
- •А.И.ОРЕХОВА, Р.П.ЛЕЛЕКОВА
- •Расчет числа атомных орбиталей на подуровнях
- •Способы выражения концентрации растворов
- •Приготовление растворов путем разведения
- •Потенциометрия
- •Потенциалы. Электроды. Гальванические элементы
- •Типы окислительно-восстановительных реакций
- •Вещество
- •Вещество
- •Вещество
- •Вещество
- •Вещество
- •Таблица 11
- •СРЕДНИЕ ЗНАЧЕНИЯ рН РАЗЛИЧНЫХ СИСТЕМ
- •Таблица 13
- •Биологическая жидкость
- •Плазма крови
- •КОНСТАНТЫ НЕКОТОРЫХ РАСТВОРИТЕЛЕЙ
- •Биосубстрат
- •Жировая ткань
- •Элемент
- •Элемент

2. ЭЛЕКТРОННОЕ СТРОЕНИЕ АТОМОВ. ХИМИЧЕСКАЯ СВЯЗЬ
Любое устойчивое состояние электрона в атоме характеризуется определенными значениями квантовых чисел: n, l, ml, ms, называемых соответственно: главное, орбитальное, магнитное и спиновое.
Состояние электрона в атоме, отвечающее определенным значениям квантовых чисел n, ℓ, ml, называется атомной орбиталью (а.о.). Иначе, атомная орбиталь – это пространство, где наиболее вероятно пребывание электрона.
В зависимости от значения орбитального квантового числа принято следующее обозначение энергетических подуровней:
ℓ = 0 |
– s подуровень (п/у) |
|
ℓ = 1 |
– p |
-*- |
ℓ= 2 – d -*- ℓ= 3 – f -*-
Каждому типу атомной орбитали соответствует своя форма электронного облака. S – орбиталь сферической формы, р – орбиталь гантелеобразная, d – орбиталь имеет вид розетки, f – орбиталь еще более сложной формы.
Число орбиталей каждого типа определяется числом способов ориентации их в пространстве, т.е. количеством значений магнитного квантового числа – ml . Магнитное квантовое число имеет (2ℓ + 1) значений
(табл. 2.1).
|
Расчет числа атомных орбиталей на подуровнях |
Таблица 2.1 |
|||
|
|
|
|||
|
Обозначение |
|
Кол-во знач. |
|
Кол-во |
|
подуровня |
|
ml |
|
а.о. |
0 |
s |
0 |
1 |
|
1 |
1 |
p |
-1;0; + 1 |
3 |
|
3 |
2 |
d |
-2;-1;0; + 1; + 2 |
5 |
|
5 |
3 |
f |
-3;-2;-1;0; + 1;+2;+3 |
7 |
|
7 |
Графически атомная орбиталь изображается  или ― . Количество (z) атомных орбиталей на энергетическом уровне определяется формулой za.o. = n2, где n – главное квантовое число.
или ― . Количество (z) атомных орбиталей на энергетическом уровне определяется формулой za.o. = n2, где n – главное квантовое число.
Согласно принципу Паули в атоме не может быть двух электронов, характеризующихся одинаковым набором квантовых чисел. Из этого следует, что каждая атомная орбиталь может быть занята не более чем двумя электронами, причем их спиновые квантовые числа должны быть различными, что обозначается ↑↓.
15
Таким образом, общее число электронов на энергетическом уровне определяется по формуле ze = 2n2. Количество электронов на подуровне определяется формулой 2(2ℓ + 1). Расчет числа электронов и структуру уровней можно представить в виде табл. 2.2.
Зная структуру каждого подуровня и уровня, можно составить электронные формулы элементов.
Устойчивому (невозбужденному) состоянию многоэлектронного атома отвечает такое распределение электронов по атомным орбиталям, при котором энергия атома минимальна. Поэтому атомные орбитали заполняются в порядке последовательного возрастания их энергий. Порядок заполнения электронами атомных орбиталей определяется правилами Клечковского, которые учитывают зависимость энергии орбитали от значений как главного (n), так и орбитального (ℓ) квантовых чисел. Согласно этим правилам атомные орбитали заполняются электронами в порядке последовательного увеличения суммы (n+1) (первое правило Клечковского), а при одинаковых значениях этой суммы – в порядке последовательного возрастания главного числа n (второе правило Клечковского).
Размещение электронов по атомным орбиталям в пределах одного энергетического подуровня определяется правилом Гунда, согласно которому минимальной энергии атома соответствует такое распределение электронов по атомным орбиталям данного подуровня, при котором абсолютное значение суммарного спина атома максимально; при любом другом размещении электронов атом будет находиться в возбужденном состоянии, т.е. будет характеризоваться более высокой энергией.
Задачи и упражнения
2.1. Как обозначается состояние электрона: а) с n=4, ℓ=2; б) с n=5, ℓ=3.
Р е ш е н и е: При записи энергетического состояния цифрой указывают номер подуровня (n), а буквой – характер подуровня (s, p, d, f). При n=4 и ℓ=2 записываем 4d; при n=5 и ℓ=3 записываем 5f.
Таблица 2.2
Расчет числа электронов
n |
ℓ |
Обозначение |
Ze = 2(2ℓ + 1) |
Ze = 2n2 |
Структура |
|||
|
|
подуровня |
|
|
|
|
уровня |
|
1 |
0 |
(s) |
2(2·0 + 1) = |
2 |
2·12 |
= 2 |
s2 |
|
2 |
0 |
(s) |
2(2·0 + 1) = |
2 |
2·22 |
= 8 |
s2p6 |
|
1 |
(p) |
2(2·1 + 1) = |
6 |
|||||
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
16
Окончание табл. 2.2
n |
ℓ |
Обозначение |
Ze = 2(2ℓ + 1) |
Ze = 2n2 |
Структура |
|||||||
|
|
подуровня |
|
|
|
|
|
|
уровня |
|||
|
0 |
(s) |
2(2·0 + 1) = |
2 |
|
|
|
|
|
|
|
|
3 |
1 |
(p) |
2(2·1 + 1) = |
6 |
2·3 |
3 |
= 18 |
2 |
6 |
d |
10 |
|
2 |
(d) |
2(2·2 + 1) = 10 |
|
s |
p |
|
||||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
(s) |
2(2·0 + 1) |
= |
2 |
|
|
|
|
|
|
|
4 |
1 |
(p) |
2(2·1 + 1) |
= |
6 |
2·42 = 32 |
s2p6d10f14 |
|||||
2 |
(d) |
2(2·2 + 1) |
= 10 |
|||||||||
|
3 |
(f) |
2(2·3 + 1) |
= 14 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2.2. Сколько всего орбиталей соответствует третьему энергетическому уровню? Сколько электронов на этом уровне? На сколько подуровней расщепляется этот уровень?
Р е ш е н и е: Для третьего энергетического уровня n = 3, количество атомных орбиталей 9 (32); это количество орбиталей является суммой 1(s) + 3(p) + 5(d) = 9. По принципу Паули количество электронов на этом уровне 18. Третий энергетический уровень расщепляется на три подуровня: s, p, d (количество подуровней совпадает с числом значений главного квантового числа).
Все химические элементы можно классифицировать в зависимости от характера заполняемых подуровней на 4 типа:
s- элементы – заполняют электронами ns – подуровень; p- элементы – заполняют электронами np – подуровень; d- элементы – заполняют электронами (n-1)d – подуровень; f- элементы – заполняют электронами (n-2)f – подуровень.
Для написания электронной формулы элемента необходимо: арабской цифрой указать номер энергетического уровня, написать буквенное значение подуровня, количество электронов записать в виде показателя степени.
Например: 26 FeIV 1s22s22p63s23p64s23d6.
Электронная формула составлена с учетом конкуренции подуровней, т.е. правила минимума энергии. Без учета последнего электронная
формула будет записываться: 26 Fe1V 1s22s22p63s23p63d64s2. Максимальная валентность элемента определяется количеством валентных орбиталей и зависит от электронного типа элемента и номера периода.
Электронная структура элементов по периодам и максимальная валентность представлены в табл. 2.3.
17
Таблица 2.3 Электронная структура и максимальная валентность элементов
Пери- |
|
|
|
|
|
|
|
|
Валентные |
Валент- |
Элект- |
|||||
Структура |
|
|
|
|
|
|
|
ронный |
||||||||
од |
|
|
|
|
|
|
|
|
орбитали |
ность |
тип |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
I |
1s1-2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
s |
1s |
|
|
|
|
|
|
||||||||||
П |
1s22s1-22p1-6 |
|
|
|
|
|
|
|
|
2p |
4 |
s, p |
||||
|
|
|
2s |
|
|
|
|
|
|
|
|
|
||||
|
1s22s22p63s1-2 |
|
|
|
|
|
|
|
|
|
|
|
|
3d ) |
|
|
Ш |
|
|
|
|
|
|
|
|
3р |
6 |
s, p |
|||||
|
3p1-6 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
3s |
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4d ) |
|
|
|
1s22s22p63s23p6 |
|
|
|
|
|
|
|
|
4p |
6 |
s, p |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
4s |
|
|
|
|
|
|
|
|
|||||||
IV |
4s1-23d1-104p1-6 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4p |
9 |
d |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
3d |
|
|
|
|
|
|
|
|
||||||
|
|
4s |
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5d ) |
8 |
s, p |
|
1s22s22p63s23p6 |
|
|
|
|
|
|
|
|
5p |
|
|
||||
|
|
5s |
|
|
|
|
|
|
|
|
|
|
||||
V |
4s23d104p65s1-2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
4d1-105p1-6 |
|
|
|
|
|
|
|
|
|
|
|
|
5p |
9 |
d |
|
|
|
4d |
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
5s |
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6f ) |
|
|
|
1s22s22p63s23p6 |
|
|
|
|
|
|
|
|
|
|
|
|
6d ) |
8 |
s, p |
|
4s23d104p65s2 |
|
|
|
|
|
|
|
6p |
|
|
|||||
VI |
4d105p66s1-10 |
|
|
|
|
|
|
|
|
|
|
|
||||
6s |
|
|
|
|
|
|
|
|
||||||||
|
5d14f1-145d2-10 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6p1-6 |
|
|
|
|
|
|
|
|
|
|
|
|
6p |
9 |
d |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
5d |
|
|
|
|
|
|
|
|||||||
|
|
|
|
6s |
|
|
||||||||||
|
|
|
|
|
|
|
|
|
18 |
|
|
|
|
|||
2.3.Какой подуровень заполняется в атоме электронами после заполнения подуровня: а) 4р; б) 4s?
Ре ш е н и е: а) Подуровню 4р отвечает сумма (n + l), равная 4+1 = 5. Такой же суммой n+l характеризуются подуровни 3d (3+2 = 5)
и5s (5+0 = 5). Однако состоянию 3d отвечает меньшее значение n (n = 3), чем состоянию 4р, поэтому подуровень 3d будет заполняться раньше, чем подуровень 4р. Следовательно, после заполнения подуровня 4р будет заполняться подуровень 5s, которому отвечает на единицу большее значение n (n=5).
б) подуровню 4s соответствует сумма n+l = 4+0 = 4. Такой же суммой n+l характеризуется подуровень 3р, но заполнение этого подуровня предшествует заполнению подуровня 4s, т.к. последнему отвечает большее значение главного квантового числа. Следовательно, после подуровня 4s будет заполняться подуровень с суммой (n+l) = 5, причем, из всех возможных комбинаций n+ℓ , соответствующих этой сумме (n=3, ℓ=2; n=4, ℓ=1; n=5, ℓ=0), первой будет реализовываться комбинация с наименьшим значением главного квантового числа, т.е. вслед за подуровнем 4s будет заполняться подуровень 3d.
Вывод: Таким образом, заполнение подуровня d отстает на один квантовый уровень, заполнение подуровня f отстает на два квантовых уровня.
2.4.Электронная структура атома описывается формулой 1s22s22p63s23d74s2. Какой это элемент?
Ре ш е н и е: Этот элемент принадлежит к электронному типу
d-элементов 1У периода, т.к. происходит застройка электронами 3d подуровня; число электронов 3d7 свидетельствует о том, что это седьмой элемент по порядку. Общее число электронов 27, значит порядковый номер 27. Этот элемент – кобальт.
2.5.На каком основании фосфор и ванадий располагают в одной группе периодической системы? Почему их помещают в разных подгруппах?
Ре ш е н и е: Электронные конфигурации атомов Р 1s22s22p33s23p3; V 1s22s22p63s23p64s23d3. В них подчеркнуты валентные электроны.
Валентных электронов у этих элементов одинаковое количество – 5. Поэтому Р и V расположены в одной 5 группе. В то же время эти элементы не являются электронными аналогами, т.к. застраивают разные подуровни, значит не должны размещаться в одной подгруппе.
Химическая связь – это результат квантово-механического взаимодействия электронов.
19
По характеру распределения электронной плотности между атомами химические связи подразделяются на ковалентные неполярные, полярные и ионные (металлическая связь, реализуемая в металлах, здесь не рассматривается). Если смещение пары электронов отсутствует, то связь приближается к ковалентной неполярной. Ковалентная полярная связь осуществляется общей парой электронов, смещенной (поляризованной) к ядру одного из атомов-партнеров. Ионная связь рассматривается как предельно поляризованная ковалентная связь. Для оценки способности атома данного элемента оттягивать к себе общую электронную пару пользуются значением относительной электроотрицательности (χ) (табл. 5). Чем больше разность электроотрицательностей (Δχ), тем больше поляризация связи (тем выше ионность связи). Считают, что, если Δχ > 1,9 , то связь ионная.
2.6. Вычислите разность относительных электроотрицательностей атомов для связей Н-О и Э-О в соединениях Э(ОН)2, где Э – элементы Са, Sr, Ba, и определите:
а) какая связь Н-О или Э-О характеризуется в каждой молекуле большей степенью ионности; б) каков характер ионизации этих молекул в водном растворе?
Р е ш е н и е: а) Вычислим Δχ для связи Э-О и Н-О:
Δχ Са-О = 3,5 - 1,04 = 2,46 ΔχSr-O = 3,5 - 0,99 = 2,51 Δχ Ba-O = 3,5 - 0,90 = 2,60 Δχ H-O = 3,5 - 2,1 = 1,4
Из сравнения Δχ видим, что связь Э-О можно считать ионной, связь Н-О – полярной.
б) ионизация в водных растворах будет осуществляться по наиболее ионной связи, т.е. по схеме: Э(ОН)2 ↔ Э2+ + 2ОН- (по типу
оснований).
Прочность химической связи характеризуется энергией (кДж/моль) и
о
длиной (нм илиА) связи. Чем выше энергия связи и меньше ее длина, тем связь прочнее.
Химическая связь, т.е. общая электронная пара, может образоваться двумя способами: по обменному и донорно-акцепторному механизму. Химическая связь характеризуется тремя основными свойствами:
1)имеет определенное направление в пространстве. С этой точки зрения различают σ и π-связи. Угол, образованный направлениями двух σ-связей, называется валентным. Если π-связь объединяет несколько атомов, она называется нелокализованной;
2)стремится к насыщаемости, вследствие чего частицы имеют определенный состав и структуру. Возможны: координационно-
20
ненасыщенное, координационно-насыщенное, валентно-насыщен- ное и валентно-ненасыщенное состояние атомов;
3)может поляризоваться под действием различных факторов (в зависимости от электроотрицательности атомов, а также под действием внешнего электрического или магнитного поля, при действии других полярных молекул).
Для объяснения геометрической структуру молекул используют представление о гибридизации атомных орбиталей центрального атома. Согласно этому представлению, образованию σ-связей предшествует изменение формы и энергии атомных орбиталей. Образуются гибридные орбитали, способные к более глубокому перекрыванию и, следовательно, к образованию более прочных связей. У элементов s и р электронного типа в гибридизации могут принимать участие орбитали, включающие неподеленные электронные пары.
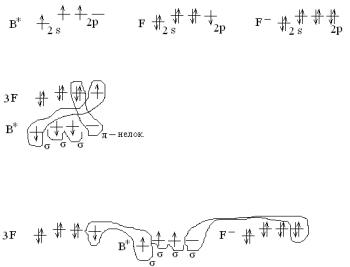
2.7. Покажите образование связи в молекуле BF3 и ионе BF4-. Объясните строение указанных частиц.
Р е ш е н и е: 1. Составим электронные формулы атомов и ио-
нов: B 1s22s22p1; F 1s22s22p5; F- 1s22s22p6.
2. Покажем распределение электронов по валентным орбиталям. При этом учтем степень окисления атома бора в соединении (условно можно считать, что число неспаренных электронов в атоме соответствует степени окисления).
3. Покажем образование всех возможных связей, укажем механизм их образования:
Образовалось 3 σ-связи по обменному механизму Исходя из валентных возможностей атома
бора и его стремления к насыщаемости, покажем образование π-связи по донорноакцепторному механизму. Но, т.к. эта связь объединяет более двух ато-
мов, она будет нелокализованной.
В ионе BF4- образуется 4 σ-связи, из них три по обменному и одна – по донорно-акцепторному механизму.
21
4.Рассчитаем кратность связи как отношение общего числа связей к числу σ-связей. В молекуле BF3 кратность связи 1⅓, в ионе BF4- - кратность связи 1.
5.Определим состояние центрального атома с точки зрения насыщае-
мости. В молекуле BF3 проявлена максимальная валентность за счет σ и π-связей, следовательно, состояние атома бора валентно-насыщенное.
Вионе BF4- проявлена максимальная валентность за счет σ-связей, следовательно, состояние атома бора координационно-насыщенное.
6.Определим характер связи В-F с точки зрения полярности. Т.к. различие в величине электроотрицательности (Δχ) составляет 4,0-2,0 = 2,0, т.е. больше 1,9 связь можно считать ионной.
7.Определим тип гибридизации атомных орбиталей центрального атома и геометрическую форму частиц.
Вмолекуле BF3 в образовании σ-связей участвуют s и 2р-орбитали, следовательно, тип гибридизации sp2. Молекула имеет треугольную
структуру. В ионе BF4- в образовании σ-связей участвуют одна s и три р-орбитали, следовательно, тип гибридизации sp3. Ион имеет тетраэдрическую форму.
8.Изобразим графически строение частиц
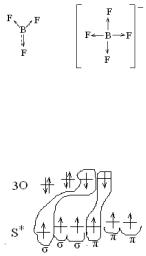
2.8. Покажите образование связей в молекуле SO3, объясните строение молекулы.
Р е ш е н и е: Электронные формулы элементов
S 1s22s22p63s23p4 O 1s22s22p4.
Т.к. степень окисления атома серы +6, покажем распределение электронов по валентным орбиталям у возбужденного атома серы.
Атом серы образует по обменному механизму 3 σ-связи (за счет одной s и двух р-атомных орбиталей) и 3 π-связи (за счет одной р- и двух d-атомных орбиталей).
Следовательно, атом валентно-насыщен, координационно-ненасыщен; кратность связи 6/3 = 2. Связь S-O полярная, общие электронные пары смещены к кислороду (Δχ = 0,5). Тип гибридизации sp2. Молекула имеет строение треугольника.
22

3. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
Комплексные соединения играют важную роль в жизнедеятельности живых организмов. Ионы Na, K, Ca, Mg, выполняющие в организме важные физиологические функции, находятся в крови, лимфе, тканевых жидкостях в виде комплексных соединений. Ионы Fe, Zn, Mn, Cu образуют комплексные соединения с белками и входят в состав ферментов, витаминов. Железо входит в состав гемоглобина. Гемоглобин представляет соединение между белком-глобином и комплексомгемом. В геме центральным ионом является Fe2+.
Комплексными соединениями называют молекулярные соединения, сочетание компонентов которых приводит к образованию сложных ионов, способных к свободному существованию как в кристалле, так и в растворе. В молекулах комплексных соединений различают внутреннюю и внешнюю сферы. Внутренняя сфера заключается в квадратные скобки и состоит из центрального атома или иона, называемого комплексообразователем, и скоординированных вокруг него атомов, ионов или молекул, называемых лигандами.
Количество лигандов, скоординированных вокруг комплексообразователя, определяют его координационное число (к.ч.). Последнее показывает количество σ-связей, возникающих между к.о. и лигандами.
Связь между к.ч. |
к.о. и его степенью окисления |
||
Степень окисления |
|
К.ч. к.о. |
Примеры |
+1 |
|
2 |
[Ag(NH3)2]Cl |
+2 |
|
4 |
[Cu(H2O)4]Cl2 |
+3 |
|
6 |
K3[Fe(CN)6] |
+4 |
|
6 |
H2[PtCl6] |
Молекула к.с. электронейтральна. Заряд внутренней сферы равен заряду внешней с обратным знаком. Заряд комплексного иона равен алгебраической сумме зарядов к.о. и лигандов.
23
Классификация комплексных соединений
1.По характеру заряда комплексного иона
-катионные: образуются за счет координации вокруг положительно заряженного к.о. нейтральных молекул лигандов
[Zn(NH3)4]Cl2 ; [Al(H2O)6]Cl3;
-анионные: комплексообразователь – положительные ионы, ли-
ганды – анионы K2[BeF4]; Na2[SiF6];
-нейтральные: образуются при координации вокруг нейтрального к.о. нейтральных лигандов [Fe(CO)5]o или при одновременной координации вокруг положительно заряженного к.о.
отрицательно заряженных и нейтральных лигандов
[Co(NH3)3Cl3]o.
2.По природе лигандов
- гидраты или аквакомплексы [Cr(H2O)6]Cl3;
-аммиакаты [Cu(NH3)4]SO4;
-ацидокомплексы K2[HgI4];
-гидроксокомплексы Na[Al(OH)4].
3.По количеству к.о.
-моноядерные [Pt(NH3)4]Cl2;
-полиядерные [(NH3)4 Co\/OHOH /\ Co(NH3)4 ]Cl4 .
Правила составления названий комплексных соединений
1)название к.с. начинают с катиона;
2)в названии комплексного иона сначала указывают лиганды, затем центральный атом. К названиям анионных лигандов добавляют окончание «о», молекулярные лиганды называют как
соответствующие свободные молекулы. Исключение: NH3 – аммин; Н2О – аква; СО – карбонил;
3)комплексообразователь в катионных и нейтральных к.с. называют русским названием элемента, в анионных – латинским названием с добавлением окончания «ат»;
4)степень окисления к.о. обозначают арабской цифрой и ставят в
скобках после его названия. K3[Co(NO2)6] – калий гексанитритокобальтат (+3); [Cr(H2O)6]Cl3 – гексааквахрома (+3) хлорид; [Fe(CJ)5]o – пентакарбонил железа (0).
Поведение комплексных соединений в растворе
В растворах к.с. ведет себя как сильный электролит и диссоциирует нацело на комплексный ион и ионы внешней сферы:
[Ag(NH3)2]Cl → [Ag(NH3)2]+ + Cl-
Комплексные ионы ионизируют обратимо и ступенчато: [Ag(NH3)2]+ ↔ [Ag(NH3)2]+ + NH3
24
[Ag(NH3)2]+ ↔ Ag+ + NH3 или суммарно: [Ag(NH3)2]+ ↔ Ag+ + 2NH3
Константа равновесия ионизации комплексного иона называется константой нестойкости
Кнест. = |
[Ag+ ][NH3]2 |
[[Ag(NH3)2 ]+ ] |
Она зависит только от природы соединения и температуры; приводится в справочниках (см. табл. 6).
25

4. ХИМИЧЕСКОЕ РАВНОВЕСИЕ
Химическим равновесием называют состояние, которому соответствует равенство скоростей прямой и обратной реакций:
V = V
При этом изменение энергии Гиббса равно нулю
Go = O; ΔΗο = T So
Состояние химического равновесия остается неизменным при постоянстве внешних условий. При изменении этих условий (температуры, давления, концентраций) равновесие нарушается с тем, чтобы восстановиться вновь, но уже при новых условиях.
Смещение равновесия подчиняется принципу Ле-Шателье: если в равновесной системе изменить одно из условий, определяющих положение равновесия, то равновесие смещается в направлении того процесса, который ослабляет эффект воздействия. Так, с увеличением концентрации реагентов равновесие смещается в сторону процесса, который вызовет расход этих реагентов. Причина такого поведения равновесной системы заключается в росте числа столкновений частиц указанных реагентов, что вызывает ускорение прямой или обратной реакции.
В газовых системах увеличение концентраций реагентов происходит при возрастании давления или уменьшении объема системы. Поэтому с увеличением общего давления в системе быстрей пойдет та из двух обратимых реакций, которая происходит с участием большего числа молей газа, т.е. равновесие смещается в сторону образования меньшего числа молей.
При повышении температуры растет скорость и прямой, и обратной реакции, но в большей степени возрастает скорость эндотермической
реакции, т.к. она характеризуется более высоким температурным коэффициентом.
Задачи и упражнения
4.1. Покажите направление смещения равновесия при уменьшении концентрации Н2 в равновесной системе:
СО + Н2О↔ СО2 + Н2 Р е ш е н и е: С уменьшением СН2 , согласно принципу Ле-
Шателье, должна преобладать прямая реакция, т.к. при этом будет расти количество Н2, и равновесие снова восстановится.
4.2. В каком направлении сместится равновесие РС15 ↔ РС13 + С12- 31 кДж·моль-1 при повышении температуры и давления?
Р е ш е н и е: С ростом температуры равновесие сместится вправо, т.к. прямая реакция идет с поглощением тепла, т.е. является
26

эндотермической. При увеличении давления число столкновений молекул РС13 и С12 будет больше, чем РС15, поэтому равновесие будет смещаться влево.
4.3. При каких условиях в равновесной системе
N2 г + 3Н2 г ↔ 2NH3 г + 22 кДж·моль-1 можно максимально увеличить выход NH3?
Р е ш е н и е: Чтобы увеличить выход NH3, т.е. сместить равновесие вправо, необходимо:
1)повысить давление смеси газов, т.к. в этом случае возрастает скорость прямой реакции, ибо в ней участвует большее число молей;
2)увеличить концентрацию N2 и Н2 и уменьшить концентрацию NH3, выводя его из сферы реакции;
3)понизить температуру реакционной смеси, т.к. реакция об-
разования NH3 является экзотермической.
Количественной характеристикой состояния химического равновесия служит константа равновесия, которая отражает закон действующих масс.
Константа равновесия связана с энергией Гиббса соотношением RTlnK
=-∆Gо. Для процесса аА + bВ ↔ сС + dD концентрационная константа
равновесия имеет вид: Кс = [C]c[D]d , где [A], [B], [C], [D] – равновес- [A]a[B]b
ные концентрации в моль/л; а, b, c, d – стехиометрические коэффициенты.
|
|
|
P |
c P |
d |
|
|
Для газовых систем записывают константу K |
p |
= |
C |
D |
|
, где Р – |
|
P |
a P |
b |
|||||
|
|
|
|||||
|
|
|
A |
B |
|
|
парциальные давления газов и смеси.
Константы Кс и Кр характеризуют равновесные процессы в разбавленных растворах электролитов и неэлектролитов и в газовых системах при давлениях, близких к 101,3 кРа (идеальные газы).
Для концентрированных растворов и неидеальных газов следует пользоваться величинами активностей:
Ka = aCc aDd aAa aBb
Константа равновесия зависит от природы реагентов и температуры, но не зависит от концентраций компонентов равновесной системы.
В гетерогенных системах концентрация твердой фазы входит в величину константы равновесия, т.к. является величиной постоянной.
27
Если реакции протекают в водных растворах с участием воды, то концентрация воды велика и постоянна и практически не будет влиять на состояние равновесия.
Запишем константы равновесия процессов: 4НС1г + О2 г ↔ 2Н2Ог + 2С12 г
K |
|
= |
[H |
2 |
O]2 |
[Cl |
2 |
]2 |
; |
K |
|
= |
PН2 |
О |
PС21 |
c |
|
|
|
|
P |
2 |
|
2 |
|||||||
[HCl]4 [O |
2 |
] |
P4 |
|
P |
||||||||||
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
НС1 |
O2 |
||
C6H12O6 p-p ↔ 2C2H5OHp-p + 2CO2 г
Kc = |
[C2H5OH]2 [CO2 ]2 |
|
|||
|
|
[C6H12O6 ] |
|||
CuSO4 p-p + Fekp ↔ Cukp + FeSO4 p-p |
|||||
|
KC |
= |
[FeSO4 ] |
|
|
|
[CuSO4 ] |
||||
|
|
|
|||
При решении задач следует четко определить агрегатное состояние реагирующих веществ, а также отличать исходные концентрации веществ от равновесных.
Сравновесная = Сисходная - Сизрасходованная
4.4. В сосуде емкостью 1 л при 410оС смешали 1 моль Н2 и 1 моль I2. Вычислите, при каких концентрациях устанавливается химическое равновесие, если константа равновесия равна 48?
Р е ш е н и е: H2 + I2 ↔ 2HI
Примем, что в реакции израсходовано по Х молей Н2 и I2. Тогда образовалось 2Х молей HI, т.е. HI = 2 моль/л. В этом случае [H2] = [I2] =
= 1 - X. Запишем: Кс = |
[HI]2 |
= |
(2x)2 |
= 48 |
|
[H2 ][I2 ] |
(1−x)2 |
||||
|
|
|
Получим уравнение: 44Х2 – 96Х + 48 = 0 Решая его, получим Х = 0,776. Рассчитаем равновесные концентрации: HI = 2X = 2·0,776 = 1,552 моль/л
[H2] = [I2] = 1 - X = 0,222 моль/л.
4.5. В обратимой реакции СО + С12 ↔ СОС12 установились следующие равновесные концентрации (моль/л): [CO] = 0,1; [Cl2] = 0,4; [COCl2] = 4. Вычислите Кравн. и исходные концентрации С12 и СО.
Р е ш е н и е: K = |
[COCl2 ] |
= |
4 |
=100 |
|
[CO][Cl2 ] |
0,10,4 |
||||
|
|
|
28

Находим исходные концентрации: Сисх. = Сравн. + Сизрасх.. Для образования 4 моль СОС12, согласно уравнению реакции, израсходовано по 4
моль СО и С12. Отсюда исходные концентрации равны: ССО = 0,1 + 4 = = 4,1 моль/л; СС12 = 0,4 + 4 = 4,4 моль/л.
4.6. Определите объемный состав смеси в момент равновесия для реакции Сграфит + О2 г ↔ СО2 г, если при 1300оС Кравн. = 0,289.
Ре ш е н и е: Кр = РРСО2
О2
Обозначим через Х содержание СО2 в объемных долях (процентах). Тогда содержание О2 составит (100-Х). Подставим в уравнение:
К = 0,289 = (100Х−Х) ; Х = 22,42 об.%. Содержание О2 составит
77,58 %.
29

5. ХИМИЧЕСКАЯ КИНЕТИКА
Химическая кинетика изучает скорость и механизм протекания химических реакций, а также влияние различных факторов на скорость. Среднюю скорость химической реакции измеряют изменением концентрации реагирующих веществ в единицу времени:
V = ± C2 −C1 ,
τ2 −τ1
где С2 и С1 – концентрации веществ (моль/л), соответствующие времени τ2 и τ1 ( в с или мин). Для гетерогенных систем скорость измеряют
изменением концентрации на единицу поверхности твердой фазы (1 см2 или 1 м2).
Скорость химической реакции зависит от следующих основных факторов:
-природы и состояния реагирующих веществ;
-характера среды, в которой протекает реакция;
-катализатора;
-концентрации реагирующих веществ, а для газов и давления;
-температуры.
Химическая активность веществ зависит от строения атомов или молекул, характера внутримолекулярных и межмолекулярных связей. Наибольшей активностью обладают радикалы, несколько она ниже у ионов и молекул. Немаловажное значение имеют также и агрегатное состояние реагентов, степень дисперсности.
Практически всегда вещества реагируют со средой (растворителем), образуя сольваты (гидраты). Кроме того, растворитель может оказывать каталитическое действие.
Катализаторы, как правило, ускоряют химические реакции за счет изменения их пути. При этом новому пути реакции соответствует более низкая энергия активации. Энергией активации (Еа) называют минимальную энергию, которой должны обладать частицы реагирующих веществ для осуществления взаимодействия. Величина Еа определяется химической природой веществ.
Влияние концентрации, давления и температуры на скорость химической реакции поддается количественной оценке.
Закон действующих масс выражает зависимость скорости химической реакции от концентрации реагирующих веществ: скорость реакции прямо пропорциональна концентрациям реагирующих веществ, возведенным в степени их стехиометрических коэффициентов. Для реакции
аА + вВ → С V = KCAaCBb ,
30

где СА и СВ – молярные концентрации реагентов А и В;
аи b – стехиометрические коэффициенты при А и В;
К– константа скорости данной реакции, отражающая влияние природы веществ. Она зависит от температуры, но не зависит от концентрации веществ.
Для газовых систем вместо концентраций можно пользоваться величи-
нами парциальных давлений: V = KPAaPBb .
В гетерогенных системах концентрации кристаллических веществ являются величинами постоянными и входят в константу скорости. Причину роста скорости реакции при увеличении концентраций реагирующих веществ можно объяснить увеличением общего числа столкновений частиц, а значит и увеличением числа активных столкновений. Запишем выражения для скорости следующих реакций:
а) 2Н2 г + О2 г = 2Н2Ог
V = KC |
2C |
O2 |
или |
V = KP |
2P |
|
|
H2 |
|
H2 |
O2 |
|
|
б) СаОкр + СО2 г = СаСО3 кр |
|
|
||||
V = KCCO2 |
или |
V = KPCO2 |
|
|
||
в) FeCl3 р-р + 3KSCN p-p = Fe(SCN)3 p-p |
V = KCFeCl3 C3KSCN |
|||||
г) 2AgCO3 кр |
|
to |
|
|
V = K |
|
→2Ag кр + 2CO2 г + O2 г |
||||||
Закон действующих масс справедлив только для простых реакций с небольшим порядком и молекулярностью.
Под порядком реакции понимают сумму показателей степеней при концентрациях в выражении закона действующих масс. Молекулярность реакции определяется минимальным числом молекул, участвующих в акте взаимодействия. По признаку молекулярности реакции делят на одномолекулярные (мономолекулярные), двухмолекулярные (бимолекулярные) и трехмолекулярные (тримолекулярные). Реакции более высокой молекулярности встречаются редко, т.к. такие реакции идут в несколько стадий.
К одномолекулярным реакциям относят реакции разложения и внутримолекулярных перегруппировок, для них V = K·C. К двухмолекулярным реакциям относят реакции, в которых взаимодействие происходит при столкновении двух молекул, для них V = K·C1·C2; для трехмолекулярных реакций V = K·C1·C2·C3 . По признаку порядка реакции бывают первого, второго и третьего порядка, а также нулевого и дробного.
Для реакции: |
|
первого порядка |
V = K·C; |
второго порядка |
V = K·C2, V = K·C1·C2; |
31
третьего порядка V = K·C3, V = K·C12·C2 , V = K·C1·C22.
Реакции имеют нулевой порядок, если во все время процесса концентрация вещества не изменяется и скорость – постоянная величина. Это возможно в гетерогенных системах, где кристаллическое вещество взаимодействует с поверхности, и концентрация остается постоянной величиной. Для реакции нулевого порядка V = K·Co. Реакция имеет дробный порядок, если процесс происходит в несколько стадий, каждая из которых имеет незначительную скорость.
Задачи и упражнения
5.1. Определите молекулярность и порядок реакции:
С12 г + 2NO г = 2NOCl г
Р е ш е н и е: В реакцию вступают 1 моль С12 и 2 моля NO, следовательно, указанная реакция - тримолекулярная. Порядок опреде-
ляем по уравнению: V = KCCl2 C2NO . Реакция – третьего порядка.
5.2. Рассчитайте скорость растворения гидроксида железа (II) в 0,02 М H2SO4 при К = 40. Определите молекулярность и порядок реакции.
Р е ш е н и е: Реакция пойдет согласно уравнению:
Fe(OH)2 кр + H2SO4 p-p = FeSO4 p-p + 2H2O ж
V = KCH2SO4 , т.к. Fe(OH)2 находится в кристаллической фазе. Молекулярность реакции равна 2, порядок 1. Рассчитаем скорость реакции:
V= 40·0,02 = 0,8 моль/мин·л.
5.3.В растворе, содержащем 1 моль SnCl2 и 2 моля FeCl3, протекает реакция по уравнению:
SnCl2 p + 2FeCl3 p ↔ SnCl4 p + 2FeCl2 p
Во сколько раз уменьшится скорость реакции после того, как прореаги-
рует 0,65 моль SnCl2?
Р е ш е н и е: Рассчитаем скорость реакции в начальный
момент: |
|
Vo = К CSnCl2 CFeCl2 |
3 = K·1·22 = 4K |
После того, как прореагировало 0,65 моль SnCl2, концентрации будут
иметь следующие значения: СSnCl2 = 1 - 0,65 = 0,35 моль/л; СFeCl3 = = 2 - 1,3 = 0,7 моль/л. При этом скорость реакции будет равна:
V1 = K·0,35·0,72 = 0,17 K.
Отношение скоростей |
Vo |
= |
4K |
= 23 раза. |
|
V |
0,17K |
||||
|
|
|
|||
|
1 |
|
|
|
5.4. Как изменится скорость реакции СО г + С12 г = СОС12 г, если объем газовой смеси уменьшить вдвое?
32
Р е ш е н и е: Начальная скорость реакции будет равна:
Vo = K·CCO· СС12 . С уменьшением объема в два раза концентрации всех
компонентов увеличатся вдвое и скорость можно рассчитать так: V1 = K 2CCO 2CCl2 = 4KCCO CCl2
Совершенно очевидно, что с уменьшением объема в 2 раза скорость реакции возрастает в 4 раза.
Влияние температуры на скорость химической реакции также оценивают количественно. С ростом температуры скорость любых реакций увеличивается, что объясняется увеличением числа активных частиц, энергия которых достигает или превышает энергию активации Еа. Зависимость константы скорости реакции от температуры выражается
уравнением Аррениуса: 2 ,303 lg |
K 1 |
= |
E a |
( |
1 |
− |
1 |
) . |
|
K 2 |
R |
|
|
||||||
|
|
|
|
T1 |
T 2 |
||||
Здесь К1 и К2 |
– константы скорости данной реакции для абсолютных |
||||||||
|
температур Т1 и Т2; |
|
|
|
|
|
|
|
|
Еа |
– энергия активации; |
|
|
|
|
|
|
|
|
R |
– газовая постоянная. |
|
|
|
|
|
|
|
|
На практике для расчетов пользуются правилом Вант-Гоффа, согласно которому при повышении температуры на 10о скорость или константа скорости реакции возрастает в 2-4 раза.
|
|
Vt2 |
|
Kt2 |
|
t 2 −t1 |
|
|
|
|
= |
= γ 10 , |
|||||
|
|
V |
|
K |
t1 |
|
|
|
|
|
t1 |
|
|
|
|
|
|
где Vt1 и Vt2 |
– скорости реакции при температурах t1 и t2; |
|||||||
Kt1, Kt2 |
– константы скорости; |
|
|
|
||||
γ– температурный коэффициент.
Правило Вант-Гоффа дает менее точные результаты, чем уравнение Аррениуса, т.к. γ можно считать постоянным только в небольшом температурном интервале. Для неорганических реакций γ = 2-4, для ферментативных γ = 7-8.
5.5. Температурный коэффициент скорости разложения HI в области температур 356-376оС равен 2. Вычислите константу скорости этой реакции при 376оС, если при 356оС она равна 8,09·10-5.
Р е ш е н и е: |
Запишем математическое выражение правила |
||||||
Вант-Гоффа: |
|
|
|
|
|
|
|
|
V376 |
|
K376 |
|
376−356 |
|
|
|
= |
= γ 10 |
|||||
|
V |
|
K |
356 |
|
|
|
356 |
|
|
|
|
|
||
Откуда К376 = γ20/10·К356 = 22·8,09·10-5 = 3,24·10-4.
33

5.6. Во сколько раз уменьшится скорость химической реакции при уменьшении температуры на 40оС, если температурный коэффициент равен 4?
40
Р е ш е н и е: Vt+40 = γ10 = 44 = 256 Vto
Таким образом, с ростом температуры на 40оС скорость реакции возрастает в 256 раз, а при снижении температуры уменьшается в то же число раз.
5.7. Ядохимикат разлагается в воде при 25оС в течение 10 суток. При какой температуре нужно выдержать отравленную воду, чтобы она через 1 час стала безвредной, если температурный коэффициент реакции разложения химиката равен 3?
Р е ш е н и е: Будем считать условную скорость величиной,
обратной времени разложения: |
|
V |
|
= |
1 |
|
и |
V |
= |
1 |
. |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
t1 |
|
τ |
|
|
t2 |
|
τ |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
Считая температуру t2 |
неизвестной, можно записать: |
||||||||||||||||||||
|
|
|
|
|
|
|
Vt |
|
|
|
τ |
|
|
t2 −t1 |
|
|
|
|
|
||
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
= |
|
1 |
= γ |
10 |
|
|
|
|
|
||||
|
|
|
|
|
|
|
V |
|
|
|
τ |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
t1 |
|
|
|
|
|
|
|
|
|
|
|
|
||
Подставим все известные величины: |
|
|
|
|
|
|
|
|
|||||||||||||
|
240 |
|
t2 −25 |
= 35 ; |
|
t2 −25 |
|
|
|
|
|
|
|
|
t2 = 75oC . |
||||||
|
= 3 10 |
|
= 5 ; |
|
|
|
|
||||||||||||||
1 |
|
|
|
|
|
|
|||||||||||||||
|
|
|
10 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
34
