
- •А.И.ОРЕХОВА, Р.П.ЛЕЛЕКОВА
- •Расчет числа атомных орбиталей на подуровнях
- •Способы выражения концентрации растворов
- •Приготовление растворов путем разведения
- •Потенциометрия
- •Потенциалы. Электроды. Гальванические элементы
- •Типы окислительно-восстановительных реакций
- •Вещество
- •Вещество
- •Вещество
- •Вещество
- •Вещество
- •Таблица 11
- •СРЕДНИЕ ЗНАЧЕНИЯ рН РАЗЛИЧНЫХ СИСТЕМ
- •Таблица 13
- •Биологическая жидкость
- •Плазма крови
- •КОНСТАНТЫ НЕКОТОРЫХ РАСТВОРИТЕЛЕЙ
- •Биосубстрат
- •Жировая ткань
- •Элемент
- •Элемент

6. РАСТВОРЫ
Способы выражения концентрации растворов
Важнейшей характеристикой раствора является концентрация, т.е. относительное содержание каждого компонента в растворе. Концентрация раствора выражается количеством растворенного вещества, содержащегося в определенной массе или в определенном объеме раствора или растворителя.
Наиболее часто употребляемые способы выражения концентрации раствора: массовая доля, моляльная, молярная, молярная концентрация эквивалента, титр, мольная доля.
Массовой долей называется количество граммов растворенного вещества, находящегося в 100 г раствора:
|
ω(х) = |
m(x) |
100 , |
|
m |
||
|
|
|
|
где ω(x) |
– массовая доля, %; |
|
|
m(x) |
– масса растворенного вещества, г; |
||
m– масса раствора, равная сумме масс растворенного вещества (m(x)) и растворителя, г.
Или: ω(х) = mρ(Vx) ,
где ρ – плотность раствора, г/мл;
V– объем раствора, мл.
6.1.Какова будет массовая доля соли в растворе, если в 450 мл воды растворить 50 г соли?
ω(х) = |
m(x) |
100; |
m(x) = 50 |
г; |
m = m(x) + mр-ля ; |
||
|
|||||||
|
m |
|
|
|
|
|
|
причем, mр-ля = 450 г, т.к. ρН2О = 1 |
г/мл, |
|
|||||
|
ω(х) = |
|
50 |
100 =10% |
|
|
|
|
50 |
+450 |
|
|
|||
|
|
|
|
|
|
||
Моляльная концентрация (моляльность) раствора определяется чис-
лом молей растворенного вещества, содержащегося в 1000 г ( 1 кг) растворителя.
|
b (x ) = |
m (x ) 1000 |
, |
|
M (x ) m р − ля |
||
|
|
|
|
где b(x) |
– моляльная концентрация, моль/кг; |
||
m(x) |
– масса растворенного вещества, г; |
||
mр-ля |
– масса растворителя, г; |
|
|
М(х) |
– молярная масса растворенного вещества, г/моль. |
||
35

|
6.2. Какова моляльность раствора KI , полученного растворе- |
|
нием 3,32 г КI в 250 мл воды? |
||
b (x ) = |
m (x ) 1000 |
|
M (x ) m р− ля |
|
|
MKI = 39 + 127 = 166 г/моль mр-ля = 250 г (т.к. ρН2О = 1 г/мл)
b(KI ) = |
3,32 |
1000 |
= 0,08 моль/г |
|
166 |
250 |
|||
|
|
Молярная концентрация (молярность) определяется числом молей |
||||
растворенного вещества, содержащихся в 1 л раствора. |
||||
С (х ) = |
|
m (x ) |
, |
|
M |
(x ) V |
|||
|
|
|||
где С(х) |
|
– молярная концентрация, моль/л; |
||
m(x) |
|
– масса растворенного вещества, г; |
||
M(x) |
|
– молярная масса растворенного вещества, г/моль; |
||
V |
|
– объем раствора, л. |
||
6.3. В 200 мл раствора содержится 12 г хлорида магния. Вы-
числите молярную концентрацию раствора. |
|||||||
С (х ) = |
|
|
m (x ) |
, |
|
||
M |
(x ) V |
|
|||||
|
|
|
|||||
М(MgCl2) = 24 + 71 = 95 г/моль |
|||||||
С(MgCl2) = |
|
12 |
= 0,63 |
моль/л |
|||
95 0,2 |
|||||||
|
|
|
|
|
|||
Молярная концентрация эквивалента (нормальная) определяется числом моль эквивалентов растворенного вещества, содержащихся в 1
лраствора:
Сэ(х) = Эm(х()x)V , моль экв/л
где Сэ(х) |
– молярная концентрация эквивалента, моль экв/л; |
Э(х) |
– молярная масса эквивалента, г/моль экв; |
V |
– объем раствора, л. |
|
6.4. Сколько граммов карбоната калия содержится в 2 л рас- |
|||
твора Сэ = 0,3 моль/л? |
|
|||
Сэ(х) = |
m(x) |
|
|
|
Э(х) V |
|
|||
|
|
|||
Отсюда: m(x) = Cэ(х)·Э(х)·V |
||||
ЭК2СО3 |
= |
39 2 +12 + 48 |
= 69 г/моль экв |
|
|
||||
|
2 |
|
||
36

m(K2CO3) = 0,3·69·2 = 41,4 г
Титр показывает массу растворенного вещества в граммах в 1 мл раствора: Т(х) = mV(x),
где Т(х) |
– титр, г/мл; |
m(x) |
– масса растворенного вещества, г; |
V |
– объем раствора, мл. |
6.5. Из 5 г медного купороса CuSO4·5H2O приготовили 100 мл раствора. Рассчитайте титр раствора медного купороса.
TCuSO4 5H2O = 1005гмл = 0,05 г/мл
Мольная доля – отношение числа молей растворенного вещества к общему числу молей в растворе.
Х(хi ) = ν(xi ) |
, |
|
|
|
|
|
|
|
||
∑ν |
|
|
|
|
|
|
|
|
|
|
где Х(хi) |
|
|
– мольная доля растворенного вещества; |
|||||||
ν(xi) |
|
|
– число молей растворенного вещества; |
|||||||
∑ν |
|
|
– число молей всех компонентов раствора. |
|||||||
6.6. Какова мольная доля хлорида натрия, если 5,85 г его рас- |
||||||||||
творено в 180 мл воды? |
|
|
|
|
||||||
|
5,85 |
|
|
0,1 |
|
|||||
Х( NaCl ) = |
|
58 ,5 |
|
= |
= 0,009 |
|||||
|
5,85 |
+ |
180 |
|
0,1 + 10 |
|||||
|
|
|
|
|||||||
|
|
|
58 ,5 |
|
18 |
|
|
|
|
|
Задач расчетного характера, в которых использовались бы различные способы выражения концентрации раствора, множество. Среди них можно выделить следующие основные типы задач: приготовление растворов определенной концентрации из заданной навески растворенного вещества; переход от одного способа выражения концентрации к другому; приготовление растворов путем разведения; состояние эквивалентности при взаимодействии растворов.
Приготовление растворов определенной концентрации
Этот тип задач сводится к расчету концентрации раствора по заданной навеске (массе) растворенного вещества или к расчету навески для получения раствора заданной концентрации по известным формулам.
6.7. Сколько уксусной кислоты и воды нужно взять, чтобы
приготовить 1 кг раствора с ω = 2 %? |
|||||
ω(х) = |
m(x) |
|
100 = |
m(x) |
100 |
m |
|
||||
|
|
m(x)+mр−ля |
|||
37

m (x ) = 1002 1 = 0 ,02 кг mр-ля = 1 – 0,02 = 0,98 кг
Переход от одного способа выражения концентрации к другому
При решении задач такого типа следует выразить массу растворенного вещества через исходную (известную) концентрацию и подставить полученное выражение в формулу для расчета определяемой концентрации.
6.8. Плотность 40 % раствора HNO3 |
равна 1,25 г/мл. Рассчи- |
||||||||
тайте молярность этого раствора. |
m (x ) 100 |
|
|
||||||
|
|
ω (х ) = |
, |
|
|||||
|
ρ V (мл ) |
||||||||
|
|
|
|
|
|||||
|
m (x ) = ω(x ) ρ V (мл ), |
||||||||
|
|
|
|
|
|
100 |
|
|
|
C(x ) = |
|
m (x ) |
|
|
= |
|
ω(x ) ρ V (мл) |
. |
|
|
M (x ) V (л) |
|
|||||||
|
|
|
100 М(х) V (л) |
||||||
Задаемся произвольным объемом раствора, например, 1 л, но представляем его в таких единицах, в каких «требует» данное выражение концентрации (для массовой доли – в мл; для молярности – в л и т.д.).
C ( HNO 3 ) = |
40 1000 |
1,25 |
= 7,94 моль / л |
|
100 1 |
63 |
|||
|
|
Приготовление растворов путем разведения
В результате разведения (разбавления) объем раствора увеличивается за счет добавления растворителя; масса растворенного вещества остается неизменной. Именно это условие лежит в основе решения задач данного типа.
m(x) в конц.р-ре = m(x) в разбавл. р-ре
6.9. Сколько литров 0,1 н H2SO4 можно приготовить из 20 мл
90 % H2SO4 (ρ = 1,82 г/мл)?
Индексация «к» и «р» обозначает величины для концентрированного и разбавленного растворов, соответственно.
Масса вещества в концентрированном растворе:
mk = ωk Vk (мл) ρk
100
Масса вещества в разбавленном растворе: mp = CЭ р·Vp(л)·ЭH2SO4
ωк Vк(мл) ρк = С |
Эр |
V (л) Э |
H2SO4 |
100 |
р |
||
|
|
|
38

Отсюда: |
V |
(л)= |
ωк Vк(мл)ρк |
= |
90 |
20 1,82 |
= 6,7 |
||
|
p |
100 |
СЭр ЭH2SO4 |
100 |
0,1 49 |
||||
|
|
|
|||||||
Состояние эквивалентности при взаимодействии растворов
По закону эквивалентов вещества взаимодействуют друг с другом равным числом моль эквивалентов: ν1э = ν2э, где ν1э и ν2э – числа моль эквивалентов.
Число моль эквивалентов вещества νэ можно рассчитать по следую-
щим формулам (1-3): νэ = |
m |
, |
(1) |
||||
|
|||||||
|
|
|
|
|
Э |
|
|
где m |
– масса вещества, г; |
Э – молярная масса эквивалента вещества, |
|||||
г/моль. |
νэ = |
Т V |
, |
|
|
(2) |
|
|
|
|
|||||
|
|
Э |
|
|
|
||
где Т – титр раствора, г/мл; |
V – объем раствора, мл. |
|
|||||
|
|
νэ = Сэ V , |
(3) |
||||
где СЭ – молярная концентрация эквивалента, моль экв/л; V – объем раствора, л.
С использованием указанных формул состояние эквивалентности при взаимодействии растворов можно записать следующим образом:
m1 |
= |
m 2 |
; |
Т1 V1 |
= |
T2 V2 |
; |
С |
Э |
|
V = C |
Э |
|
V |
|
|
|
|
|
|
|||||||||
Э1 Э2 |
Э1 |
Э2 |
|
1 |
1 |
2 |
2 |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||
6.10. На нейтрализацию раствора уксусной кислоты израсходовано 29 мл раствора КОН Сэ = 0,1 моль/л. Сколько уксусной кислоты содержалось в растворе?
Ре ш е н и е: СН3СООН + КОН = СН3СООК + Н2О,
νЭСН3СООН = νЭКОН
Число νСН3СООН удобнее выразить через массу, т.е. именно эта вели-
чина требуется по условию задачи, а число νКОН – через известную молярную концентрацию эквивалента этого раствора.
mCH3COOH = СЭ(КОН) V(KOH)
Отсюда: mCH3COOH = CЭ(КОН) V(KOH) ЭСН3СООН
ЭСН3СООН = М = 60 г/моль; mCH3COOH = 0,1·0,029·60 = 0,174 г.
39
7. СВОЙСТВА РАСТВОРОВ ЭЛЕКТРОЛИТОВ
Ионное произведение воды. Водородный показатель
Вода, будучи очень слабым электролитом, в незначительной степени
ионизирует, образуя ионы водорода и гидроксид-ионы: Н2О ↔ Н+ + ОН-
Этому процессу соответствует константа ионизации:
Кион, = |
[H + ] [OH − ] |
= 1,8 10 −16 |
|
|
(1) |
|||||
|
[H 2O] |
|
|
|
|
|
|
|
||
[Н2О]= |
СН2 О = |
m1лН2 |
О |
= |
|
1000 г |
= 55,55 |
моль/л |
(2) |
|
МН2 О |
18г/ моль |
|||||||||
|
|
|
|
|
|
|||||
Подставляя в уравнение (1) значение Кион. и СН2О, получаем:
Кион.· СН2О = СН+ ·СОН- ; 1,8·10-16·55,55 = СН+ ·СОН- КН2О или КW = CH+ ·COH- = 10-14 при 20-25оС,
т.е. произведение концентраций ионов водорода и гидроксид-ионов представляет собой постоянную при данной температуре величину и называется ионным произведением воды.
Поскольку ионизация воды – эндотермический процесс, то с повышением температуры он усиливается, и значение КН2О возрастает; напри-
мер, при 37оС: КН2О = СН+ ·СОН- = 2,47·10-14.
В чистой воде концентрации ионов водорода и гидроксид-ионов одинаковы и при 22-25оС составляют 10-7 моль/л.
Растворы, в которых концентрации ионов водорода и гидроксид-ионов
одинаковы, называются нейтральными растворами: СН+ = СОН- = 10-7 моль/л.
В кислых растворах СН+ > СОН-. В щелочных растворах СН+ < COH-. Вместо концентраций ионов Н+ и гидроксид-ионов удобно пользоваться их десятичными логарифмами, взятыми с обратным знаком. Эти величины обозначаются символами рН и рОН и называются, соответ-
ственно, водородным и гидроксильным показателями.
pН = - lgCH+ ; |
pOH = - lgCOH- |
|
Логарифмируя соотношения СН+ ·СОН- = КН2О и меняя знаки на обрат- |
||
ные, получаем: рН + рОН = рКН2О |
|
22-25оС; |
рН + рОН = 14 |
при |
|
рН + рОН = 13,61 |
при |
37оС. |
При температуре 22-25оС в нейтральных растворах рН = 7, в кислых – рН < 7, в щелочных – рН > 7. Для организма, т.е. при 37оС, рН = 6,805 – среда нейтральная.
40
|
Задачи и упражнения |
7.1. Рассчитайте рН при 25оС, если: |
|
а) СН+ = 10-5 моль/л; |
б) СОН- = 10-8 моль/л. |
Р е ш е н и е: |
а) рН = -lgCH+ = - lg10-5 = 5 (среда кислая, т.к. |
рН < 7),
б) рОН = - lgCOH- = - lg 10-8 = 8, pH = 14 - pOH = 14 - 8 = 6 (среда кислая, т.к. рН < 7).
7.2. Концентрация ионов водорода в растворе равна 4·10-3 моль/л. Определите рН раствора.
Ре ш е н и е: рН = - lg (4·10-3) = - (lg 10-3 + lg 4) = 3 - 0,6 = 2,4
(среда кислая).
7.3. Концентрация гидроксид-ионов в растворе равна 6,4·10-8 моль/л. Определите рН раствора.
Ре ш е н и е: рОН = - lg COH- = - lg (6,4·10-8) = - (lg 10-8 + lg 6,4)
=8 - 0,806 = 7,193.
pH = 14 - pOH = 14 - 7,193 = 6,806 (среда кислая).
7.4.Определите концентрацию ионов водорода в растворе, рН
которого равен 4.
Р е ш е н и е: Согласно условию задачи -lg CH+ = 4, следовательно, lgCH+ = -4, отсюда СН+ = 10-4 моль/л.
7.5.Определите концентрацию ионов водорода в растворе, рН
которого равен 4,60.
Р е ш е н и е: Согласно условию задачи (-lg CH+) = 4,60, следовательно, lgCH+ = -4,60, или lgCH+ = -5 + 0,4 , отсюда по таблице логарифмов находим СН+ = 2,5·10-5 моль/л.
7.6.Чему равна концентрация гидроксид-ионов в растворе, рН которого равен 10,80?
Р е ш е н и е: Из соотношения рН + рОН = 14 находим:
рОН = 14 - рН = 14 - 10,80 = 3,20. Отсюда, (-lg COH-) = 3,20 или lg COH-
= -3,20 или -lg COH- = -4 + 0,8. Этому значению логарифма соответствует значение СОН- = 6,31·10-4 моль/л.
Степень и константа ионизации слабых электролитов
По степени ионизации в водных растворах электролиты делятся на слабые и сильные. Согласно теории Аррениуса сильные электролиты полностью диссоциированы на ионы, т.е.: КА → К+ + А-.
К сильным электролитам относятся все растворимые соли, многие минеральные кислоты, гидроксиды щелочных и щелочноземельных металлов.
Слабые электролиты при растворении лишь частично ионизируют на ионы. В отличие от сильных электролитов, их ионизация протекает обратимо с установлением равновесия: КА↔ К+ + А- .
41
К слабым электролитам относятся органические кислоты, некоторые минеральные кислоты, амфотерные гидроксиды.
Количественно процесс ионизации может быть охарактеризован степенью и константой ионизации.
Константой ионизации называется константа равновесия процесса ионизации слабого электролита. Например, в водном растворе уксусной кислоты устанавливается равновесие:
СН3СООН ↔ Н+ + СН3СОО-.
Кион . = |
[H + ] [CH 3COO |
− ] |
– константа ионизации. |
|
[СН 3 |
СООН ] |
|
||
|
|
|
||
Степенью ионизации (α) электролита называется отношение числа молекул, подвергнувшихся ионизации, к общему числу молекул электролита в растворе.
В случае электролита КА, ионизирующего на ионы К+ и А-, константа и степень ионизации связаны соотношением (закон разбавления
Оствальда): К = |
α2 С , |
|
1 − α |
где С – молярная концентрация электролита, моль/л;
К– константа ионизации;
α– степень ионизации.
Если степень ионизации значительно меньше единицы, то при приближенных вычислениях можно принять 1- α ~ 1, тогда выражение закона
К = α2С, отсюда α = КС , т.е. степень ионизации слабых электроли-
тов обратно пропорциональна корню квадратному из концентрации раствора или прямо пропорциональна корню квадратному из разведения раствора;
С = V1 , где V – разбавление или разведение раствора, тогда:
α =  K V .
K V .
Если в растворе электролита КА степень его ионизации равна α, то концентрация ионов К+ и А- в растворе одинакова и составляет:
СК+ = СА- = αС. Подставив сюда значение α из предыдущего соотношения, находим: СК+ =СА− =С КV =
КV =  KC , следовательно, концентрация
KC , следовательно, концентрация
ионов водорода для слабой кислоты и концентрация ионов гидроксида
для слабого основания равны соответственно:
СН+ = Ск-ты· α, СОН- = Сосн.· α, или, переходя к рН, -lgCH+ = -lgCк-ты - lg α, pH = pCк-ты + р α.
42

-lgCOH- = lgCосн. - lg α, pOH = pCосн + р α.
Для сильных электролитов, когда α = 1, концентрация ионов Н+ и ОН- в растворе сильных кислот и щелочей равна СН+ = Ск-ты, -lgCH+ = -lgCк-ты,
рН = рСк-ты ; СОН- = Сосн. , -lgCOH- = -lgCосн. , рОН = рСосн.
Задачи и упражнения
7.7. Определите концентрацию ионов водорода и рН 0,001 М раствора азотной кислоты при температуре 25оС, считая ионизацию
полной.
Р е ш е н и е: HNO3 → H+ + NO3-
Из уравнения диссоциации азотной кислоты видно, что при условии полной ее диссоциации, концентрация ионов Н+ (моль/л) равна концентрации кислоты.
СН+ = 0,001 моль/л = 10-3 моль/л
рН = -lgCH+ = -lg10-3 = 3.
7.8. Вычислите константу ионизации уксусной кислоты, зная, что в 0,1 М растворе она ионизирована на 1,3 %. Рассчитайте концентрацию ионов водорода и рН этого раствора.
Ре ш е н и е: СН3СООН ↔ СН3СОО- + Н+
1)СН+ = Ск-ты· α; СН+ = 0,1·0,013 = 1,3·10-3 моль/л,
2)рН = -lg(1,3·10-3) = 3 – 0,1139 = 2,886,
3) α = |
К ; K = α2C = (0,013)2·0,1 = 0,0000169 = 1,69·10-5. |
|
С |
|
7.9. Степень ионизации уксусной кислоты в 0,1 М растворе |
равна 1,32·10-2. Найдите константу ионизации кислоты и значение рК.
Р е ш е н и е: |
Подставим данные задачи в уравнение закона |
|||||||||
разбавления Оствальда: |
К = |
α |
2 С |
= |
(1,32 10−2 )2 0,1 |
=1,77 |
10−5 |
, |
||
1 |
−α |
1−0,0132 |
|
|||||||
|
|
|
|
|
|
|||||
Откуда рК = -lg(1,77·10-5) = 5 - lg1,77 = 5 - 0,25 = 4,75.
Расчет по приближенной формуле К = α2С приводит к близкому зна-
чению К: К = (1,32·10-2)2·0,1 = 1,74·10-5, откуда рК = 4,75.
7.10. Константа ионизации синильной кислоты равна 7,9·10-10 (приложение, табл. 4). Найдите степень ионизации HCN в 0,001М рас-
творе.
Р е ш е н и е: HCN ↔ H+ + CN-
Поскольку константа ионизации HCN очень мала, то для расчета можно воспользоваться приближенной формулой:
α = |
К |
= |
7,9 10 |
−10 |
= 8,9 10 |
−4 |
|
С |
10 −3 |
||||||
|
|
|
|
||||
43
Сильные электролиты. Активность ионов
Концентрированные растворы сильных электролитов не подчиняются теории Аррениуса. Для них характерны межионные взаимодействия, в результате чего количество свободных ионов снижается. Поэтому для описания состояния ионов в растворе используется, наряду с концентрацией ионов, их активностью, т.е. условной (эффективной) концентрацией ионов, в соответствии с которой они действуют в химических процессах. Активность иона а (моль/л) связана с его молярной концентрацией в растворе (С) соотношением: а = f·C, где f – коэффициент активности.
Коэффициенты активности ионов зависят от состава и концентрации раствора, заряда и природы иона. Приближенно можно считать, что в разбавленных растворах ионная сила раствора равна полусумме произведений концентраций каждого иона на квадрат его заряда:
J = 12(C1 Z12 +C2 Z22 +...+Cn Zn2)= 12 ∑(Ci Zi )
Коэффициент активности иона в разбавленном растворе можно вычислить по формуле или воспользоваться табл.10:
lg f = |
− 0,5Z 2 |
|
J |
. |
|
1 |
+ |
J |
|
||
|
|
|
|||
7.11. Вычислите ионную силу и активность ионов в растворе,
содержащем 0,01 моль/л MgSO4 и 0,01 моль/л MgCl2.
Р е ш е н и е: MgSO4 → Mg2+ + SO42- MgCl2 → Mg2+ + 2Cl-
Ионная сила раствора равна:
J = 0,5(CMg2+·22 + CSO42-(-2)2 + CCl-(-1)2) = 0,5(0,02·4 + 0,01·4 + 0,02·1) = = 0,07.
Коэффициент активности иона Mg2+ и равный ему коэффициент активности иона SO42- найдем по формуле:
|
− 0,5 Z 2 |
|
J |
|
− 0,5 4 0,07 |
|
− |
||
lg f = |
|
|
|
|
= |
|
|
= −0,42 |
= 1,58 |
1 |
+ |
J |
|
1 + |
0,07 |
||||
|
|
|
|
|
|||||
или (-1+0,58), отсюда f = 0,38.
Аналогично находим коэффициент активности хлорид-иона:
lg f |
= |
− 0,5 1 0,07 |
= |
− 0,5 1 0,27 |
= −0,107 = −1 + 0,893 |
|
1 + 0,27 |
||||
|
1 + 0,07 |
|
|
||
f = |
0,782 |
|
|
|
|
Теперь, пользуясь соотношением, находим активность каждого иона:
аMg2+ = 0,02·0,38 = 0,0076 моль/л,
44
аSO42- = 0,01·0,38 = 0,0038 моль/л, |
|
аС1- = 0,02·0,782 = 0,01564 моль/л. |
|
7.12. Вычислите показатель активности ионов водорода (аН+) в |
|
растворе, содержащем 0,01 моль/л А1С13 и 0,1 моль/л НС1. |
|
Р е ш е н и е: |
НС1 → Н+ + С1- |
А1С13 → А13+ + 3С1-
Находим ионную силу раствора:
J = 0,5(CH+·(+1)2 + CCl-·(-1)2 + CAl3+·(3)2 = 0,5(0,1·12 + 0,13·12 + 0,01·9) =
= 0,16
CH+ = CHCl = 0,1 моль/л
СС1- = 0,1 + 3·0,01 = 0,1 + 0,03 = 0,13 моль/л
СА13+ = 0,01 моль/л Коэффициент активности Н+ найдем по формуле:
lg f = |
− 0,5Z2 |
J |
= |
− 0,5 (1)2 |
0,16 |
= |
− 0,5 0,4 |
= −0,14 = −1 + 0,86; |
|
1 + J |
1 + 0,16 |
|
|
1 + 0,4 |
|
||
f = 0,725 .
аН+ = СНС1·f = 0,1·0,725 = 0,0725 моль/л
paH+ = -lgaH+ = -lg0,0725 = -lg7,25·10-2 = -(lg7,25 + lg10-2) = -0,86 + 2 = = 1,14.
Задачу можно решить и другим способом, воспользовавшись логариф- |
|||||||
мическим выражением формулы aH+ = CHCl·f |
|||||||
paH+ = pH + pf |
|
|
pH = -lgCH+ = -lg10-1 = 1 |
||||
pf = |
0,5 Z 2 |
J |
= |
0,5 1 |
2 0,16 |
= 0,14 |
|
1 + |
J |
1 + |
0,16 |
||||
|
|
|
|||||
paH+ = 1 + 0,14 = 1,14
45

8.ПРОИЗВЕДЕНИЕ РАСТВОРИМОСТИ
Внасыщенном растворе малорастворимого сильного электролита устанавливается равновесие между осадком (твердой фазой) электролита и ионами электролита в растворе, например:
BaSO4 |
↔ Ba2+ + SO42- |
в осадке |
в растворе |
Константа равновесия этого процесса выразится следующим уравнением
K = [Ba 2+ ] [SO 42−] [BaSO 4(к) ]
Знаменатель этой дроби, т.е. концентрация твердого сульфата бария, есть величина постоянная, так что произведение К·[BaSO4(к)] тоже является при данной температуре константой. Отсюда следует, что произведение концентраций ионов Ва2+ и SO42- также представляет собой постоянную величину, называемую произведением растворимости и обозначаемую ПР: [Ba2+]·[SO42-] = ПРBaSO4 .
Произведение концентраций ионов малорастворимого электролита, содержащихся в его насыщенном растворе (произведение растворимости), есть величина постоянная при данной температуре (см. табл. 12). Если в растворе электролита образуется два или несколько одного сорта ионов, то в выражении для ПР концентрации этих ионов должны быть возведены в соответствующие степени, например:
1) |
CaF2 ↔ Ca2+ + 2F- ; |
ПРCaF = [Ca2+]·[F-]2 |
|
тв.ф. |
2 |
|
|
|
2) |
Са3(РО4)2 ↔ 3Са2+ + 2РО43- ; |
ПРCa3 (PO4 )2 = [Ca2+]3[PO43-]2 |
тв.ф.
При увеличении концентрации одного из ионов электролита в его насыщенном растворе (например, путем введения другого электролита, содержащего тот же ион) произведение концентраций ионов электролита становится больше ПР. При этом равновесие между твердой фазой и раствором смещается в сторону образования осадка.
Напротив, если в насыщенном растворе электролита уменьшить концентрацию одного из ионов (например, связав его каким-либо другим ионом), произведение концентраций ионов будет меньше значения ПР, раствор станет ненасыщенным, равновесие между жидкой фазой и осадком сместится в сторону растворения осадка.
46
Исходя из значений ПР, можно вычислить растворимость малорастворимых электролитов в воде и растворах, содержащих другие электролиты.
Задачи и упражнения
8.1. Растворимость гидроксида магния Mg(OH)2 при 18оС равна 1,7·10-4 моль/л. Найдите произведение растворимости Mg(OH)2 при этой температуре.
Р е ш е н и е: При растворении каждого моля Mg(OH)2 в раствор переходит 1 моль ионов Mg2+ и вдвое больше ионов ОН-. Следовательно, в насыщенном растворе Mg(OH)2:
[Mg2+] = 1,7·10-4 моль/л; [OH-] = 3,4·10-4 моль/л.
Отсюда: ПРMg(OH)2 = [Mg2+][OH-]2 = 1,7·10-4(3,4·10-4)2 = 1,96·10-11.
8.2. Произведение растворимости иодида свинца при 20оС равно 8·10-9. Вычислите растворимость соли в (моль/л и г/л) при указанной температуре.
Р е ш е н и е: Обозначим искомую растворимость через Х (моль/л). Тогда в насыщенном растворе PbI2 содержится Х моль/л ионов Pb2+ и 2Х моль/л ионов I-. Отсюда:
ПРPbI2 = [Pb2+][I-]2 = X·(2X)2 = 4X3
Отсюда: Х = 3 |
ПРPbI |
2 |
= 3 |
8 10 |
−9 |
−3 |
|
|
|
|
= 1,3 10 |
||||
4 |
|
4 |
|
||||
|
|
|
|
|
|
||
Поскольку молярная масса PbI2 равна 461 г/моль, то растворимость PbI2, выраженная в г/л, составит 1,3·10-3·461 = 0,6 г/л.
8.3. Смешаны равные объемы 0,01 М растворов хлорида кальция и сульфата натрия. Образуется ли осадок сульфата кальция?
Р е ш е н и е: Найдем произведение концентраций ионов Са2+ и SO42- и сравним его с произведением растворимости сульфата кальция. Исходные молярные концентрации растворов СаС12 и Na2SO4 одинаковы и равны 0,01 моль/л. Поскольку при смешении исходных растворов общий объем раствора вдвое возрастает, то концентрации ионов Са2+ и SO42- вдвое уменьшатся по сравнению с исходными. Таким образом,
ССа2+ = CSO24− = 0,005 = 5·10-3 моль/л.
Находим произведение концентраций ионов:
ПК = ССа2+· CSO24− = (5·10-3)2 = 2,5·10-5.
По данным табл. 5 произведений растворимости ПРCfSO4 = 2,4·10-5.
Найденное значение произведения концентраций ионов примерно равно этой величине, следовательно, раствор будет насыщенным относительно сульфата кальция, и осадок образуется.
47

8.4. Произведение растворимости при некоторой температуре Ag2CrO4 = 4,05·10-12. Вычислите концентрацию ионов Ag+ в насыщенном растворе Ag2CrO4.
Р е ш е н и е: Ag2CrO4 (к) ↔ 2Ag+ + CrO42- ПР = [Ag+]2·[CrO42-] = 4,5·10-12.
Т.к. при диссоциации Ag2CrO4 ионов CrO42- получается в 2 раза мень-
ше, чем ионов Ag+, то [CrO42-] = ½ [Ag+]
Выражая в произведении растворимости [CrO42-] через [Ag+] получаем: [Ag+]2· 1/2 [Ag+] = 4,05·10-12,
отсюда ½ [Ag+]3 = 4,05·10-12
[Ag+] = 3 8,1 10−12 = 2,008 10−4 моль/л.
8.5. Объясните с точки зрения теории ПР, почему гидроксид
алюминия растворяется при добавлении щелочей? А1(ОН)3 ↔ А13+ + 3ОН-
тв.ф. ионы насыщ. раствора
КОН → К+ + ОН-
__________________
[Al(OH)4]- p-p
Связывание ионов А13+ в комплекс приводит к нарушению равновесия и смещению его вправо, вплоть до полного растворения А1(ОН)3.
48
9.ГИДРОЛИЗ СОЛЕЙ
Вобщем случае под гидролизом понимают реакции разложения вещества водой. Гидролизу могут подвергаться химические соединения различных классов: белки, жиры, углеводы, эфиры, соли и т.д. В неорганической химии чаще всего встречаются с гидролизом солей.
Гидролизом соли называют взаимодействие соли с молекулами воды, приводящее к образованию малоионизированных соединений. Следст-
вием гидролиза является изменение характера среды в результате нарушения равновесия ионизации воды Н2О ↔ Н+ + ОН-.
Возможны четыре варианта гидролиза в зависимости от типа соли:
1.Соль, образованная сильной кислотой и сильным основанием, гидролизу не подвергается. Реакция среды нейтральная.
KNO3 + H2O ≠
Ионы К+ и NO3- не образуют с водой малоионизированных продуктов (КОН и HNO3 – сильные электролиты).
2.Соль, образованная сильным основанием и слабой кислотой, подвергается гидролизу по аниону. Реакция среды щелочная (рН > 7).
1 ступень |
СО32- + НОН ↔ НСО3- + ОН- |
гидролиза |
Na2CO3 + H2O ↔ NaHCO3 + NaOH |
3.Соль, образованная слабым основанием и сильной кислотой, под-
вергается |
гидролизу |
по катиону. |
Реакция |
среды кислая |
(рН < 7). |
|
|
|
|
Cu(NO3)2 → Cu2+ + 2NO3- |
|
|
|
|
гидратация Cu2+ + 4H2O → [Cu(H2O)4]2+ |
|
|
||
|
|
H+ |
|
|
1 ступень |
[Cu(H2O)4]2+ |
+ HOH ↔ [Cu(H2O)3OH]+ + H3O+ |
||
гидролиза |
к-та 1 |
осн.2 |
осн.1 |
к-та 2 |
или в упрощенном виде: Cu2+ + HOH ↔ CuOH+ + H+
Cu(NO3)2 + H2O ↔ CuOHNO3 + HNO3
4.Соль, образованная слабым основанием и слабой кислотой, подвергается гидролизу по катиону и аниону. Характер среды определяется степенью диссоциации (ионизации) образовавшихся соеди-
нений
CH3COO- + NH4+ + HOH ↔ CH3COOH + NH4OH
CH3COONH4 + H2O ↔ CH3COOH + NH4OH
Гидролиз можно усилить, если: а) разбавить раствор;
б) нагреть раствор, т.к. процесс гидролиза – эндотермический (тепло расходуется на разрыв водородных связей между молекулами воды);
49

в) связать один из продуктов гидролиза; обычно это ионы Н+ или ОН-, которые накапливаются при гидролизе, и связывание их в молекулы воды приводит к смещению равновесия.
Количественно процесс гидролиза характеризуется константой (Кгидр.) и степенью гидролиза (h).
Степень гидролиза h – это отношение концентрации гидролизованной соли к общей концентрации ее. Чем слабее кислота или основание, тем больше степень гидролиза. Так для 0,1 М CH3COONa h = 0,08 %
αСН3СООН = 1,3 %, а для 0,1 М Na2CO3 h = 2,9 % αН2СО3 = 0,02 %.
Константа гидролиза (Кгидр.) является постоянной при данной температуре и показывает полноту гидролиза:
|
Н+ |
|
|
|
|
СН3СОО- + НОН ↔ СН3СООН + |
ОН- |
||||
осн.2 |
к-та 1 |
к-та 2 |
осн. 1 |
||
СН3COONa + H2O ↔ CH3COOH + NaOH |
|||||
Кгидр. = |
Кw |
|
, где Кw |
– ионное произведение воды, |
|
Кион.СН3 |
СООН |
||||
|
|
|
|||
или в общем виде:
Кгидр. соли, образованной сильным основанием и слабой кислотой:
Кгидр. = |
Кw |
|
Кион.слаб.к−ты |
||
|
Кгидр. Соли, образованной слабым основанием и сильной кислотой:
Кгидр. = К Кw ион.слаб.осн.
Кгидр. Соли, образованной слабым основанием и слабой кислотой:
Кгидр. = w
Кион.слаб.осн. Кион.слаб.к−тыК
Исходя из значений Кион. слабых кислот или оснований (табл. 9, приложение), можно рассчитать Кгидр. соответствующих солей.
Задачи и упражнения
9.1. Напишите математическое выражение константы гидролиза соли NH4NO3. Рассчитайте константу гидролиза, если константа ионизации гидрата аммиака равна 1,8·10-5.
Р е ш е н и е: Пишем уравнение гидролиза данной соли. Соль образована слабым основанием и сильной кислотой, поэтому механизм
гидролиза следующий:
NH4+ + HOH ↔ NH3·H2O + H+
50
NH4NO3 + H2O ↔ NH3·H2O + HNO3
Пишем выражение для константы гидролиза соли, образованной слабым основанием и сильной кислотой, и рассчитываем Кгидр.:
Кгидр.NH |
|
NO |
|
= |
Kw |
= |
Кw |
= |
1 10−14 |
= 5,6 10−10 |
|
|
Kион.слаб.осн. |
Kион.NH3 H2O |
|
||||||
|
4 |
|
3 |
|
|
1,8 10−5 |
|
|||
9.2. Какая из солей подвергается гидролизу: KI, CrCl3? Напишите ионные уравнения гидролиза, раскрыв механизм гидролиза. Укажите реакцию среды.
Р е ш е н и е: а) Соль KI образована сильным основанием (КОН) и сильной кислотой (HI), поэтому гидролизу не подвергается.
б) Соль CrCl3 образована слабым основанием и сильной кислотой, гидролиз идет по катиону. Ион Cr3+ в аквакомплексе обладает высоким поляризующим действием и «выталкивает» во внешнюю среду из координированной молекулы воды два протона. В результате аквакомплекс является протолитической кислотой, а молекулы воды внешней среды, принимая протоны, являются протолитическим основанием.
Реакция среды кислая (рН < 7). |
→ Cr3+ + 3Cl- |
|
|
|
CrCl3 |
|
|
Гидратация Сr3+ |
+ 6H2O → [Cr(H2O)6]3+ |
|
|
2H+ |
|
|
|
Гидролиз [Cr(H2O)6]3+ + 2HOH |
= [Cr(H2O)5O]+ + 2H3O+ |
||
к-та 1 |
осн. 2 |
осн. 1 |
к-та 2 |
9.3. Как протекает гидролиз соли KNO2? Дайте мотивированный ответ. Рассчитайте константу гидролиза, если константа ионизации азотистой кислоты 5,1·10-4.
Р е ш е н и е: Соль нитрит калия образована сильным основанием и слабой кислотой, поэтому механизм гидролиза этой соли следующий:
NO2- |
+ HOH |
↔ HNO2 + OH- |
осн.2 |
к-та 1 |
к-та 2 осн. 1 |
KNO2 + H2O ↔ HNO2 + KOH
Анион NO2- «захватывает» протон из молекулы воды, ведет себя как протолитическое основание, а молекула воды внешней сферы является протолитической кислотой. Реакция среды щелочная. Пишем формулу Кгидр. Для соли, образованной сильным основанием и слабой кислотой, и рассчитываем ее:
Кгидр.KNO |
|
= |
Kw |
= |
Кw |
= |
1 10−14 |
= 1,96 10−11 |
|
2 |
Kион.слаб.к−ты |
Kион.HNO2 |
5,1 10−4 |
||||||
|
|
|
|
|
51

9.4. При смешивании растворов хлорида железа (Ш) и карбоната натрия выделяется диоксид углерода и гидроксид железа (Ш). Напишите уравнение реакции гидролиза.
Р е ш е н и е: При смешивании растворов FeCl3 и Na2CO3 происходит взаимное усиление гидролиза, т.к. ионы Н+ и ОН-, образующиеся в результате гидролиза указанных солей, уходят из сферы реакции в виде молекул воды, что смещает равновесие процесса гидролиза вправо и активизирует последующие ступени гидролиза. Это приводит к образованию молекул слабой кислоты и слабого основания.
2FeCl3 + 3Na2CO3 + 6H2O → 2Fe(OH)3↓ + 3H2CO3 + 6NaCl
3H2O 3CO2↑
в ионном виде:
2Fe3+ + 3CO32- + 6HOH → 2Fe(OH)3 + 3H2CO3.
9.5. Подвергается ли гидролизу соль CuSO4? Дайте пояснения. Какими способами можно усилить гидролиз?
Р е ш е н и е: Соль CuSO4 образована слабым основанием и сильной кислотой, гидролизу подвергается по катиону. Заряд катиона +2, следовательно, гидролиз будет протекать по двум ступеням, обра-
зуется аквагидроксосоль. Реакция среды кислая (рН < 7). Cu2+ + HOH ↔ CuOH+ + H
2CuSO4 + 2H2O ↔ (CuOH)2SO4 + H2SO4
или через образование аквакомплекса: CuSO4 → Cu2+ + SO42-
Cu2+ + 4H2O → [Cu(H2O)4]2+ H+
[Cu(H2O)4]2+ + HOH ↔ [Cu(H2O)3OH]+ + H3O+
к-та 1 осн. 2 осн. 1 к-та 2 Гидролиз можно усилить:
а) разбавляя раствор; б) нагревая раствор, т.к. реакция гидролиза – процесс эндотер-
мический; в) добавляя какую-либо щелочь, т.к. при этом связываются
ионы гидроксония в молекулу воды, и равновесие реакции гидролиза смещается вправо: Н3О+ + ОН- → 2Н2О.
52

10. ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА РАСТВОРОВ
Осмотическое давление растворов. Закон Вант-Гоффа
Осмотическое давление разбавленных растворов неэлектролитов может быть вычислено по уравнению Вант-Гоффа:
π = C·R·T,
где π – осмотическое давление; С – молярная концентрация, моль/л; R – газовая постоянная;
Т– температура, К.
Единицей измерения давления в СИ является Паскаль (Па) – н/м2 – Ньютон/м2.
Универсальная газовая постоянная в СИ равна 8,31 Дж/моль·К. Иногда давление приводят в атмосферах (атм.) и мм рт.ст. Приборы, измеряющие давление, калиброваны также в этих единицах, поэтому в решении задач будем использовать единицу измерения – атм.
Осмотическое давление раствора электролита вычисляется по уравнению: π = i·C·R·T,
где i – изотонический коэффициент, показывающий, во сколько раз осмотическое давление раствора электролита больше осмотического давления раствора неэлектролита той же молярной концентрации:
i = πэл. .
πнеэл.
Изотонический коэффициент рассчитывается по уравнению: i = 1 + α(n – 1),
где α – степень ионизации электролита;
n – число частиц, которые образуются при ионизации электролита в растворе.
Для очень разбавленных растворов сильных электролитов α = 1 и i = n
Осмотическое давление в растворах ВМС не подчиняется закону Вант-Гоффа. Оно значительно увеличивается с ростом концентрации и может быть рассчитано по уравнению Галлера:
π = МС RT + KC 2 RT
В этом уравнении:
С – массовая концентрация ВМС, г/см3;
М– молекулярная масса ВМС;
К– константа Галлера;
R– универсальная газовая постоянная;
Т– температура, К.
53
Растворы с одинаковым осмотическим давлением называются изотоническими. В медицинской и фармацевтической практике под изотоническими растворами понимают растворы, по величине осмотического давления равные осмотическому давлению плазмы крови (7,4 атм).
Задачи и упражнения
10.1. Взяты 0,1 моль/л растворы NaCl, K2SO4, C6H12O6. В каком из растворов осмотическое давление будет максимальным?
Р е ш е н и е: прежде всего осмотическое давление растворов электролитов (NaCl и K2SO4) будет выше, чем осмотическое давление раствора неэлектролита – глюкозы (С6Н12О6).
πглюк. = C·R·T; πэл. = i·C·R·T,
где С – молярная концентрация всех растворов одинаковая – моль/л;
Т– температура раствора одна и та же.
Следовательно, из двух растворов электролитов максимальное осмотическое давление будет в растворе с наибольшим изотоническим коэффициентом – 1. Для сильных электролитов степень ионизации α можно принять равной 1, отсюда: NaCl → Na+ + Cl- диссоциирует с образованием двух ионов, и i = 1 + 1(2 - 1) = 2. K2SO4 диссоциирует с образованием трех ионов, и i = 1 + 1(3 - 1) = 3;
πK2SO4 = 3CRT; πNaCl = 2CRT; πглюк. = CRT.
Ответ: Максимальным осмотическим давлением в данном ряду растворов обладает раствор сульфата калия (K2SO4).
10.2. Будут ли изотоничны 1 моль/л раствор NaCl и 1 моль/л раствор глюкозы?
Ответ: Растворы называются изотоническими, если имеют равные осмотические давления. При одинаковой молярной концентрации раствор NaCl будет иметь осмотическое давление в два раза больше, чем рас-
твор глюкозы. πглюк. = CRT; πNaCl = iCRT = 2CRT; i NaCl = 2 (см.
вопрос 1).
Понижение давления пара растворителя над раствором. Закон Рауля
При заданной температуре давление насыщенного пара над жидкостью величина постоянная. При растворении в жидкости какого-либо нелетучего вещества давление насыщенного пара этой жидкости понижается. Разность между давлением насыщенного пара над чистым растворителем (Ро) и давлением насыщенного пара растворителя над раствором (Р) называется понижением давления над раствором: Р = Ро - Р.
Закон Рауля связывает относительное понижение давления насыщенного пара растворителя над разбавленными растворами нелетучих неэлектролитов с концентрацией.
54
Величина |
Ро −Р |
называется относительным понижением давления |
||||
|
Ро |
|||||
|
|
|
|
|
|
|
пара: |
Ро −Р |
= хi; |
xi = |
νi |
- мольная доля растворенного вещества. |
|
|
|
|||||
|
Ро |
|
|
|
∑νi |
|
Относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворенного вещества. Понижение давления пара растворителя над растворами электролитов:
Рэл. = i Pнеэл.
где: i – изотонический коэффициент.
Первое следствие из закона Рауля: температура кипения раствора выше, чем чистого растворителя. Повышение температуры кипения раствора прямо пропорционально моляльной концентрации раствора.
Для неэлектролитов: |
tкип. = Кэб·b, |
для электролитов: |
tкип. = i Kэб.·b, |
где: b – моляльная концентрация растворенного вещества, моль/кг; i – изотонический коэффициент,
Kэб. – эбулиоскопическая константа, К·кг·моль-1 (см. табл. 14).
При b = 1 моль/кг, Кэб. = tкип., т.е. Кэб. можно назвать молярным повышением температуры кипения.
Эбулиоскопическая константа характеризует только природу растворителя. Для любого водного раствора Кэб. = 0,52о (приложение, табл. 5). Второе следствие из закона Рауля: температура замерзания раствора ниже, чем чистого растворителя. Понижение температуры замерзания раствора прямо пропорционально моляльной концентрации раствора.
Для неэлектролитов: |
tзам. = Ккр. ·b, |
для электролитов: |
tзам. = i·Kкр. ·b, |
где: tзам. – понижение температуры замерзания (иногда называют депрессией);
i – изотонический коэффициент;
Ккр. – криоскопическая константа, К·кг·моль-1 (см. табл. 14).
При b = 1 моль/кг tзам. = Ккр.; Ккр. называют моляльной депрессией. Криоскопическая константа характеризует только природу растворите-
ля и не зависит от природы растворенного вещества. Для водного раствора Ккр = 1,86о (приложение, табл. 5).
10.3. Найдите понижение давления пара растворителя над раствором, если 18 г глюкозы растворено в 360 мл Н2О. Давление пара
воды при данной температуре Ро = 10 кПа, Мглюк. = 180 г/моль.
Р е ш е н и е: Решаем по закону Рауля: Р = Ро - Р = Ро·xi. Определим мольную долю растворенного вещества, xi:
55

|
|
|
|
|
|
|
|
|
|
|
|
mглюк. |
|
|
|
|
|
|||
xi = |
|
νi |
|
|
|
= |
|
|
|
|
|
Mглюк. |
|
|
|
|
||||
∑ ν |
i |
|
|
m |
глюк. |
+ |
mН |
О |
||||||||||||
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|||||||
|
|
|
|
|
|
|
|
Мглюк. |
МН2О |
|||||||||||
|
|
|
|
|
18 |
|
|
|
|
|
|
|
0,1 |
|
|
|
|
|
||
хглюк . = |
|
|
180 |
|
|
|
|
= |
|
= 0,005 , |
||||||||||
|
18 |
|
|
|
|
|
20 ,1 |
|||||||||||||
|
|
|
+ |
360 |
|
|
|
|
|
|
||||||||||
|
180 |
|
|
18 |
|
|
|
|
|
|
|
|
|
|
||||||
Р = 10 кПа·0,005 = 0,05 кПа.
Ответ: Понижение давления пара над раствором составляет 0,05 кПа, что в мм рт. ст. составляет 0,37 (760 мм рт. ст. – 101,3 кПа).
10.4. Взяты растворы глюкозы, NaCI и СаCI2 с концентрацией 1 моль/кг. Какой из растворов имеет наиболее низкую температуру замерзания?
Т.к. концентрация растворов 1 моль/кг, то понижение температуры замерзания раствора глюкозы (неэлектролит) равно Ккр = tзам..
Для электролитов |
tзам. = i·Ккр. |
tзам.NaCI = 2·Ккр. |
tзам.CaCI2 = 3 Ккр. |
Следовательно, понижение температуры замерзания для раствора CaCI2 наибольшее, и этот раствор будет иметь наиболее низкую температуру замерзания:
tзам. = 0 - tзам. = - |
tзам. |
Т.к. все растворы водные, tозам..глюкозы = -1,86о; |
|
tозам.NaCI = -2·1,86о = -3,72о; |
tозам.CaCI2 = -3·1,86о = -5,58о. |
10.5. Определите относительную молекулярную массу глюкозы, если раствор, содержащий 116 г глюкозы в 1000 г воды, замерзает при температуре -1,2о.
Р е ш е н и е: Задача на определение относительной молекулярной массы криометрическим методом, т.е. методом, в котором измеряется понижение температуры замерзания раствора в зависимости
от концентрации растворенного вещества. |
|
|
Для решения задачи воспользуемся следствием из закона Рауля: |
|
|
где: tзам. |
tзам. = Ккр. ·b, |
(1) |
– понижение температуры замерзания; |
|
|
Ккр = 1,86о |
– криоскопическая константа воды. |
|
Подставим в уравнение (1) выражение моляльной концентрации b: b = mгл 1000
Mr mр−ля
56

получим: tзам. = Ккр. |
mгл. 1000 |
(2) |
|
Mr mр−ля |
|||
|
|
Найдем из уравнения (2) относительную молекулярную массу вещества:
Mr = |
Ккр mгл. 1000 |
|
|
(3) |
|
|
||
|
tзам. mр−ля |
|
Подставим в уравнение (3) численные значения всех величин tзам. = 0 - tзам. = 0 - (-1,2о) = 1,2
1,86 116 1000 =
Mr = 180 . 1,2 1000
Ответ: Полученное значение (180) соответствует относительной молекулярной массе глюкозы.
10.6. 200 мг белка цитохрома растворено в 10 см3 воды. Относительная молекулярная масса цитохрома 12400. Каково понижение температуры замерзания раствора?
Р е ш е н и е: Т.к. плотность воды ρ = 1 г/см3, можно считать известной массу Н2О: mH2O = ρ·V = 1 г/см3·10 см3 = 10 г
Задача на связь молекулярной массы вещества с понижением температуры замерзания раствора, т.е. аналогично задаче 1. Поэтому запишем уравнение (2)
m 1000
tзам. = Ккр. Mr mр−ля
1,86о 0,21000 = о tзам. = 0,003
12400 10
Ответ: Способ определения молекулярной массы по измерению температуры замерзания раствора имеет свои пределы. Для соединений с большой молекулярной массой оказывается трудным ввести в раствор достаточное количество вещества, чтобы удалось точно измерить изменение температуры замерзания. 0,003о – величина слишком малая для точного определения молекулярной массы. В этом случае лучше воспользоваться другим методом.
10.7. Осмотическое давление, обусловленное растворением 200 мг цитохрома в 10 см3 воды при 25о, составляет 0,039 атм. Вычислите молярную массу цитохрома.
Р е ш е н и е: Осмотическое давление 0,039 атм намного легче измерить, чем уменьшение температуры на 0,003 К. Поэтому осмоти-
57

ческое давление является наиболее удобным коллигативным свойст-
вом, используемым для измерения больших молекулярных масс. |
|
||||||
Запишем уравнение Вант-Гоффа для осмотического давления: |
|
||||||
|
|
π = CRT |
|
|
|
(4) |
|
Подставим в уравнение (4) выражение молярной концентрации |
|
||||||
С = |
m |
, моль/л, получим: |
π = |
m RT |
|
(5) |
|
M V |
M V |
||||||
|
|
|
|
||||
Из уравнения (5) найдем молярную массу:
M= m RT .
πV
Подставим в уравнение численные значения всех величин:
M = |
0,2 0,082 298 |
= 12400 г/моль |
|
0,039 0,01 |
|||
|
|
Ответ: Молярная масса цитохрома, определенная по измерению осмотического давления, соответствует относительной молекулярной массе.
10.8. Рассчитайте осмотическое давление раствора неэлектролита при 0оС, если раствор замерзает при -1,86о.
Ре ш е н и е: Задача на связь осмотического давления раствора
спонижением температуры замерзания. Запишем уравнение ВантГоффа для неэлектролитов:
π = CRT |
(6) |
Для разбавленных растворов можно принять, что молярная концентрация (С) совпадает с моляльной концентрацией (b).
Моляльную концентрацию раствора найдем из выражения для понижения температуры замерзания:
tзам. – Ккр. ·b, |
b = |
tзам. |
|
|
Ккр. |
Подставим значение b в уравнение (4), получим:
π = |
tзам. R T |
|
Ккр |
Подставим значения величин, входящих в уравнение:
π = 1,86 0,082 273 = 22,4 атм 1,86
Ответ: Понижение температуры замерзания соответствовало моляльной депрессии, поэтому полученное значение осмотического давления отвечает допущениям газовых законов при выводе уравнения ВантГоффа.
58

10.9. Определите кажущуюся степень ионизации нитрата кальция в растворе, полученном растворением 16,4 г этой соли в 1 л воды, если такой раствор замерзает при -0,46о.
Р е ш е н и е: Раствор нитрата кальция – раствор электролита, поэтому:
tзам. = i·Ккр. ·b |
(7) |
Подставим в уравнение (7) значение моляльной концентрации и решим полученное уравнение относительно i:
tзам. = i Ккр |
|
m 1000 |
; |
i = |
tзам. mр−ля Mr |
(8) |
|||
Mr mр−ля |
Ккр. m 1000 |
||||||||
|
|
|
|
|
|||||
т.к. i = 1 + α(n - 1), |
|
i − 1 |
|
|
|
|
|
||
отсюда |
α = |
|
|
|
|
(9) |
|||
|
n − 1 |
|
|
|
|||||
nCa(NO3 )2 |
= 3 |
|
|
|
|
|
|||
|
|
|
|
|
|
|
|||
Подставим в уравнение (8) значения величин: i = 0,46 164 1000 = 2,5
1,86 16,4 1000
Зная величину i, определим α из выражения (9): α = 23,5−−11 = 0,75 , что соответствует 75%
Ответ: 75% - кажущаяся степень диссоциации, т.к. Ca(NO3)2 – раствор сильного электролита с достаточно высокой концентрацией.
10.10. Рассчитайте осмотическое давление раствора хлорида
натрия при температуре 25оС, если раствор замерзает при температуре - 0,56о.
Р е ш е н и е: Задача на расчет осмотического давления по методу криометрии. Запишем уравнение Вант-Гоффа для расчета осмоти-
ческого давления раствора электролита: |
|
π = iCRT |
|
αNaCI = 1 |
NaCI → Na+ + CI-; |
n = 2, |
i = 2. |
|
π = 2·CRT |
|
|
Раствор разбавленный, поэтому С → b – моляльную концентрацию раствора определим по понижению температуры замерзания:
tзам. = 2·Ккр. ·b; |
b = |
tзам. |
||||
2 Ккр. |
|
|||||
Подставим выражение b в уравнение: |
|
|
|
|||
π = 2 |
|
tзам. |
R T |
|
(10) |
|
|
|
|
||||
|
2 |
Ккр. |
|
|
|
|
59

Подставим в уравнение (10) значения входящих величин:
π = 2 0,56 0,082 298 = 7,35 атм 1,86 2
Ответ: Данный раствор NaCl является гипотоническим раствором, т.к. его осмотическое давление ниже осмотического давления крови (7,63 атм).
10.11. Определите относительную молекулярную массу неэлектролита, если при растворении 3 г этого вещества в 100 г воды температура кипения раствора повысилась на 0,087о.
Р е ш е н и е: Задача на нахождение относительной молекулярной массы по методу эбулиоскопии. Воспользуемся следствием из закона Рауля:
tкип = Кэб·b
Подставим значение моляльной концентрации (b) и решим полученное уравнение относительно молекулярной массы вещества:
tкип = |
Кэб m 1000 |
; |
Mr = |
Кэб m 1000 |
|
tкип mр−ля |
|||
|
Mr mр−ля |
|
||
Подставим численные значения:
M r = |
0,52 3 1000 |
= 180 |
|
0,087 100 |
|||
|
|
Ответ: Действительно, в воде была растворена глюкоза, относительная молекулярная масса которой 180.
10.12. Будут ли изотоничны растворы (неэлектролиты), если осмотическое давление одного 5 атм, а понижение температуры замерзания другого раствора составило 0,34о. Температура 25оС.
Р е ш е н и е: Задача на нахождение осмотического давления по методу криометрии. Запишем уравнение Вант-Гоффа для раствора неэлектролита:
π = CRT
Подставим выражение моляльной концентрации из выражения:
|
tзам. = b·Kкр , |
получим: π = |
tзам RT |
|
Kкр |
Рассчитаем величину π2 : π2 = 0,34 0,082 298 =5 атм
1,86
Ответ: Два раствора изотоничны, т.к. их осмотические давления равны.
60
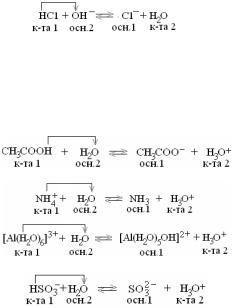
11. ПРОТОЛИТИЧЕСКАЯ ТЕОРИЯ КИСЛОТ И ОСНОВАНИЙ
В1923 г. И.Бренстед и Т.Лоури предложили протолитическую теорию кислот и оснований. Согласно этой теории:
кислота – это молекула или ион, который является донором протонов Н+, протогеном; основание – это молекула или ион, который является акцептором протонов, протофилом;
амфотерным соединением или амфолитом являются молекулы или ионы, способные как отдавать, так и присоединять протон, а, следовательно, вступать в реакции, характерные как для кислот, так и для оснований.
Врезультате взаимодействия протолитической кислоты и протолитического основания образуются новые сопряженные кислота и основание:
Кпротолитическим реакциям относят реакции нейтрализации, ионизации, гидролиза, аутопротолиза.
Классификация кислот и оснований в водных растворах
Протолитическими кислотами могут быть нейтральные молекулы, катионы и анионы. Вода может выполнять роль кислоты и основания.
а) нейтральные молекулы
б) катионы
в) анионы
Протолитическими основаниями могут быть также нейтральные молекулы, катионы и анионы:
а) нейтральные молекулы
61

б) катионы
в) анионы
Амфотерным соединением или амфолитом может быть любая частица в зависимости от характера партнера:
К амфолитам также относят Н2О, аминокислоты
Аутопротолиз – это реакция, в которой роль кислоты и основания выполняет одна и та же молекула
Таким образом, согласно протолитической теории кислотно-основные свойства соединения проявляются только в присутствии партнера с противоположными свойствами. Роль такого партнера может выполнять и молекула растворителя.
Классификация растворителей
Протогенные растворители – доноры протонов, обладающие только кислотными свойствами. В их присутствии растворенное вещество обладает свойством основания: HF, HC1, H2SO4, CH3COOH.
62
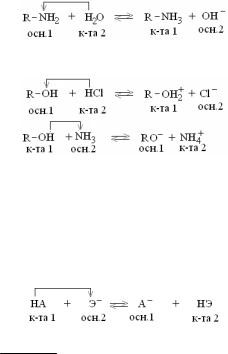
Протофильные растворители – акцепторы Н+, обладающие только основными свойствами: NH3 ж, R-NH2 , C5H5N, NH2-NH2. В их присутствии растворенное вещество становится кислотой:
Амфипротонные растворители проявляют и кислотные и основные свойства: Н2О, аминокислоты, низкомолекулярные спирты
Апротонные растворители не обладают способностью ни отдавать, ни присоединять Н+: С6Н6, С6Н5СН3.
Количественная характеристика кислотно-основных свойств
Протолиз – это равновесный процесс взаимодействия протолитической кислоты и протолитического основания, поэтому он может быть описан константой равновесия, которая называется константой про-
толиза.
= [A−][НЭ]
Кпротолиза [HA][Э−]
Рассмотрим каждую сопряженную реакцию:
HA ↔ H+ +A− |
KHA = |
[H+ ][A−] |
||
[HA] |
||||
|
|
|||
HЭ ↔ Н+ +Э− |
КНЭ = |
[H+ ][Э−] |
|
|
[H ] Э |
||||
|
|
|||
Константы КНА и КНЭ называются константами кислотности; разделим эти константы друг на друга.
KHA |
= |
[H+ ][A−][HЭ] |
= Kпротолиза |
|
[HA][H+ ][Э−] |
||
KНЭ |
|
||
Таким образом, константа протолиза выражается отношением констант ионизации протолитических кислот и показывает силу одной кислоты относительно другой (см. табл. 9).
63
12. БУФЕРНЫЕ СИСТЕМЫ
Буферными называются системы, которые обладают определенным значением рН и поддерживают это значение при разбавлении раствора
идобавлении небольших количеств сильных кислот или щелочей. Буферные системы 1 типа состоят из слабых кислот и солей этих ки-
слот и сильных оснований. При этом, с точки зрения протолитической теории, кислота, как донор протонов, служит для связывания ОН- ионов
посторонней щелочи. Роль протолитического основания выполняет анион соли, который связывает ионы Н+ посторонней сильной кислоты
иобразует молекулы слабой кислоты, входящей в состав буфера. Таков механизм буферного действия систем данного типа.
Примером буферных систем 1 типа могут служить ацетатный, фосфат-
ный и гидрокарбонатный буферы: CH3COOH – CH3COONa ; NaH2PO4 – Na2HPO4; H2CO3 – NaHCO3.
При добавлении сильной кислоты или щелочи имеют место следующие процессы, поддерживающие постоянство рН:
СН3СОО- + Н+ ↔ СН3СООН |
СН3СООН + ОН- ↔ СН3СОО- + Н2О |
||
основание |
кислота |
кислота |
основание |
НРО42- + Н+ ↔ Н2РО4- |
Н2РО4- + ОН- ↔ НРО42- + Н2О |
||
НСО3- + Н+ ↔ Н2СО3 |
Н2СО3 + ОН- ↔ НСО3- + Н2О |
||
Нетрудно заметить, что в процессе буферного действия один компонент буфера превращается в эквивалентное количество другого компонента.
Буферные системы 2 типа составлены из слабого основания и соли этого основания и сильной кислоты. Катионы соли служат протолитической кислотой. Примерами буферных систем 2 типа являются следующие:
аммиачная: NH3·H2O (NH4OH) – NH4Cl гидроксиламиновая: NH2OH – NH2OH·HCl (HONH3Cl) анилиновая: C6H5NH2·H2O – C6H5NH3Cl.
Процесс буферного действия аммиачной системы может быть выражен
уравнениями:
NH3·H2O + H+ ↔ NH4+ + H2O
основание
NH4+ + OH- ↔ NH3·H2O
кислота Для расчета рН буферных систем используются следующие формулы:
1 тип: рН = рКк + lg |
νсоли |
|
νкислоты |
||
|
64

2 тип: рН = 14 – (рКосн + lg ννсоли )
основ.
рК = -lgK, где К – константа ионизации слабой кислоты или слабого основания буферной системы.
ν = C·V или νэ = Сэ·V, т.е. число моль или моль эквивалентов. Для оценки способности буферной системы поддерживать постоянство рН при добавлении посторонних кислот или щелочей используется величина буферной емкости:
В = νэ , моль экв/л, V pH
где: νэ – число моль эквивалентов посторонней кислоты или щелочи, добавленное к 1 л буферного раствора;
V – объем буферного раствора, л; рН – изменение рН буфера.
Если в системе νэ основания > νэ кислоты, то в системе емкость по кислоте будет выше емкости по основанию Вк > Восн.
Если же νэ кислоты > νэ основания, то Восн > Вк. В буфере будет соблюдаться равенство Вк = Восн, если νэ кислоты = νэ основания, т.е. рН = рКк для буфера 1 типа и рН = 14 - рК для буфера 2 типа.
В процессе обмена веществ в организме человека образуется большое количество кислых продуктов. Сохранение постоянства реакции среды организмов обеспечивается наличием в них буферных систем: белковой, бикарбонатной, фосфатной, гемоглобиновой, оксигемоглобиновой, аммиачной.
Белковый буфер представляет систему из протеина и его соли, образованной сильным основанием. Компоненты этого буфера могут быть выражены как Pt-COOH – слабодиссоциированная белок-кислота и ее соль Pt-COONa.
Pt-COOH ↔ Pt-COO- + H+
Pt-COONa → Pt-COO- + Na+
При увеличении концентрации Н+ соль белка реагирует с кислотами, образуя слабодиссоциированную белок-кислоту и нейтральную соль:
Pt/\NHCOO2 − + Na+ +H+ +C1− → Pt/\NHCOOH2 + Na+ +Cl−
При взаимодействии со щелочами в реакцию вступает белок-кислота, и вместо сильного основания образуется слабоосновная соль:
Pt / COOH → Pt / COO− |
ионизированнаяформа белка. |
|
\NH2 |
+ |
|
|
\NH3 |
|
Белок в ионизированной форме проявляет буферное действие:
65

Pt / COO+ |
− +H+ +Cl− → Pt / COOH+ +Cl− |
\NH3 |
\NH3 |
При добавлении сильной кислоты образуется слабокислая соль белка (солянокислый протеин). При добавлении щелочи образуется слабоосновная соль белка (протеинат натрия) по уравнению:
Pt / COO+ |
− + Na+ +OH− → Pt \/NHCOOOH− |
+ Na+ |
\NH3 |
3 |
|
|
|
Благодаря белкам все клетки и ткани организма обладают определенным буферным действием.
Бикарбонатный буфер присутствует в крови в большой концентрации.
Все кислоты попадают в кровь, связываются бикарбонатным буфером. Na+ + HCO3- + H+ + Cl- → Na+ + Cl- + H2O + CO2.
Углекислый газ легкими выбрасывается в атмосферу. Таким образом, организм освобождается от избытка кислоты; накапливающиеся соль и вода удаляются с мочой и потом, а убыль бикарбоната пополняется в процессе тканевого дыхания.
Фосфатный буфер имеет наибольшее значение в таких биологических жидкостях, как моча и соки пищеварительных желез.
Наиболее мощными буферными системами крови являются гемоглобиновый и оксигемоглобиновый буферы, которые составляют 75 % буферной емкости крови. Буферные свойства этих систем идентичны белковой буферной системе.
Задачи и упражнения
12.1. Рассчитайте количество мл 0,1 М СН3СООН и 0,1 М CH3COONa, необходимое для приготовления 100 мл буферного рас-
твора с рН = 4,0, рКСН3СООН = 4,76.
Р е ш е н и е: Для систем 1 типа: рН = рКкисл + lg Cc Vc
Ск Vк
отсюда: lg |
Cc Vc |
= рН - рКкисл |
|
|
|
|
|||||||||
|
|
|
|
|
|
||||||||||
|
|
|
|
|
C |
к |
V |
|
|
|
|
|
|||
|
|
|
|
|
|
к |
|
|
|
|
|
||||
Подставим известные величины: |
|
|
|
|
|||||||||||
lg |
0,1 |
Vc |
|
= 4 − 4,76 = −0,76 , |
Vc + Vк = 100 мл |
||||||||||
0,1 |
Vк |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||
lg |
|
|
Vc |
|
|
|
= −0,76 ; |
Vc |
= 0,174 ; V |
= |
17,4 |
= 14,84 мл |
|||
|
|
|
|
|
|
||||||||||
|
(100 − Vc ) |
||||||||||||||
|
|
||||||||||||||
|
|
|
|
100 − Vc |
c |
1,174 |
|
||||||||
|
|
|
|
|
|
||||||||||
Vк = 100 - 14,84 = 85,16 мл
66
Таким образом, чтобы приготовить 100 мл 0,1 М ацетатного буфера необходимо слить 14,84 мл 0,1 М CH3COONa и 85,16 мл 0,1 М
СН3СООН.
12.2. Рассчитайте рН фосфатного буфера, состоящего из 100 мл 0,01 М NaH2PO4 и 20 мл 0,1 М Na2HPO4. Как изменится рН при добавлении к этой смеси 30 мл раствора NaOH с молярной концентрацией эквивалента Сэ = 0,02 моль экв/л? КН2РО−4 = 1,6·10-7
|
|
Р е ш е н и е: Рассчитаем рН: |
рН = рК |
|
− + lg |
Cc Vc |
||
|
|
Н2 |
Ск Vк |
|||||
|
|
|
|
|
|
РО4 |
||
|
|
− = -lg 1,6·10-7 = 6,8 |
|
|
|
|||
рК |
Н2 |
|
|
|
|
|||
|
РО4 |
|
|
|
|
|
|
|
рН = 6,8 + lg |
0,1 20 |
= 6,8 + lg 2 = 7,1 |
|
|
|
|||
0,01 100 |
|
|
|
|||||
|
|
|
|
|
|
|
|
|
Роль соли (основания) в буфере выполняет Na2HPO4, а роль кислоты –
NaH2PO4.
Н2РО4- + ОН- ↔ НРО42- + Н2О кислота НРО42- + Н+ ↔ Н2РО4- основание
При добавлении NaOH в буфере уменьшится количество кислоты NaH2PO4 и увеличится количество соли Na2HPO4. Расчет ведем в миллимолях (ммоль). νNaOH = X = 30 мл·0,02 = 0,6 ммоль
рН = 6,8 + lg |
2 |
+ X |
= 6,8 + lg |
2 |
+ 0,6 |
= 6,8 + lg |
2 |
,6 |
|
1 |
− X |
1 |
− 0,6 |
0 |
,4 |
||||
|
|
|
рН = 6,8 + 0,815 = 7,615 ≈ 7,62
Произошел значительный сдвиг рН в щелочную область ( рН = 0,52), что можно объяснить небольшим содержанием кислоты NaH2PO4 (1ммоль) в буфере, т.е. низкой емкостью по основанию
12.3. Аммиачный буфер содержит 20 мл 0,1 М NH3·H2O и 50 мл 0,2 М (NH4)2SO4. рКNH3 H2O = 4,74. Будет ли изменяться рН буфера
при разбавлении раствора в 2 раза? Ответ подтвердите расчетом.
Р е ш е н и е: Для буфера 2 типа: рОН = рКосн. + lg |
Сс Vc |
|||||||
|
||||||||
|
|
|
|
|
|
C |
ос |
V |
Рассчитаем исходное значение рНо: |
|
|
|
|
|
ос |
||
|
|
|
|
|
|
|
||
рНо =14 − 4,74 −lg |
0,2 50 |
= 9,26 −lg |
10 |
= 8,94 |
|
|
|
|
0,1 20 |
|
2 |
|
|
|
|||
|
|
|
|
|
|
|||
После разбавления раствора в 2 раза соответственно уменьшится вдвое число моль основания и соли;
67
pH = 9,26 − lg |
10 0,5 |
= 8,94 |
|
2 0,5 |
|||
|
|
Таким образом, как показал расчет, при разбавлении раствора рН буфера не изменилось.
12.4. Рассчитайте буферную емкость по кислоте, если при добавлении к 100 мл гидрокарбонатного буфера 25 мл раствора НСI Сэ = 0,05 моль экв/л рН изменилось от 3,5 до 4,0.
В |
= |
ν HCIэ |
|
25мл 10 −3 0,05 1000 |
|
|
−2 |
моль экв/л |
|
к |
|
V рН = |
(4,0 − 3,5) 100 |
= 2,5 |
10 |
|
|
|
|
|
|
12.5. |
Приготовлен буферный |
раствор, содержащий |
0,02 |
||||
моль/л анилина, 0,04 моль/л солянокислого анилина. К 1 л буферного раствора добавили 10 мл раствора NaOH Сэ = 0,1 моль экв/л. Рассчитайте емкость буфера по основанию. Изменится ли величина емкости, если предварительно буфер разбавить в 4 раза? Ответ подтвердите расчетом. КС6 Н5 NH2 = 4,1·10-10.
Р е ш е н и е: рКС6Н5NH2 = -lg 4,1·10-10 = 9,4
рН |
о |
= 14 − рК |
С6 Н5 NH 2 |
− lg |
|
νc |
= 14 − 9,4 − lg |
0,04 |
= 14 − 9,4 − 0,3 = 4,3 |
|||||||||||||||||
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
νосн |
|
0,02 |
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
После добавления 0,001 моль щелочи к исходному раствору: |
||||||||||||||||||||||||||
рН =14 −9,4 −lg |
0,04 −0,001 |
= 4,33 |
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
1 |
|
|
|
|
|
0,02 +0,001 |
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
B |
|
= |
|
νоснэ |
|
= |
|
0,001 |
= 0,033 моль экв/л |
|||||||||||||||||
|
V рН |
|
0,03 |
|
||||||||||||||||||||||
1осн |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
После добавления 0,001 моль щелочи к разбавленному раствору: |
||||||||||||||||||||||||||
рН 2 |
= 14 − 9,4 − lg |
|
|
0,01 − 0,001 |
|
= 14 − 9,4 − lg |
0,009 |
= 4,42 |
||||||||||||||||||
0,005 + 0,001 |
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
0,006 |
|
|||||||||||||
B 2осн = |
0,001 |
|
|
|
= |
|
0,001 |
= 0,0083 |
моль экв/л |
|||||||||||||||||
4,42 − 4,3 |
0,12 |
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
Таким образом, при разбавлении буферного раствора его емкость уменьшается.
Сравните емкость данных растворов по кислоте и основанию.
рКNH3 Н2О = 4,74. |
|
Ответ: 1) Вк = 0,042; |
Восн = 0,062 |
2) Вк = 0,070; |
Восн = 0,046. |
68

13. ЭЛЕКТРОХИМИЯ И ЭЛЕКТРОХИМИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ И ДИАГНОСТИКИ
ВМЕДИЦИНЕ И САНИТАРИИ
Вмедицинской практике широко применяют методы электродиагностики и электролечения, основанные на использовании электрической проводимости тканей организма и ответных реакций на электрическое воздействие.
Электрохимические методы, применяемые в медицине, делят на две группы. К первой относят методы, требующие внешнего источника тока; они изучают явления и процессы, протекающие в тканях и жидкостях организма при прохождении через них электрического тока. Ко второй группе относят методы без использования внешнего источника тока; они основаны на измерении электродвижущей силы гальванических элементов – составляющих электрохимических систем. К первой группе относится кондуктометрия, ко второй – потенциометрия.
Кондуктометрия
Кондуктометрией называют электрохимический метод анализа, основанный на изучении электрической проводимости проводников ионного типа.
Биологические жидкости организма, внутри- и межклеточная жидкость содержат большое количество сильных и слабых электролитов. проницаемость биологических мембран во многом определяется концентрацией электролитов.
Определение содержания электролитов в тканях и жидкостях организма позволяет проводить диагностику некоторых патологических состояний.
Электрическая проводимость растворов электролитов
Существуют проводники двух типов: 1 и 2 рода. В проводниках 1 рода носителями электричества являются электроны. К ним относят металлы. Растворы и расплавы электролитов относят к проводникам 2 рода. Перенос электричества в них осуществляется положительными и отрицательными ионами. Величина, характеризующая способность вещества проводить электрический ток, называется электрической проводи-
мостью – L.
Если сопротивление проводника R, электрическая проводимость этого проводника L = R1 . Единица измерения L Стилл обратный Ом-. Сопро-
тивление однородного проводника прямопропорционально его длине и обратнопропорционально площади его поперечного сечения:
69

R = ρSl ,
где R – сопротивление проводника, Ом; ℓ – длина проводника, м;
S – площадь поперечного сечения, м2;
ρ – удельное сопротивление материала проводника, Ом·м.
Удельной электрической проводимостью называют величину, изме-
ряемую обратным значением его удельного сопротивления: æ = ρ1 ,
где ρ – удельное сопротивление, Ом·м или См/м; æ – удельная электрическая проводимость, Ом-·м-.
Удельная электрическая проводимость – характеристика материала проводника, численно равная проводимости вещества, заключенного в объеме между двумя электродами, отстоящими друг от друга на рас-
2 |
|
1 |
|
l |
|
стоянии ℓ = 1 м и с площадью S = 1 м : |
æ = |
|
|
. |
|
R |
S |
||||
Электрическая проводимость раствора одного и того же вещества зависит от концентрации вещества в растворе, поэтому для сравнения способности различных электролитов проводить электрический ток применяют молярную электропроводимость λV.
Молярной электрической проводимостью называют величину, изме-
ряемую электрической проводимостью объема раствора, содержащего один моль эквивалента вещества и заключенного между электродами, отстоящими друг от друга на расстоянии один метр.
λV = æ/1000С,
где æ – удельная электропроводимость, Ом-·м-; С – молярная концентрация раствора, моль/л;
λV – молярная электропроводимость, Ом-·м2·моль-.
Удельная и молярная электропроводимости зависят от природы электролитов, температуры, концентрации.
Закон Кольрауша
Электрический ток в растворах электролитов переносится катионами и анионами, движущимися в противоположных направлениях. При большом разведении раствора катионы и анионы перемещаются независимо, и предельную удельную электрическую проводимость можно определить æ∞ = æА + æК, а предельную молярную электропроводимость рассчитывают по формуле:
λ∞ = æ∞/1000С = æА/1000С + æК/1000С
70
Предельная молярная электрическая проводимость иона прямопропорциональна его электрической подвижности (U)
λ = F·U,
где F – постоянная Фарадея, 96500 Кл/моль;
Если обозначить æА/1000С = UA; æK/1000С = UK,
то λ∞ = UA + UK.
UA и UK – предельные молярные подвижности анионов и катионов. Закон Кольрауша гласит: предельная молярная электропроводимость λ∞ раствора электролита равна сумме молярных подвижностей анионов и катионов, входящих в состав этого электролита.
Молярные подвижности различных ионов вычислены и сведены в таблицы (см. табл. 15). С помощью табличных данных можно рассчитывать предельные молярные электрические проводимости растворов электролитов.
Электрическая проводимость клеток и тканей организма
Живой организм с точки зрения электрохимии можно рассматривать как систему, состоящую из клеток и межклеточного пространства, заполненного раствором электролитов. Удельная электрическая проводимость клеток составляет 10-3-10-9 Ом-·м-, а межклеточной жидкости – 10-3 Ом-·м-. По электрической проводимости биологические ткани и жидкости можно расположить в следующей последовательности: кровь, лимфа, желчь, мышечная ткань, серое вещество мозга, ткань легких, ткань печени, жировая ткань, костная ткань. Изменение электрической проводимости тканей и клеток используют для диагностики заболеваний.
Кондуктометрический метод исследования делят на прямую кондуктометрию и кондуктометрическое титрование. Прямую кондуктометрию используют для определения общего содержания и состояния электролитов в биологических средах: плазме, сыворотке крови, желудочном соке, моче, тканевых жидкостях. Кондуктометрическое титрование применяют для количественного определения кислот, оснований, солей в различных жидкостях, в том числе и биологических.
Сущность прямой кондуктометрии сводится к измерению сопротивления проводника с помощью прибора – кондуктометра. Кондуктометрическая ячейка представляет стеклянный сосуд с вмонтированными в него платиновыми электродами. При прямых кондуктометрических измерениях строится график зависимости электропроводимости от концентрации L = f(C), по которому определяют концентрацию электролита в исследуемом растворе.
Кондуктометрическое титрование – это метод анализа, в котором точка эквивалентности определяется по изменению электрической проводи-
71

мости раствора в ходе титрования. Экспериментально определяется зависимость между электрической проводимостью титруемого раствора и добавляемым объемом титранта, и строится график зависимости L
= f(Vтитранта).
Например, раствор сильной кислоты НС1 неизвестной концентрации титруем раствором NaOH. Идет реакция нейтрализации:
HCl + NaOH → NaCl + H2O
H+ + Cl- + Na+ + OH- → Na+ + Cl- + H2O
Протоны, обладающие большей подвижностью, замещаются менее подвижными ионами Na+, Электрическая проводимость вследствие этого уменьшается и в точке эквивалентности становится минимальной. В точке эквивалентности соблюдается закон эквивалентов:
Vиссл.р-ра ·Сэ иссл.р-ра = Vтитранта ·Сэ титранта, по которому рассчитывают кон-
центрацию исследуемого раствора.
Задачи и упражнения
13.1. При 18оС электропроводность 5 % раствора Mg(NO3)2 равна 4,38 Ом-1·м-1, плотность его 1,038 г/мл. Вычислите кажущуюся степень ионизации Mg(NO3)2 в указанном растворе.
Р е ш е н и е: Молярная концентрация 5 % раствора Mg(NO3)2
равна:
С = |
|
ω ρ1000 |
= |
5 0,38 1000 |
= 0,35моль/ л |
||
100 МMg(NO3 )2 |
|
||||||
|
|
100 148 |
|||||
Молярная электропроводность равна: |
|||||||
|
λс = |
4,38 10−3 |
=1,25 10−2 Ом-1·м2·моль-1 |
||||
|
|
||||||
|
|
0,35 |
|
|
|
|
|
Значения λ∞ вычисляем, исходя из подвижности ионов: |
|||||||
λMg2+ = 89,2·10-4, |
|
λNO3− = 62,6·10-4 (табл. 15, приложение) |
|||||
λ∞ = (89,2 + 2·62,6) ·10-4 = 214,4·10-4 = 2,144·10-2 Ом-1·м2·моль-1
=1,25 10 −2 =
λ∞ 2,144 10 −2 0,583 , α = 58,3 %
13.2.При 18оС электропроводность насыщенного раствора иодида серебра равна 4,144·10-6 Ом-1·м-1; электропроводность воды, определенная в этих же условиях, 4·10-6 Ом-1·м-1. Вычислите концентрацию
AgI (моль/л) в насыщенном растворе (растворимость). Подвижности ионов Ag+ и I- соответственно равны 53,5·10-4 и 66,5·10-4 Ом-1·м2·моль-1 (табл. 15, приложение).
Р е ш е н и е: Насыщенный раствор труднорастворимого вещества можно считать бесконечно разбавленным. По электропровод-
72
