
- •Иодометрия.
- •Определение восстановителей.
- •Определение окислителей.
- •Определение кислот.
- •Приготовление рабочих растворов.
- •Условия проведения иодометрии.
- •Лабораторная работа. Определение активного хлора в растворе хлорной воды методом иодометрии. Определение активного хлора в белильной извести методом иодометрии.
- •Ход выполнения работы
- •Контрольные вопросы.
- •Рекомендуемая литература.
- •Лабораторная работа. Определение концентрации перекиси водорода методом иодометрии.
- •Ход выполнения работы
Ход выполнения работы
Полученную навеску белильной извести растереть в фарфоровой ступке с несколькими каплями воды и небольшими порциями сливать с дистиллированной водой в мерную колбу емкостью 100 мл, довести объем водой до метки и перемешать.
В колбу для титрования пипеткой вносят 10 мл полученной суспензии, прибавляют туда же мерным цилиндром по 10 мл иодида калия и соляной кислоты. Содержимое в колбе окрашивается в цвет иода, что указывает на его образование.
Образовавшийся иод титруют титрованным раствором тиосульфата натрия до соломенного цвета, затем вносят индикатор (2-3 капли 5% свежеприготовленного раствора крахмала) и продолжают титровать до исчезновения синей окраски. Повторить титрование 3 раза, результаты занести в журнал.
По среднему объему тиосульфата рассчитать массу хлора -m(Cl2) в навеске двумя способами:
а) через титр тиосульфата (![]() );
);
б) через титр тиосульфата натрия по
хлору (![]() );
);
5. Рассчитать процентное содержание хлора в навеске.
6. Оформить отчет по лаб. работе. Определить метод и вид титрования. Написать все уравнения реакций в молекулярном виде, составить для каждой ионно-электронный баланс, определить эквивалентные массы окислителей и восстановителей в данных реакциях..
Контрольные вопросы.
Какие реакции называются окислительно-восстановительными?
От чего зависит скорость окислительно-восстановительных реакций?
Какие рабочие растворы и индикаторы используются в иодометрии?
Чему равна эквивалентная масса тиосульфата в реакции с иодом?
Как определяются окислители, восстановители, кислоты данным методом?
К навеске 1,5 г технического сульфита натрия после растворения было прибавлено 100 мл 0.1 н раствора иода. На титрование избытка иода потребовалось 42 мл 0,05н раствора Na2S2O3∙5Н2О. Определить содержаниеNa2SO3 в техническом образце.
К 30 мл 0,105н KMnO4 прибавили избытокKI, и Н2SO4. На титрование выделившегося иода израсходовали 33 мл тиосульфата натрия. Определить
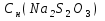 .
.Какая масса K2Sсодержится в растворе, если на титрование этого раствора расходуется 40 мл 0,02н раствора иода?
Сколько мл 0,5н раствора Na2S2O3потребуется для титрования иода, выделившегося при взаимодействии 50 мл 0,2н раствораKMnO4с избыткомKI, и Н2SO4?
Сколько потребуется тиосульфата натрия для приготовления 0,5 л 0,02н раствора?
К 30 мл 0,107н раствора HClприбавлен избытокKIиKIO3.На титрование выделившегося иода было затрачено 33,27 мл тиосульфата натрия.Определить
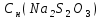 .
.Определить фактор эквивалентности для I-при окислении доI2.
Какие вещества анализируют в методе иодометрии обратным титрованием?
Почему при иодометрическом определении окислителей и кислот иодид калия добавляют в избытке?
В реакциях осаждения эквивалентная концентрация раствора K2Cr2O7составляет 0,1 моль/л. Вычислить эквивалентную концентрацию этого раствора в реакциях окисления.
Рекомендуемая литература.
А.П.Цитович Курс аналитической химии. М.., «Лань»,2007
В.Д.Пономарев Аналитическая химия. М., «Медицина», 1988
