
- •Курс лекцій з фізики
- •I. Фізичні основи механіки…………………………………………………….18
- •II. Електростатика…………………………………………………………….....47
- •III. Постійний електричний струм………………………………………..77
- •IV. Електромагнетизм………………………………………………………….…91
- •V. Коливання та хвилі……………………………………………...…122
- •VI. Хвильова оптика……………………………………………….…150
- •VII. Ядерна фізика…………………………………………………….244
- •VIII. Основи молекулярної фізики і термодинаміки……………...261
- •IX. Фізика твердого тіла………………………………………..…283
- •Змістовний модуль № 1
- •Вступна лекція
- •Роль фізики у розвитку техніки та вплив техніки на розвиток фізики
- •I. Фізичні основи механіки
- •Механічний рухполягає в зміні з часом взаємного розташування тіл, або їх частин у просторі.
- •1. Основи кінематики поступального руху
- •В). Циліндрично-полярні координати ρ, φ, z.
- •Якщо траекторія – пряма лінія , то такий рух називають прямолінійним, а якщо крива – криволінійним. Найпростішим прикладом криволінійного руху є рух матаеріальної точки по колу :
- •2. Основи кінематики обертального руху
- •3. Абсолютні і відносні швидкості та прискорення
- •І закон Ньютона
- •Іі закон Ньютона
- •III закон Ньютона
- •5. Закон збереження імпульсу
- •6. Рух тіла із змінною масою. Реактивний рух
- •Імпульс системи
- •7. Центр мас. Закон руху центра мас
- •Одержана формула виражає закон руху центра мас
- •7.1. Сили інерції
- •Приклади руху тіл у нісв
- •8.1 Момент сили та момент імпульса
- •Напрям вектора визначається за правилом векторного добутку.
- •Проекція вектора на довільну вісьZ, що проходить через точку о , називаєтьсямоментом сили відносно цієї осі :
- •8.2 Рівняння моментів
- •8.3 Момент інерції тіла відносно осі обертання
- •8.4 Рівняння динаміки обертального руху
- •8.5 Закон збереження момента імпульса
- •9. Пружні напруження. Закон Гука. Деформація стрижнів
- •10. Робота. Енергія
- •10.1 Кінетична енергія Знайдемо роботу , яку виконує силапри переміщенні матеріальної точки масоюmіз положення 1 в положення 2.
- •10.3 Закон збереження механічної енергії
- •10.4 Кінетична енергія тіла при обертальному русі
- •11. Рівняння руху та рівноваги твердого тіла
- •Іі. Електростатика
- •15. Закон збереження електричного заряду. Електричне поле. Напруженість електричного поля
- •16. Потік вектора напруженості.
- •17. Теорема Остроградського-Ґаусса
- •18. Застосування теореми Остроградського-Ґаусса до розрахунку напруженості електростатичних полів
- •20. Напруженість як градієнт потенціалу
- •Розглянемо випадок переміщення одиничного додатнього точкового заряду q iз точки 1 в точку 2 вздовж осі X.
- •17. Провідники у електростатичному полі
- •Явище перерозподілу поверхневих зарядів на провіднику у зовнішньому електростатичному полі називається електростатичною індукцією, а перерозподілені заряди –індукованими зарядами.
- •17.1 Електрична ємність
- •17.2 Взаємна електроємність
- •18. Енергія зарядженого відокремленого провідника, конденсатора. Енергія електростатичного поля. Об’ємна густина енергії
- •19. Діелектрики у електростатичному полі
- •19.1 Типи діелектриків. Електронна і орієнтаційна поляризація
- •19.2 Неполярні діелектрики. Електронна поляризація
- •19.3 Полярні діелектрики. Дипольна, або орієнтаційна поляризація
- •19.4 Іонні діелектрики. Іонна поляризація
- •20. Механічні ефекти в діелектриках. Електрострикція та п’єзоефект. Сегнотелектрики.
- •22.Закон Ома у диференціальній формі
- •23. Закон Джоуля-Лєнца
- •24. Закон Ома у інтегральній формі
- •25. Розрахунок параметрів електричних кіл
- •26. Електричний струм у вакуумі
- •27. Робота виходу електронів з металу. Контактна різниця потенціалів
- •28. Термоелектричні явища
- •29. Електричний струм у газах
- •29.1. Типи газових розрядів:
- •IV. Електромагнетизм
- •Якщо контур зі струмом повернути на 90°від рівноважного положення, то на нього буде діяти максимальний обертальний моментМmax.
- •31. Закон Біо-Савара-Лапласа
- •32. Закон повного струму для магнітного поля у вакуумі. Вихровий характер магнітного поля
- •Якщо контур не охоплює провідник зі струмом, то
- •33. Cила Лоренца
- •34. Контур зі струмом у магнітному колі
- •35. Магнітний потік. Теорема Остроградського-Ґаусса
- •36. Робота переміщення провідника і контуру зі струмом у магнітному полі
- •Матеріал для самостійної роботи
- •37. Магнітні моменти атомів. Намагніченість. Атоми в магнітному полі
- •39. Магнітне поле в речовині. Закон повного струму для магнітного поля в речовині. Напруженість магнітного поля
- •40. Феромагнетики
- •41. Явище електромагнітної індукції. Закон Ленца. Закон електромагнітної індукції (закон Фарадея)
- •42. Явище самоіндукції. Індуктивність
- •43. Явище взаємної індукції
- •44. Енергія магнітного поля
- •Змістовний модуль 4
- •V.Коливання та хвилі
- •45. Гармонічні коливання. Диференціальне рівняння гармонічних коливань
- •46. Вільні електромагнітні коливання
- •Графік залежності хвід часу наведено на рис.1
- •48. Диференціальне рівняння вимушених коливань і його розв’язок. Резонанс
- •49. Вимушені коливання у електромагнітному коливальному контурі. Кола змінного струму. Закон Ома
- •50. Резонанс напруг
- •51. Розгалуження змінних струмів.
- •54. Інтерференція хвиль. Рівняння стоячої хвилі
- •55.Звукові хвилі та їх властивості. Ефект Допплера.
- •Ефект Допплера
- •56. Основи теорії Максвелла для електромагнітного поля. Струм зміщення
- •57. Рівняння Максвелла для електромагнітного поля
- •58. Основні властивості електромагнітних хвиль
- •Змістовний модуль 8
- •Vіii. Основи молекулярної фізики і термодинаміки
- •99. Статистичний і термодинамічний
- •100. Рівняння молекулярно-кінетичної теорії ідеального газу для тиску
- •101. Середня кінетична енергія
- •102. Розподіл Максвелла молекул
- •103. Барометрична формула. Розподіл Больцмана частинок у зовнішньому потенціальному полі
- •104. Закон рівномірного розподілу енергії за ступенями вільності молекул
- •105. Перший закон термодинаміки. Робота газу при зміні його об'єму
- •106. Теплоємність. Класична молекулярно-кінетична теорія теплоємностей ідеального газу та її обмеженість.
- •107. Застосування першого закону термодинаміки до ізопроцесів
- •108. Адіабатний процес. Застосування першого закону термодинаміки до адіабатного процесу ідеального газу
- •109. Коловий процес. Теплові двигуни і холодильні машини. Оборотні і необоротні процеси
- •110. Цикл Карно і його коефіцієнт корисної дії для ідеального газу
- •111. Другий закон термодинаміки
- •112. Ентропія. Ентропія ідеального газу
- •113. Теорема Нернста та її наслідки
- •Іх. Фізика твердого тіла
- •114. Поняття про квантові статистики Бозе – Ейнштейна і Фермі - Дірака
- •115. Розподіл електронів провідності в металі за енергіями. Енергія Фермі
- •116. Енергетичні зони в кристалах
- •117. Розподіл електронів по енергетичних зонах. Валентна зона і зона провідності. Метали, діелектрики і напівпровідники
- •118. Власна провідність напівпровідників
- •119. Домішкова провідність напівпровідників
- •121. Люмінесценція твердих тіл
- •123.Рідкі кристали
101. Середня кінетична енергія
молекул. Молекулярно-кінетичне
трактування абсолютної температури
Знайдемо вираз для середньої кінетичної енергії поступального руху молекули ідеального газу:
О![]()
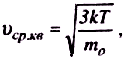 скільки
скільки
Т![]() о
о
О тже,
середня кінетична енергія поступального
руху молекул ідеального газу залежить
тільки від його абсолютної температури,
<к>
прямо пропорційна до Т.
тже,
середня кінетична енергія поступального
руху молекул ідеального газу залежить
тільки від його абсолютної температури,
<к>
прямо пропорційна до Т.
На рис. 39 зображено залежність <к> від Т. Якщо T = 0, <к> = 0, тобто припиняється поступальний рух молекул газу, а отже, дорівнює нулю і його тиск.
Отже, абсолютна температура є міра середньої кінетичної енергії поступального руху молекул.
О днак
в області температур, близьких до
абсолютного нуля, поведінка молекул
описується не класичними законами, а
законами квантової механіки.
днак
в області температур, близьких до
абсолютного нуля, поведінка молекул
описується не класичними законами, а
законами квантової механіки.
102. Розподіл Максвелла молекул
ідеального газу за швидкостями
теплового руху
Внаслідок безперервного хаотичного руху молекул, а також взаємного зіткнення молекул піл час цього руху кожна молекула зокрема може змінювати свою швидкість як за величиною, так і за напрямком. Тому в газі будуть як швидкі, так і повільні молекули. Але, хоча швидкості окремих молекул змінюються, властивості газу у стані термодинамічної рівноваги загалом при цьому не змінюються: залишаються постійними параметри системи. Зумовлено це тим, що швидкості газових молекул підлягають певному законові, тобто, незважаючи на повну хаотичність молекулярних рухів, розподіл молекул за швидкостями виявляється не випадковим, а цілком визначеним. До того ж він є однозначним і єдино можливим.
Дж. Максвелл теоретично розв'язав задачу про розподіл молекул ідеального газу за швидкостями поступального руху. Він встановив закон, шо дає змогу визначити, яка кількість молекул dn із загальної кількості n молекул ідеального газу в одиниці об'єму мають при даній температурі швидкості, які лежать в інтервалі від v до v + dv. Дж. Максвелл вважав, що газ складається з великої кількості n однакових молекул, температура в усіх частинах посудини з газом теж однакова і відсутні зовнішні дії на газ.
Якщо розбити діапазон швидкостей молекул на малі інтервали, які дорівнюють dv, то на кожний інтервал швидкості припадатиме деяка кількість молекул dn(v), що мають швидкість в інтервалі dv.
Закон Максвелла описусться деякою функцією f(v), шо називається
функцією розподілу молекул за швидкостями руху.
Ц![]() я
функція визначає відносну кількість
молекул швидкості яких лежать в
інтервалі від v
до
v + dv, тобто
я
функція визначає відносну кількість
молекул швидкості яких лежать в
інтервалі від v
до
v + dv, тобто
![]()
з![]() відси
відси
Застосовуючи методи теорії імовірності, Максвелл знайшов функцію f(v) у такому вигляді:
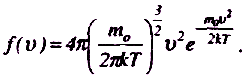
К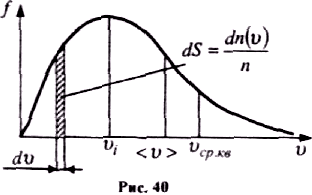
 онкретний
вигляд функції залежить від роду
газу (m0)
і від параметра стану (Т). Графік функції
f(v) наведений на рис. 40. Функція f(v)
починається
від нуля, досягає максимуму, а потім
асимптотично пряму до нуля. Крива
несиметрична відносно максимального
значення f(v). Відносна
кількість молекул dn(v)/n, швидкості
яких
лежать в інтервалі від v
до
v + dv, числово дорівнює площі заштрихованої
ділянки на рис. 40.
онкретний
вигляд функції залежить від роду
газу (m0)
і від параметра стану (Т). Графік функції
f(v) наведений на рис. 40. Функція f(v)
починається
від нуля, досягає максимуму, а потім
асимптотично пряму до нуля. Крива
несиметрична відносно максимального
значення f(v). Відносна
кількість молекул dn(v)/n, швидкості
яких
лежать в інтервалі від v
до
v + dv, числово дорівнює площі заштрихованої
ділянки на рис. 40.
В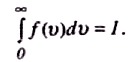 ся
площа, обмежена кривою розподілу і
віссю абсцис, числово дорівнює кількості
молекул, швидкості яких мають різні
значення від 0 до.
Оскільки цю умову задовольняють всі n
молекул, то площа, що розглядається,
дорівнює одиниці:
ся
площа, обмежена кривою розподілу і
віссю абсцис, числово дорівнює кількості
молекул, швидкості яких мають різні
значення від 0 до.
Оскільки цю умову задовольняють всі n
молекул, то площа, що розглядається,
дорівнює одиниці:
Швидкість, при якій f(v) максимальна, називається найімовірнішою швидкістю vi.
Використовуючи умову максимуму виразу f(v), можна знайти вираз для найімовірнішої швидкості:

![]()
оскільки
Середня арифметична швидкість молекул <v> визначається за формулою
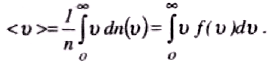
Підставляючи сюди f(v) й інтегруючи, отримаємо
![]()
О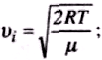 тже,
є три швидкості, які характеризують
стан газу (рис. 40):
тже,
є три швидкості, які характеризують
стан газу (рис. 40):
найімовірніша
![]()
середня арифметична
![]()
середня квадратична
При збільшенні температури (або зменшенні маси молекул) максимум кривої f(v) зміщується у бік більших швидкостей, а його абсолютна величина зменшується, причому площа, яка охоплена кривою f(v) і віссю v, залишається незмінною.
З![]() акон
Максвелла зручно формулювати,
ввівши відносну швидкість
акон
Максвелла зручно формулювати,
ввівши відносну швидкість
де v - дана швидкість, а vi - найімовірніша швидкість для
молекул даного газу при даній температурі.
Розподіл, який визначає кількість молекул, відносні швидкості яких лежать у межах від uв до uв + duв , має такий вигляд:
![]()
З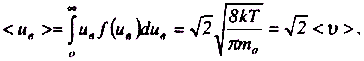 найдемо
середню відносну швидкість молекул
ідеального газу:
найдемо
середню відносну швидкість молекул
ідеального газу:
де <v> - середня арифметична швидкість.
