
Контрольная работа № 2
111. Дайте определение понятиям: степень окисления, окисление, восстанов-
ление.
- Укажите, в каких из приведенных процессов происходит окисление, а
в каких – восстановление.
- Определите какое количество электронов отдается или принимается в
каждом процессе.
- Напишите полуреакцию с учетом кислотности (там, где указана кис-
лотность среды).
|
|
рН < 7 |
pH > 7 |
pH = 7 |
|
|
11. |
IO4- I2 |
MnO2 MnO42- |
H2S SO42- |
CrO2- CrO33- |
Решение
Степень окисления - условный заряд атома в молекуле в предположении, что электронные пары, осуществляющие связь, полностью смещены в сторону более электроотрицательных атомов.
Окисление — процесс отдачи электронов, с увеличением степени окисления.
Восстановле́ние – процесс присоединения электронов, при этом степень окисления понижается.
2IO4- + 14е I2 восстановление;
MnO2 – 2е MnO42- окисление;
H2S – 8е SO42- окисление;
CrO2- ± 0е CrO33-
2IO4- + 16H+ + 14е I2 + 8H2O
MnO2 + 4OH- – 2е MnO42- + 2H2O
H2S + 2H2O – 8е SO42 + 10H+
112. Какие из перечисленных веществ и за счёт какого элемента проявляют
обычно окислительные, а какие – восстановительные свойства? Какие из
них обладают окислительно-восстановительной двойственностью?
Ответ обосновать положением элемента в периодической системе и про-
являемой степенью окисления.
11. I2, H2S, K2FeO4;
Решение
I2 – это вещество обладает окислительно – восстановительной двойственностью за счет атома иоду, потому что атом йоду в молекуле I2 находится в степени окисления 0. Степень окисления 0 для йоду это промежуточная, потому что он находится в Периодической системе в VII группе, а самая низкая степень окисления для элементов этой группы - -1; наивысшая - +7.
H2S – это вещество обладает окислительными свойствами за счет атома S, потому что атом S в молекуле H2S находится в степени окисления -2. Степень окисления -2 для S это самая низкая, потому что он находится в Периодической системе в VI группе, а самая низкая степень окисления для элементов этой группы - -2; наивысшая - +6.
K2FeO4 – это вещество обладает восстановительными свойствами за счет атома Fe, потому что атом Fe в молекуле K2FeO4 находится в степени окисления +6. Степень окисления +6 для Fe это наивысшая, потому что он хоть и находится в Периодической системе в VIII группе, но для Fe наивысшая степень окисления будет +6, потому что это элемент побочной подгруппы.
113. Уравняйте нижеприведенные реакции электронно-ионным методом
(метод полуреакций) и определите тип ОВР (меж-, внутримолекулярная,
диспропорционирования):
11. As + H2SO4 As2O3 + SO2 + H2O;
KMnO4 + MnSO4 + H2O MnO2 + K2SO4 + H2SO4;
Решение
As + H2SO4 As2O3 + SO2 + H2O
В. О.
 2As
– 6е
As2O3
1
2As
– 6е
As2O3
1
 SO42-
+ 2е
SO2
3
SO42-
+ 2е
SO2
3
2As – 6е + 3SO42- + 6е As2O3 +3SO2
2As + 3SO42- As2O3 +3SO2
2As + 3SO42- + 6Н+ As2O3 +3SO2 + 3H2O
2As + 3H2SO4 As2O3 + 3SO2 + 3H2O
Тип ОВР – межмолекулярная.
KMnO4 + MnSO4 + H2O MnO2 + K2SO4 + H2SO4
О. В.
 Mn+2
+ 2H2O
– 2е
MnO2
+ 6Н+
3
Mn+2
+ 2H2O
– 2е
MnO2
+ 6Н+
3
MnO4- + 2H2O + 3е MnO2 + 4ОН- 2

3Mn+2 + 6H2O – 6е + 2MnO4- + 4H2O + 6е 3MnO2 + 12Н+ + 2MnO2 + 8ОН-
2MnO4- + 3Mn+2 + 10H2O 5MnO2 + 4Н+ + 8H2O
2MnO4- + 3Mn+2 + 2H2O 5MnO2 + 4Н+
2KMnO4 + 3MnSO4 + 2H2O 5MnO2 + K2SO4 + 2H2SO4
Тип ОВР – репропорционирование (конпропорционирование).
114. Каким образом определяют возможность протекания окислительно-
восстановительных реакций? Используя значения стандартных вос-
становительных потенциалов, ответьте на следующие вопросы.
11.Можно ли использовать бромную воду для окисления в нейтральной среде следующих веществ: H2SO3, NaCl, KI? Приведите возможные уравнения реакций.
Решение
1.Возьмем из справочника значения стандартных восстановительных потенциалов:
E0(Br2/2Br-) = 1,06 B
E0(SO42-/SO32-) = - 0,17 B
E0(Cl2/2Cl-) = 1,36 B
E0(I2/2I-) = 0,54 B
2.Найдем разницу стандартных восстановительных потенциалов:
Δ E0 = E0OX - E0RED
За условием задания окислителем выступает бромная вода.
- для вещества H2SO3
Δ E0 = E0(Br2/2Br-) - E0(SO42-/SO32-)
Δ E0 = 1,06 – (- 0,17) = 1,23 В
Разница положительная, тому реакция возможна.
- для вещества NaCl
Δ E0 = E0(Br2/2Br-) - E0(Cl2/2Cl-)
Δ E0 = 1,06 – 1,36 = - 0,3 В
Разница негативная, тому реакция не возможна.
- для вещества KI
Δ E0 = E0(Br2/2Br-) - E0(I2/2I-)
Δ E0 = 1,06 – 0,54 = 0,52 В
Разница положительная, тому реакция возможна.
3.Складаемо уравнение реакции:
 -
для вещества H2SO3
-
для вещества H2SO3
H2SO3 + H2O – 2е SO42- + 4Н+ 1

Br2 + 2e 2Br- 1
H2SO3 + H2O – 2е + Br2 + 2e SO42- + 4Н+ + 2Br-
H2SO3 + Br2 + H2O SO42- + 2Br- + 4Н+
H2SO3 + Br2 + H2O H2SO4 + 2HBr
 -
для
вещества
KI
-
для
вещества
KI
2I- – 2е I2 1

Br2 + 2e 2Br- 1
2I- – 2е + Br2 + 2e I2 + 2Br-
2I- + Br2 I2 + 2Br-
2KI + Br2 I2 + 2KBr
130. Выразите молекулярными и ионными уравнениями реакций нижеприве-
денные схемы.
- Напишите уравнения диссоциации и выражения констант нестой-
кости комплексных ионов.
- Объясните возможность или невозможность протекания этих реакций
(используя значения констант нестойкости комплексов и величин
произведения растворимости осадков).
11.Cd(NO3)2 [CdI4]2- [Cd(NH3)4]2+ [Cd(OH)4]2- CdS;
Решение
Cd(NO3)2 [CdI4]2- [Cd(NH3)4]2+ [Cd(OH)4]2- CdS
-
Cd(NO3)2 + 4KI = K2[CdI4] + 2KNO3
Cd2+ + 2NO3- + 4K+ + 4I- = 2K+ + [CdI4]2- + 2K+ + 2NO3-
Cd2+ + 4I- = [CdI4]2-
-
K2[CdI4] + 4NH3 = [Cd(NH3)4]I2 + 2KI
2K+ + [CdI4]2- + 4NH3 = [Cd(NH3)4]2+ + 2I- + 2K+ + 2I-
[CdI4]2- + 4NH3 = [Cd(NH3)4]2+ + 4I-
-
[Cd(NH3)4]I2 + 4KOH = K2[Cd(OH)4] + 4NH3 + 2KI
[Cd(NH3)4]2+ + 2I- + 4K+ + 4OH- = 2K+ + [Cd(OH)4]2- + 4NH3 + 2K+ + 2I-
[Cd(NH3)4]2+ + 4OH- = [Cd(OH)4]2- + 4NH3
-
K2[Cd(OH)4] + H2S = CdS↓ + K2S + 4H2O
2K+ + [Cd(OH)4]2- + H2S = CdS↓ + 2K+ + S2- + 4H2O
[Cd(OH)4]2- + H2S = CdS↓ + S2- + 4H2O
5.Напишем уравнения диссоциации и выражения констант нестойкости
комплексных ионов:
- для K2[CdI4]
Диссоциация
1 – степень
K2[CdI4] ↔ 2K+ + [CdI4]2-
2 – степень
[CdI4]2- ↔ Cd2+ + 4I-
Константа нестойкости

- для [Cd(NH3)4]I2
Диссоциация
1 – степень
[Cd(NH3)4]I2 ↔ [Cd(NH3)4]2+ + 2I-
2 – степень
[Cd(NH3)4]2+ ↔ Cd2+ + 4NH3
Константа нестойкости

- для K2[Cd(OH)4]
Диссоциация
1 – степень
K2[Cd(OH)4] ↔ 2K+ + [Cd(OH)4]2-
2 – степень
[Cd(OH)4]2- ↔ Cd2+ + 4OH-
Константа нестойкости

5.Объясняем возможность или невозможность протекания этих реакций:
А) Возьмем из справочника константы нестойкости и произведения растворимости:
Кн ([CdI4]2-) = 3,8 * 10-6
Кн ([Cd(NH3)4]2+) = 4,3 * 10-8
Кн ([Cd(OH)4]2-) = 5,5 * 10-10
ПР (СdS) = 7,0 * 10-28
Реакции переведения одного комплексного соединения в другое или из комплексного соединения образуется осадок возможные, если значения Кн новообразованного комплексного соединения меньше, нежели значения Кн исходного комплексного соединения, или значения ПР новообразованного осадку меньше, нежели значения Кн исходного комплексного соединения.
Вывод: протекание всех реакций возможно.
141. Какая масса дихромата калия и какой объем 30%-ного раствора ( =
1,148 г/мл) соляной кислоты потребуется для выделения хлора, который
будет затем использован для получения хлората калия массой 24,5 г?
Решение
1.Найдем массу хлора, который будет использован для получения хлората калия массой 24,5 г:
х г 24,5 г
6KOH + 3Cl2 = 5KCl + KClO3 + 3H2O
213 г 122,5 г
х = m(Cl2)
=
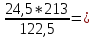 42,6
г
42,6
г
2.Найдем массу дихромата калия и соляной кислоты, которые будут давать 42,6 г хлору:
y г z г 42,6 г
K2Cr2O7 + 14HCl = 3Cl2 + 2CrCl3 + 2KCl + 7H2O
294 г 511 г 213 г
y
= m(K2Cr2O7)
=
 58,8
г
58,8
г
z
= m(HCl)
=
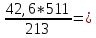 102,2
г
102,2
г
3.Найдем массу 30%-ного раствора соляной кислоты:


4.Найдем объем 30%-ного раствора соляной кислоты:


156. Какие свойства характерны для разбавленной серной кислоты:
а) образует средние и кислые соли;
б) изменяет цвет лакмуса и фенолфталеина;
в) реагирует как с основными так и с кислотными оксидами;
г) взаимодействует с магнием, медью, цинком.
Написать возможные уравнения реакций.
