
Лабораторные работы / Лабораторная Работа 42 49 по ФХ (теория)
.pdf
объединенного закона светопоглощения Ламберта-Бугера-Беера: при данной длине волны оптическая плотность прямо пропорциональна концентрации поглощающих частиц и толщине поглощающего слоя.
Оптическая плотность обладает свойством аддитивности, т.е. оптическая плотность смеси веществ, подчиняющихся закону светопоглощения и не вступающих в химическое взаимодействие друг с другом, равна сумме оптических плотностей компонентов при l = const:
A = ∑Ai =l∑εi Ci |
(13) |
|
i |
i |
|
где εi и Сi - соответственно коэффициент погашения и концентрация i-го компонента смеси.
При использовании объемной концентрации (молярность) коэффициент погашения ε называют молярным коэффициентом погашения. Часто концентрацию выражают в моль/л, а толщину поглощающего слоя - в см. Тогда
молярный коэффициент погашения выражается в |
л |
. Очевидно, что ε |
|
моль см |
|||
|
|
численно равен величине оптической плотности А при l=1 см и С=I моль/л. Кроме величины оптической плотности на практике часто используют
величину Т - пропускание (обычно выражают в процентах): |
|
||
T = |
I |
100 (%) |
(14) |
|
|||
|
I 0 |
|
|
Величина Т связана с оптической плотностью соотношением: |
|
||
A = 2 − lg T |
(15) |
||
Коэффициент погашения ε зависит от природы поглощающей среды, длины волны падающего света и температуры. Величины А и Т зависят кроме того еще от концентрации С и толщины поглощающего слоя l. В эксперименте, переходя от одной длины волны к другой или меняя концентрацию, приходится работать с кюветами различной толщины. Для того, чтобы в таких случаях иметь возможность сравнивать экспериментальные
данные, используют приведенную оптическую плотность Al , которая не
зависит от толщины поглощающего слоя.
На рис.4 изображены способы графического представления законов светопоглощения.
10
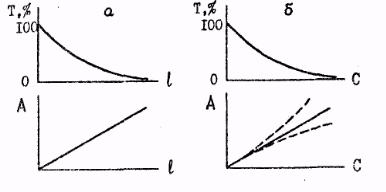
Рис.4. Графическое представление законов светопоглощения при λ=const ; а - закон Ламберта-Бугера (С=const) ; б - закон Беера (l=const); пунктир - отклонения от закона Беера.
В химии важна зависимость А или Т от концентрации (закон Беера), Наблюдаемые иногда на опыте отклонения от закона Беера могут быть вызваны физико-химическими или инструментальными причинами.
Физико-химические причины включают в себя все явления, связанные с изменением состояния поглощающих частиц при изменении концентрации. Чаще всего это диссоциация, ассоциация, полимеризация, комплексообразование в растворах. В этих случаях истинная концентрация поглощающих частиц отличается от общей концентрации вещества в растворе, и отклонение от примой А - С (рис. 4б) является указанием на определенные физико-химические изменения состояния вещества в поглощающей системе.
Инструментальные причины связаны с особенностями устройства и работы спектрофотометрических приборов и в основном сводятся к двум факторам: недостаточно строгая монохроматичность светового потока и недостаточная точность работы приемников излучения. Чтобы устранить первую причину, необходимо работать при довольно узких щелях спектрофотометров. Что касается второй причины, то она заставляет проводить измерения в таком диапазоне оптических плотностей, где ошибка - наименьшая.
Обычно считают, что удовлетворительные по точности результаты можно получать в диапазоне А = 0.2 – 0.8. Однако для каждого конкретного, прибора этот интервал должен быть уточнен на основании эксперимента.
11
§4. Изучение равновесия диссоциации слабых электролитов в растворах Для изучения диссоциации слабых электролитов и определения степени
и константы диссоциации часто пользуются спектрофотометрическим методом, основанном на различии в электронном спектре поглощения молекулярной и ионизированной форм данного вещества в растворе.
Если какая-либо кислота диссоциирует по схеме: НА
 Н+ + А–,
Н+ + А–,
то молекула НА и анион А– имеют разные полосы поглощения, которые могут лежать как в видимой, так и в ультрафиолетовой области. Так как при данной степени диссоциации 0<α<1 в растворе находятся как молекулы НА, так и анионы А–, в спектре раствора будут одновременно наблюдаться по крайней мере две полосы (сольватированный ион водорода не поглощает во всей УВИ области). При изменении степени диссоциации (вследствие разбавления раствора, изменения рН, температуры или природы растворителя) соотношение между интенсивностями этих полос будет меняться. В пределе при α=1 в спектре останется только одна полоса, соответствующая поглощению аниона А–. В другом предельном случае при α=0 эта полоса исчезнет, а поглощение, отвечающее молекуле НА, достигнет максимальной для данной концентрации интенсивности.
На рис.5 представлен пример семейства кривых поглощения, отвечающих различным степеням диссоциации при различных значениях рН: слабой органической кислоты параоксипропиофенона, который в воде диссоциирует следующим образом:
HO-C6 H4 CO-C2 H5 
 Н+ + (О-С6 Н4 -СО-С2 Н5 ) –
Н+ + (О-С6 Н4 -СО-С2 Н5 ) –
Все кривые пересекаются в одной "изобестической" точке, где оптическая плотность не зависит от рН, так как интенсивность поглощения частиц обоих сортов при этой длине волны одинакова.
12

Рис.5. |
Спектр |
поглощение |
параоксипропиофенона |
при |
|
различных рН: 1–4.0; 2–5.0; 3–7.0; 4– 8.0; 5–8.5; 6–11.0; 7–12.0
Слева и справа от изобестической точки поглощение зависит от рН, и наблюдаемая оптическая плотность i-го раствора с данным значением рН
будет складываться из поглощения молекулярной и анионной форм: |
|
|||||||
|
|
|
|
|
Ai =εH A CH A l + εA -CA -l |
(16) |
||
Если общая концентрация вещества в растворе равна С, а степень |
||||||||
диссоциации кислоты в i-м растворе равна αi , то |
|
|||||||
|
|
|
|
|
Ai =εHAC(1 −αi )l +εA− Cαi l |
(17) |
||
или |
|
|
|
|
|
|
|
|
|
|
|
|
|
Ai = A′(1 −αi ) + A′′αi |
(18) |
||
Здесь A′=ε |
HA |
Cl и |
A′′=ε |
A |
− Cl - предельные оптические плотности |
раствора, |
||
|
|
|
|
|
|
|
||
соответственно, в кислой (α=0) и в щелочной (α =1) среде при λ=const. |
||||||||
Из уравнения (18) находим: |
|
|||||||
|
|
|
|
|
αi = |
Ai − A′ |
|
(19) |
|
|
|
|
|
A′′− A′ |
|||
|
|
|
|
|
|
|
||
Все значения здесь должны быть измерены при одной длине волны. Таким образом, величину α можно найти для каждого раствора с данным
значением рН, причем расчеты можно вести как по одной, так и по другой полосе поглощения. Для параоксипропиофенона λ1 =273 нм, λ2 =323 нм.
Термодинамическая константа диссоциации может быть выражена через
активности ионов и молекул в растворе: |
|
||
K a = |
aH + a A− |
(20) |
|
aHA |
|||
|
|
||
С учетом ионного коэффициента активности γА- и считая, что αНА=СНА, можно записать:
13
|
|
|
K a = |
aH + C A− |
γ A− |
|
|
|
|
(21) |
|||||||||
|
|
|
|
CHA |
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Дробь |
C A− |
можно заменить на |
|
α |
|
|
. Тогда: |
|
|
||||||||||
|
CHA |
|
|
1 −α |
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
lg K a =lg aH + + lg |
|
|
α |
|
|
|
+ lgγ |
A− |
(22) |
|||||||
|
|
|
1 |
−α |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
Вводя величину |
pKa =−lg Ka , |
можно записать окончательное уравнение |
|||||||||||||||||
для расчета рКа: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
pK a = pH − lg |
|
|
α |
|
|
−lgγ A− |
|
(23) |
||||||||
|
|
|
1 |
−α |
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
Если в первом |
приближении |
|
считать |
|
раствор идеальным |
и принять |
|||||||||||||
γ A− =γ H + =1, то расчетное уравнение (23) приобретает вид: |
|
||||||||||||||||||
|
|
|
pKC = pH − lg |
|
|
α |
|
|
|
(24) |
|||||||||
|
|
|
1 |
−α |
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
Расчет по этому |
уравнению дает значение |
логарифма идеальной, или |
|||||||||||||||||
кажущейся константы диссоциации (функции концентрации), которая зависит от ионной силы раствора. Если получить ряд значений рК при различной ионной силе раствора, можно найти значение рКа, применяя графическую экстраполяцию на нулевую ионную силу.
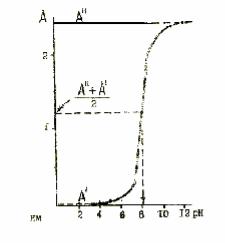
Рис.6. Графическое определение рКС параоксипропиофенона при λ2 . Значение рКС=
рН1 / 2 =8.1,
Решение по уравнению (24) можно провести и графически.
Если α=0.5 то рКС = рН1 / 2 где pH1 / 2 – так называемый "половинный показатель", т.е. значение рН, при котором 50% вещества находится в диссоциированном состоянии.
Для нахождения pH1 / 2 строят график зависимости А=f(рН) при λ1 и при λ2 и по полувысотам полученных кривых находят значение pH1 / 2 =рКС. Пример графического способа расчета рКС для параоксипропиофенона при λ2
14
приведен на рис.6.
Определение констант кислотной и основной диссоциации представляет собой один из важных способов выяснения структуры органических молекул.
15
Контрольные вопросы.
1. Закон светопоглощения Ламберта-Бугера-Беера. Его определение и математическая формулировка. Понятия оптической плотности и процента пропускания, связь между ними. Коэффициент погашения, его физический смысл и экспериментальный способ определения.
2. Причины отклонений от закона Беера. Графическое выражение закона Бера.
3. Принцип определения константы диссоциации слабых электролитов в растворах спектрофотометрическим способом. Вид спектра для равновесия диссоциации слабой кислоты и его зависимости от рН.
4. Аналитический способ обработки экспериментальных данных: определение степени диссоциации слабой кислоты по поглощению аниона и по поглощению недиссоциированной кислоты. Расчёт рКС по этим данным.
5. Графический метод определения рКС.
16

Работа №42. Задача 1 .
Раствор некоторого вещества обнаруживает следующие значения оптической плотности при различных длинах волн для разных концентраций (толщина поглощающего слоя l=1см).
|
|
|
|
||
|
λ,нм |
Концентрация, |
с 105 , моль/л |
||
|
|
10 |
7,5 |
5,0 |
2,5 |
|
|
|
|
|
|
|
400 |
0,60 |
0,45 |
0,30 |
0,15 |
|
425 |
0,67 |
0,51 |
0,33 |
0,17 |
|
|||||
|
450 |
0,72 |
0,54 |
0,36 |
0,18 |
|
475 |
0,71 |
0,51 |
0,35 |
0,17 |
|
500 |
0,66 |
0,48 |
0,33 |
0,16 |
|
525 |
0,56 |
0,42 |
0,28 |
0,14 |
|
550 |
0,40 |
0,30 |
0,20 |
0,10 |
|
575 |
0,31 |
0,24 |
0,16 |
0,08 |
|
600 |
0,25 |
0,18 |
0,12 |
0,06 |
|
700 |
0,08 |
0,06 |
0,04 |
0,02 |
|
750 |
0,05 |
0,03 |
0,02 |
0,01 |
|
|
|
|
|
|
Постройте кривую спектра поглощения этого вещества в координатах
ε=f(λ). Проверьте, подчиняется ли этот раствор закону Беера при λмакс. (длине волны, соответствующей максимуму поглощения).
Задача 2 .
При λ = 405нм наблюдаются следующие значения оптической плотности п- нитрофенола в буферных растворах с различными рН:
рН |
5,0 |
6,0 |
6,2 |
6,4 |
6,6 |
6,8 |
7,0 |
7,2 |
7,4 |
7,6 |
7,8 |
8,0 |
9,0 |
|
|
|
|
|
|
|
|
|
0,48 |
|
|
|
|
А |
0,04 |
0,06 |
0,08 |
0,12 |
0,18 |
0,26 |
0,33 |
0,42 |
0,55 |
0,60 |
0,62 |
0,64 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Определите графически величину рКс для п-нитрофенола.
17
Работа №49.
Задача 1 .
Зависимость оптической плотности водного раствора динитрофенола от концентрации при 436нм следующая:
|
|
|
|
|
|
|
|
|
С 104 моль/л |
2 |
6 |
10 |
14 |
18 |
22 |
26 |
30 |
А |
0,20 |
0,44 |
0,79 |
1,02 |
1,20 |
1,35 |
1,45 |
1,48 |
|
|
|
|
|
|
|
|
|
Постройте график зависимости оптической плотности от концентрации и объясните, какими конкретными физико-химическими явлениями в растворе данного вещества обусловлен характер этой зависимости.
Задача 2 .
При 272нм наблюдаются следующие значения оптической плотности
п-оксипропиофенона (C2 H5 CO-C6 H4 -OH) в буферных растворах с различными рН:
рН |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
|
|
|
|
|
|
|
|
|
|
|
|
А |
1,50 |
1,48 |
1,43 |
1,28 |
1,05 |
0,77 |
0,65 |
0,47 |
0,34 |
0,27 |
0,25 |
|
|
|
|
|
|
|
|
|
|
|
|
Определите графически величину рКс для оксипропиофенона.
18
