
Металлы IA группы
.pdfМинистерство образования и науки Российской Федерации Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования
«Ростовский государственный строительный университет»
Утверждено на заседании
кафедры химии 04.03.2013 г.
Методические указания по дисциплине "Химия»
на тему «Характеристика щелочных металлов. Физические и химические свойства»
для бакалавров по направлению 261400
"Технология художественной обработки материалов"
для профиля «Технология художественной обработки материалов»
Ростов - на – Дону
2013
1
УДК 541.2
Методические указания по дисциплине "Химия". «Характеристика
щелочных металлов. Физические и химические свойства» для бакалавров по
направлению 261400 "Технология художественной обработки материалов"
для профиля «Технология художественной обработки материалов» - Ростов
н/Д: Рост.гос.строит.ун-т, 2013 г.. – с.
Содержится краткий обзор о распространении щелочных металлов в
природе, строении их атомов. Рассмотрены физические и химические свойства
элементов 1А подгруппы, способы их получения и области применения.
Электронная версия методических указаний находится в
библиотеке, ауд. 224.
Составитель:
канд.хим.наук, доцент
Л.М. Астахова
Редактор Т.М. Климчук
Темплан 2013 г., поз.________________________________________________
Подписано в печать Формат 60x84/16. Бумага белая. Ризограф.
Уч.-изд.л. 1,0. Тираж 100 экз. Заказ__________________________________
Редакционно-издательский центр Ростовского государственного строительного университета
344022, Ростов-на-Дону, ул. Социалистическая, 162
© Ростовский государственный строительный у3ниверситет, 2013
2
Введение
В главной подгруппе первой группы (1А) периодической таблицы Д.И.
Менделеева расположены следующие химические элементы, табл.1, [4]
|
|
|
Таблица 1 |
|
Некоторые исторические сведения |
|
|||
|
|
|
|
|
Название |
Символ |
Год |
Происхождение названия |
|
открытия |
||||
|
|
|
||
|
|
|
|
|
Литий |
Li |
1817 |
От латинского «литос» (камень) |
|
|
|
|
|
|
Натрий |
Na |
1807 |
От греческого «нитрон» (сода) |
|
|
|
|
|
|
Калий |
K |
1807 |
От арабского «алкали» (щелочь) |
|
|
|
|
|
|
Рубидий |
Rb |
1861 |
От латинского «рубидус» (темно- |
|
|
|
|
красный) |
|
Цезий |
Cs |
1860 |
От латинского «цезиус» (небесно- |
|
|
|
|
голубой) |
|
Франций |
Fr |
1939 |
От названия страны «Франция» |
|
|
|
|
|
|
Простые вещества этих элементов называются щелочными металлами.
Это название они получили из-за хорошей растворимости в воде соответствующих гидроксидов (МеОН) – щелочей.
Натрий и калий относятся к наиболее распространенным элементам - в
земной коре в составе разных минералов; лития, рубидия и цезия значительно меньше – встречаются только в малораспространенных алюмосиликатах или входят в небольших количествах в состав минералов, содержащих более распространенные щелочные металлы; франция (радиоактивный элемент,
обладающий малым временем полураспада – средняя продолжительность жизни атома 32 мин) ничтожно мало, табл.2,3, [1,2,4].
3
|
|
|
|
Таблица 2 |
|||
Распространенность щелочных металлов в природе |
|
|
|
|
|||
|
|
|
|
|
|
|
|
Элемент |
Распространенность |
в |
Концентрация в |
|
Концентрация в |
|
|
|
земной коре, мкг на |
г |
речной |
воде, |
|
океанической |
|
|
коры |
|
мкг/л |
|
|
воде, мкг/л |
|
|
|
|
|
|
|
|
|
Li |
20 |
|
3 |
|
|
180 |
|
|
|
|
|
|
|
|
|
Na |
2,4∙104 |
|
9000 |
|
|
11,05∙106 |
|
|
|
|
|
|
|
|
|
K |
2,4∙104 |
|
2300 |
|
|
4,6∙104 |
|
|
|
|
|
|
|
|
|
Rb |
90 |
|
1 |
|
|
120 |
|
|
|
|
|
|
|
|
|
Cs |
3 |
|
0,05 |
|
|
0,5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Таблица 3 |
|
Важнейшие минералы, в которых содержатся щелочные металлы |
|||||||
|
|
|
|
|
|||
Элемент |
Минерал |
|
|
Формула |
|
||
|
|
|
|
|
|
||
Li |
Сподумен |
|
|
LiAl(SiO3)2 |
|
||
|
|
|
|
|
|
|
|
|
Каменная соль |
|
|
NaCl |
|
|
|
Na |
Чилийская селитра |
|
|
NaNO3 |
|
||
|
Криолит |
|
|
Na3AlF6 |
|
||
|
|
|
|
|
|
||
|
Карналит |
|
|
KCl∙MgCl2∙6H2O |
|
||
K |
Селитра |
|
|
KNO3 |
|
|
|
|
Сильвинит |
|
|
KCl∙ NaCl |
|
||
|
|
|
|
|
|||
Природные натрий и цезий являются «чистыми » |
элементами, другие |
||||||
элементы слагаются из изотопов, табл.4, [4].
4
|
|
|
|
Таблица 4 |
Содержание естественных изотопов в некоторых металлах |
||||
|
|
|
|
|
Элемент |
Относительная |
атомная |
Изотопное содержание |
|
|
масса |
|
|
|
|
|
|
|
|
Li |
6,941 |
|
6 Li 7,42 %; |
7 Li 92,58% |
|
|
|
3 |
3 |
|
|
|
|
|
Na |
22,9898 |
|
1123 Na 100% |
|
|
|
|
|
|
K |
39,0983 |
|
1939 К 93,1%; |
1941К 6,88% |
|
|
|
|
|
Rb |
85,468 |
|
3785Rb 72,15%; |
3787 Rb 27,85% |
|
|
|
|
|
Cs |
132,90122 |
|
13355 Cs 100% |
|
|
|
|
|
|
Fr |
Основное значение имеет изотоп |
22387 Fr |
||
|
|
|
|
|
1. Физические свойства щелочных металлов
Щелочные металлы очень мягкие и имеют небольшую плотность по сравнению с другими металлами, обладают характерным металлическим блеском, пластичны, хорошо проводят тепло и электрический ток. Параметры,
характеризующие некоторые физические свойства этих веществ приведены в таблице 5, [1,2,4].
В металлах независимо от того в каком агрегатном состоянии они находятся твердом или жидком реализуется металлическая химическая связь.
Вспомним, что типичные металлы характеризуются малым числом электронов во внешнем электронном слое атомов и для их ионизации требуется небольшая энергия (см. табл. 5). При конденсации паров металла атомы сближаются и их наружные электроны переходят в общее пользование всех атомов данного металла. Возникающие положительные катионы металла удерживаются вместе за счет притяжения ко всем свободно движущимся в металле электронам. С
5
ковалентной металлическая связь сходна тем, что при реализации той и другой валентные электроны переходят в общее пользование атомов. Различие в том,
что в случае
Таблица 5
Некоторые свойства щелочных металлов
Свойства |
|
Li |
Na |
K |
Rb |
Cs |
Fr |
||
|
|
|
|
|
|
|
|
||
Плотность, г/см3 |
|
0,53 |
0,97 |
0,86 |
1,52 |
1,87 |
≈2,4 |
||
|
|
|
|
|
|
|
|||
Твердость (алмаз = 10) |
0,6 |
0,5 |
0,4 |
0,3 |
0,2 |
- |
|||
|
|
|
|
|
|
|
|||
Теплоемкость (Н2О = 1) |
0,84 |
0,29 |
0,17 |
0,08 |
0,05 |
- |
|||
|
|
|
|
|
|
|
|||
Электропроводность (Hg=1) |
11 |
21 |
14 |
8 |
5 |
- |
|||
|
|
|
|
|
|
|
|
|
|
Tпл, |
ºС |
|
180 |
98 |
63 |
39 |
28,6 |
24 |
|
|
|
|
|
|
|
|
|
|
|
Tкип, |
ºС |
|
1370 |
883 |
760 |
701 |
685 |
606 |
|
Радиус атома, нм |
|
0,157 |
0,186 |
0,236 |
0,243 |
0,262 |
0,280 |
||
|
|
|
|
|
|
|
|||
Радиус иона, Ме+, нм |
0,068 |
0,098 |
0,133 |
0,149 |
0,165 |
0,175 |
|||
|
|
|
|
|
|
|
|||
Атомный объем, см3/моль |
13,1 |
23,7 |
45,5 |
55,8 |
71 |
- |
|||
|
|
|
|
|
|
|
|||
Энергия ионизации атома, эВ |
5,39 |
5,14 |
4,34 |
4,18 |
3,89 |
3,83 |
|||
|
|
|
|
|
|
|
|
||
Относительная |
|
0,97 |
0,94 |
0,91 |
0,89 |
0,86 |
0,86 |
||
электроотрицательность |
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|||
Работа выхода электрона, эВ |
2,46 |
2,28 |
2,25 |
2,13 |
1,94 |
|
|||
|
|
|
|
|
|
|
|||
Сродство к электрону, эВ |
0,618 |
0,548 |
0,501 |
0,486 |
0,472 |
0,460 |
|||
|
|
|
|
|
|
|
|||
Электродный потенциал, Еº, |
-3,05 |
-2,71 |
-2,924 |
-2,925 |
-2,923 |
- |
|||
В |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Свободная |
энергия |
-561 |
-377 |
-322 |
-289 |
-276 |
- |
||
образования, Gº, кДж/моль |
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
||
Конфигурация |
внешней |
2s1 |
3s1 |
4s1 |
5s1 |
6s1 |
7s1 |
||
оболочки атома |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6 |
|
|
|
|
ковалентной связи валентные электроны связывают два атома, а в случае металлической – все атомы данного куска металла. С ионной связью металлическая связь сходна наличием катионов. Но в металлах катионы связываются свободно перемещающимися электронами (электронным газом), а
в веществах с ионной химической связью – анионами.
Твердые вещества – вещества кристаллические. Кристаллические решетки металлов сходны с атомными решетками алмаза, кремния, но в узлах металлических кристаллических решеток расположены положительно заряженные ионы металла. Металлическая связь очень прочна.
Физические свойства определяются особенностями строения металлов.
Пластичность обусловлена смещением пластов ионов друг относительно друга при деформации (изменении формы куска металла), но разрыва не происходит, так как связывающие их электроны продолжают осуществлять связь между сместившимися ионами.
Электропроводность обусловлена перемещением электронов по всей кристаллической решетке.
Теплопроводность, металлический блеск также обусловлены способностью свободного перемещения электронов по всему металлу.
Естественно, что все эти свойства проявляются у разных металлов в различной степени. В ряду щелочных металов свойства закономерно изменяются при переходе от лития к цезию. Это обусловлено ростом массы и радиуса атомов сверху вниз по подгруппе. Рост массы атома приводит к увеличению плотности металла. Увеличение радиуса атома обусловливает ослабление сил притяжения между атомами простого вещества и как следствие снижаются температуры плавления и кипения, а также уменьшается энергия ионизации атомов.
2. Получение щелочных металлов
7
Металлы 1А подгруппы имеют высокие электродные потенциалы и являются сильнейшими восстановителями. Поэтому получить их путем восстановления соответствующих оксидов нельзя. Их нельзя также получить вытеснением из водных растворов солей действием каких-либо других металлов (см.табл. 5). Электролиз водных растворов солей щелочных металлов приводит к образованию соответствующей щелочи. Получить щелочной
металл можно проводя электролиз расплава его галогенида.
Электролизом называется процесс, происходящий на электродах под действием электрического тока, подаваемого от внешнего источника. При
электролизе происходит превращение электрической энергии в химическую.
Ячейка для электролиза называется электролизером и состоит из двух
электродов и электролита. Электроды подключаются к внешнему источнику питания (ИП). К положительному полюсу ИП подключается анод, на котором протекает процесс окисления; к отрицательному полюсу ИП – катод, на котором протекает процесс восстановления.
Рассмотрим электродные реакции на примере электролиза расплава NaCl.
При плавлении соли происходит ее термохимическая диссоциация:
NaCl → Na+ + Cl-.
Если в этот расплав погрузить два нерастворимых электрода и подключить их к полюсам ИП, то в электролите начинается направленное движение ионов и на электродах будут происходить следующие процессы :
- на катоде (на этот электрод поступают электроны от внешнего ИП) –
восстановление катионов натрия до металлического натрия;
- на аноде (с этого электрода электроны идут во внешнюю цепь) – окисление
хлорид-ионов до газообразного хлора |
|
|
К: Na+ |
+ е- |
→ Na0 |
А: 2 Cl- |
+ 2е- |
→ Cl20 |
|
|
|
8
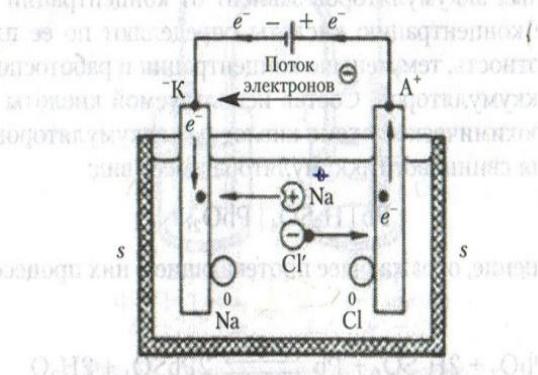
2NaCl электролиз 2Na Cl2
см. рис.
Рис. Схема электролиза расплава NaCl
3. Химические свойства щелочных металлов
Щелочные металлы принадлежат к числу наиболее активных в
химическом отношении элементов. Такая активность обусловлена в первую очередь низкими значениями энергии ионизации атомов – легкостью отдачи ими валентных электронов. Строение атомов определяет как физические, так и химические свойства веществ.
Металлы способны отдавать свои валентные электроны атомам неметаллов, ионам водорода, ионам других металлов, а поэтому будут реагировать с неметаллами – простыми веществами, водой, солями, кислотами.
Щелочные металлы легко окисляются, превращаясь в однозарядные ионы Ме0 - е- ↔ Ме+,
таким образом, все щелочные металлы являются сильными восстановителями.
Отрицательные электродные потенциалы этих металлов (см. табл. 5)
9
показывают, что они склонны к окислению. Это означает, что равновесие в вышеприведенной реакции смещено вправо. Если рассмотреть процесс окисления щелочного металла с точки зрения строения атома становится понятным, что при переходе в ионное состояние каждый щелочной металл приобретает устойчивую электронную конфигурацию на внешнем энергетическом уровне – аналогичную одному из инертных газов. Рассмотрим подробнее электронные формулы металлов и их катионов [3].
Li0 |
- |
1s22s1 |
Li+ |
- |
1s2 |
Na0 |
- |
1s22s22p63s1 |
Na+ |
- |
1s22s22p6 |
K0 |
- |
1s22s22p63s23p64s1 |
K+ |
- 1s22s22p63s23p6 |
|
Rb0 |
- 1s22s22p63s23p64s23d104p65s1 |
Rb+ - 1s22s22p63s23p64s23d104p6 |
|||
Cs0 |
- 1s22s22p63s23p64s23d104p65s24d10 5p6 6s1 |
|
|
||
|
|
|
Cs+- 1s22s22p63s23p64s23d104p65s24d10 5p6 |
||
Из приведенных выше формул видно, что валентные электроны у всех без исключения щелочных металлов находятся на разных уровнях , но s-
подуровнях. Поэтому эти металлы относятся к s-элементам.
3.1. Реакции с простыми веществами [1,2,4]
На примере натрия проследим взаимодействие с кислородом. Натрий –
серебристо-белый металл настолько мягкий, что легко режется ножом. Он очень легко окисляется на воздухе поэтому хранится под слоем керосина.
Нормальные оксиды щелочных металлов натрия, калия, рубидия, цезия получают обычно косвенным путем. Например, оксид натрия Na2O получают нагреванием пероксида натрия с металлическим натрием: Na2O2 + 2Na →
2Na2O. |
Оксид натрия бурно реагирует с водой с образованием гидроксида |
натрия и выделением большого количества теплоты: |
|
Na2O + |
Н2О → 2NaOН. |
|
10 |
