
- •1. Общая характеристика и химические свойства щелочных металлов.
- •2. Особенности соединений бериллия по сравнению с соединениями щелочно-земельных металлов.
- •3. Общая характеристика и химические свойства бора, его получение.
- •4. Общая характеристика и химические свойства алюминия, индия, галлия и таллия.
- •5. Общая характеристика и химические свойства углерода.
- •6. Общая характеристика и химические свойства кремния.
- •7. Общая характеристика и химические свойства германия, олова и свинца.
- •Получение
- •Химические свойства
- •Получение
- •Химические свойства
- •9. Общая характеристика и химические свойства фосфора его получение в промышленности.
- •10. Общая характеристика и химические свойства мышьяка, сурьмы и висмута.
- •11. Получение кислорода и пероксида водорода в промышленности и в лаборатории.
- •12. Общая характеристика и химические свойства серы, селена и теллура.
- •13. Получение водорода в промышленности.
- •14. Общая характеристика и химические свойства галогенов.
- •14. Фториды ксенона: получение, строение молекул и химические свойства.
- •15. Общая характеристика и химические свойства меди, серебра, золота.
- •16. Общая характеристика и химические свойства элементов подгруппы цинка.
- •17. Общая характеристика и химические свойства подгруппы скандия.
- •18. Общая характеристика и химические свойства металлов подгруппы титана.
- •19. Общая характеристика и химические свойства элементов подгруппы ванадия.
- •20. Общая характеристика и химические свойства хрома, молибдена и вольфрама.
- •21. Общая характеристика и химические свойства марганца, технеция и рения.
- •22. Общая характеристика и химические свойства железа, кобальта и никеля.
- •23. Общая характеристика и химические свойства платиновых металлов.
- •26. Получение железа, никеля, хрома и марганца в промышленности.
- •27. Пирометаллургические способы получения металлов (свинец, медь, цинк) из сульфидных руд.
- •28. Окислительное действие нитрата калия и хлората калия при нагревании (сплавлении).
- •29. Образование аммиакатов и гидроксокомплексов металлов и их разрушение кислотами и при нагревании.
- •30. Реакции термического разложения некоторых кислых солей ( NaHco3, NaH2po4, Na2hpo4, NaHso4).
- •31. Гидролиз солей (по катиону, по аниону, одновременный гидролиз двух солей).
2. Особенности соединений бериллия по сравнению с соединениями щелочно-земельных металлов.
Общая характеристика солей бериллия, магния и щелочно-земельных металлов, их растворимость и гидролиз.
Получение оксида, гидроксида кальция и хлорной извести в промышленности.
Элементы II группы имеют общую электронную конфигурацию: (n-1)p6ns2, кроме Ве 1s22s2. В силу последнего, свойства Ве немного отличаются от свойств подгруппы в целом. Свойства магния тоже отличаются от свойств подгруппы, но в меньшей степени.
Из всех металлов II группы только бериллий практически не взаимодействует с водой (препятствует защитная пленка на его поверхности)
2Be + 3H2O = BeO↓ + Be(OH)2↓ + 2H2↑
2H2O+ 2e− = 2OH− + 2H2 ( восстановление)
2Be + 4OH− − 4e− = BeO + Be(OH)2 + H2O ( окисление)
С сухим водородом металлы 2 группы (кроме Be) при небольшом нагреве образуют гидриды:
Э + Н2 = ЭН2
Гидрид бериллия получают следующим образом:
BeCl2 + 2LiH=BeH2 + 2LiCi
По многим химическим свойствам бериллий больше похож на алюминий, чем на находящийся непосредственно под ним магний (проявление "диагонального сходства").
|
|
Отношение радиуса иона к заряду, 1 нм |
Характер гидроксида |
Кристаллическая решётка хлоридов |
Структура гидрида |
|
Be |
45,4 |
Амфотерный |
Молекулярная (безв.);ионная(кристаллогидрат) |
полимер |
|
Al |
41,7 |
амфотерный |
Молекулярная (безв.);ионная(кристаллогидрат) |
полимер |
Ве, его оксид и гидроксид проявляют амфотерные свойства, в частности растворяются и сплавляются со щелочами:
Be + 2NaOH =(сплавл)= Na2BeO2 + H2
BeO + 2KOH + H2O = K2[Be(OH)4]
Be(OH)2 + 2KOH =(спл)=K2BeO2 + 2H2O
Be(OH)2 –малорастворимое соединение в отличии от гидроксидов щелочноземельных металов
И так, особенности химии бериллия:
- амфотерность Be, BeO, Be(OH)2;
-образование
сравнительно прочных комплексных ионов
( например:] ,
,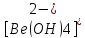 ,
, ;
;
- соединения бериллия склонны к полимеризации и образованию многоядерных комплексных соединений в растворах.
Соли бериллия магния и щелочноземельных металлов.
Соли бериллия имеют более ковалентную связь, чем соли других металлов этой подгруппы, и поэтому обладают в растворе меньшей электропроводностью. В водных растворах соли бериллия гидратированы благодаря малому радиусу иона Be2+ и сильному взаимодействию с дипольными молекулами воды. Бериллий в отличие от других металлов плохо реагирует с азотной кислотой, так как на поверхности образуется защитная пассивирующая пленка BeO.
Сульфиды металлов 2 группы гидролизованы в водных растворах, гидролиз усиливается от RaS к BeS, сульфиды бериллия и магния гидролизованы практически полностью.
Галогениды Be, Mg и щелочноземельных металлов хорошо растворимы в воде кроме MgF2, CaF2, SrF2, BaF2. К малорастворимым соединениям относятся карбонаты, оксолаты, фосфаты, арсенаты и дркгие соли этих металлов, малорастворимы сульфаты CaSO4, SrSO4, BaSO4.
В
водных растворах сильно гидролизованы
соли бериллия, менее – соли магния;
растворимые соли кальция,стронция и
бария практически не гидролизованы в
водных растворах. В силу гидролиза при
сливании растворов солей
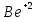 и
и
 с растворами карбонатов выпадают в
осадок основные карбонаты, у остальных
металлов осаждаются в этом случае
малорастворимые карбонаты.
с растворами карбонатов выпадают в
осадок основные карбонаты, у остальных
металлов осаждаются в этом случае
малорастворимые карбонаты.
Нитраты
и карбонаты металлов 2 группы термически
неустойчивы,их стабильность возрастает
с ростом радиуса катиона

Жесткость воды определяется содержанием в ней растворимых солей щёлочноземельных металлов, главным образом, кальция и магния (так называемых «солей жёсткости»).
Получение оксида, гидроксида кальция и хлорной извести в промышленности.
В промышленности оксид кальция получают термическим разложением известняка:
CaCO3 = CaO + CO2
CaO + H2O → Ca(OH)2
Хлорная известь CaOCl2 (у Соловьева)
Cl2 + Ca(OH)2 = CaOCl2 + H2O
(В Википедии)
Хло́рная и́звесть Ca(Cl)OCl — смесь гипохлорита, хлорида и гидроксида кальция
2Ca(OH)2 + 2Cl2 = Ca(OCl)2 +CaCl2 +2H2O
