
25+
.pdf
|
Жерносек А.К. |
|
|
|
|
Лекции по фармацевтической химии |
||||||||||||||||
ЦЕФАЛОСПОРИНЫ |
|
|
|
|
|
|
Антибиотики, близкие по структуре к |
|||||||||||||||
Цефалоспорины (цефемы) – антибиотики, |
|
цефемам («истинным цефалоспоринам» |
||||||||||||||||||||
являющиеся производными 7-аминоцефало- |
|
H |
|
|
|
|
H OCH3 |
|
||||||||||||||
спорановой или 7-аминодезацетоксицефало- |
R1 |
N OCH3 S |
|
|
|
|||||||||||||||||
спорановой кислоты. |
|
|
|
|
|
|
|
O O |
N |
|
|
R1 |
N |
|
O |
|||||||
|
H N |
|
|
S |
|
|
|
|
H N |
|
S |
|
|
|
R2 |
|
O |
N |
R2 |
|||
|
2 |
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
COOH |
|
|
O |
|
||
|
|
|
N |
|
|
O |
CH3 |
|
N |
|
|
|
|
|
|
|
|
|
COOH |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
O |
|
|
|
O |
|
CH3 |
|
|
|
|
|
|
|
|
|
||||||
|
|
|
COOH |
|
O |
|
|
|
|
|
H |
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
COOH |
|
|
|
|
|
|
|
|
|
|||||
|
H2N |
H H |
5 |
|
|
|
|
|
|
|
|
|
|
R1 |
N |
|
|
|
|
|
|
|
|
7 |
6 |
S |
4 |
|
(6R,7R)-7-амино-3-метил-8-оксо-5- |
|
|
O |
N |
|
|
|
|
|
|||||||
|
|
N |
|
3 |
|
|
|
|
R2 |
|
|
|||||||||||
|
|
|
|
|
тиа-1-азабицикло [4.2.0]окт-2-ен-2- |
|
|
O |
|
|
|
|
||||||||||
|
O 8 |
1 |
2 |
CH3 |
карбоновая кислота |
|
|
|
|
|
|
|
COOH |
|
|
|
||||||
|
|
|
|
COOH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
История создания |
|
|
|
|
|
|
|
|
O |
|
|
H |
|
|
|
|
||||||
|
|
|
|
|
|
|
HO |
|
|
N |
|
S |
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
1945 - Итальянский учёный Giuseppe |
|
NH2 |
O |
N |
O |
CH3 |
||||||||||||
|
|
|
|
Brotzu (1895-1976) выделил из пробы |
|
|
|
|
O |
|
COOH |
|
O |
|||||||||
|
|
|
|
морской воды в Сардинии у места |
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
Английский биохимик Edward Penley Abraham (1913- |
||||||||||||||||||
|
|
|
|
слива в море сточных вод грибок |
|
|||||||||||||||||
|
|
|
|
Cephalosporium acremonium и |
|
|
1999) – «продвижение» полусинтетических |
|||||||||||||||
|
|
|
|
установил, что выделяемые им |
|
цефалоспоринов. |
|
|
|
|
|
|||||||||||
|
|
|
|
продукты обладают антимикробной |
|
|
H |
|
|
|
|
|
|
|||||||||
|
|
|
|
S |
|
N |
S |
|
|
|
|
|
||||||||||
|
|
|
|
активностью |
|
|
|
|
|
|
|
|
|
|
|
|||||||
1953 – Выделен и идентифицирован цефалоспорин С |
|
O |
O |
N |
|
O |
CH3 |
|
|
|||||||||||||
(«микропримесь к микропримеси») – низкая |
|
|
|
|
COONa |
O |
|
|
||||||||||||||
антимикробная активность, нет фермента аналогичного |
|
|
|
|
|
|||||||||||||||||
амидазе пенициллинов. У цефалоспоринов нет |
|
Вторая половина 1970-х – создание цефалоспоринов |
||||||||||||||||||||
перспектив? |
|
|
|
|
|
|
|
|
|
|
II и III пололения. В нестоящее время в медицинской |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
практике используются около 40 цефалоспоринов. |
||||||||
Химическая классификация цефалоспоринов |
N-замещённые цефалоспорины |
|
|
|||||||||||||||||||
Цефалоспорины-кислоты |
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
R3 |
|
|
|
|
|
|
||||||||
|
H |
|
|
|
|
|
|
|
|
|
H C |
|
|
|
NH |
H |
|
|
|
|
||
|
|
|
|
|
|
|
|
H |
|
|
3 |
N |
|
|
|
|
N |
|
S |
|
|
|
R1 |
N |
|
|
S |
|
|
|
|
|
|
|
|
|
R1 |
|
|
|
|
||||
|
|
|
|
N |
N |
N |
|
S |
S |
N |
|
|
O |
|
N |
|
|
|
||||
|
O |
|
N |
|
|
|
|
|
|
|
|
|
|
|
O |
R2 |
|
|
||||
|
|
|
R |
|
N O |
N |
|
|
S |
|
|
|
|
|
|
|
||||||
|
|
|
2 |
N |
|
|
|
|
|
|
|
|
|
|||||||||
|
O |
|
|
COOH |
|
|
O |
|
COONa |
|
|
|
|
|
|
|
COOH |
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
O O |
|
|
|
|
|
|
||
Аминоцефалоспорины |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
NH2 |
H |
|
|
|
|
N |
N |
NH |
H |
|
N N |
|
||||||||
|
NH2 |
H |
|
|
|
|
|
|
|
S |
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
N |
|
|
H3C |
|
|
|
N |
|
S N N CH3 |
|||||
R1 |
|
N |
|
S |
|
|
|
|
O O |
|
|
|
|
|
|
|
||||||
O O |
|
N |
|
|
|
|
N |
|
CH3 |
|
|
|
O O |
N |
|
S |
|
|||||
|
|
R2 |
|
|
|
|
HO |
|
COONa |
|
||||||||||||
|
|
|
|
COOH |
|
|
|
|
|
COOH |
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
2011/2012 |
|
|
|
|
|
|
|
|
|
1

Жерносек А.К.
Иминоцефалоспорины
N R3 H |
|
|
|
N |
|
S |
|
R1 |
|
|
|
O O |
N |
R2 |
|
|
|
COOH |
|
N |
OCH3 |
|
|
H |
|
|
|
S |
N |
S |
|
|
|
|
|
N O |
N |
O CH3 |
|
H2N |
O |
COONa |
O |
|
|||
Лекции по фармацевтической химии
Классификация по поколениям (АТХ) J01D Другие бета-лактамные АБ
J01DB Цефалоспорины первого поколения
J01DB01 Цефалексин
J01DB04 Цефазолин
J01DC Цефалоспорины второго поколения
J01DC01 Цефуроксим
J01DC04 Цефаклор
J01DD Цефалоспорины третьего поколения
J01DD01 Цефотаксим
J01DD02 Цефтазидим
J01DD04 Цефтриаксон
J01DE Цефалоспорины четвёртого поколения
J01DE01 Цефепим
|
|
|
|
|
Поколение |
Характеристика |
|
|
Первое |
Активны в отношении Гр+ кокков (кроме |
|
|
|
энтерококков), в том числе и образующих |
|
|
|
БЛ. Разрушаются БЛ Грбактерий |
|
|
Второе |
Действуют не только на Гр+ кокки, но и |
|
|
|
некоторые Грмикроорганизмы |
|
|
Третье |
Более активны, чем ЦС I и II в отношении |
|
|
|
Гр-. Стафилококк и другие кокки к ним |
|
|
|
менее чувствительны |
|
|
Четвёртое |
Менее активны в отношении Гр+, чем ЦС I, |
|
|
|
и не превышают по активности действие |
|
|
|
ЦС III на Гр-, но более устойчивы к |
|
|
|
действию БЛ и высокоэффективны в |
|
|
|
отношении анаэробов |
|
|
|
|
|
Связь структуры и действия
В основе полусинтетических ЦС лежит структура 7- АЦК или 7-АДЦК. Биологической активностью обладают соединения, у которых 6-й и 7-й атомы в остатке 7-АЦК (7-АДЦК) имеют R-конфигурацию. Антибиотики, у которых в 7-м положении содержится метоксигруппа, имеют S-конфигурацию данного атома)
R |
|
H |
H |
H |
5 |
|
1 |
N |
|
6 |
S |
4 |
|
|
7 |
|
||||
|
|
|
||||
|
|
|
3 |
|||
|
|
O |
|
N |
|
|
|
|
8 |
|
R2 |
||
|
|
O |
1 |
2 |
||
|
|
|
|
|
COOH |
|
Положение С2
При замещении карбоксильной группы на сложноэфирную получают цефалоспориныпролекарства, применяемые перорально. Они хорошо всасываются в ЖКТ и затем в плазме гидролизуются неспецифическими эстеразами с образованием активного антибиотика
OCH3 N H
H
O |
N |
S |
|
|
|
O |
N |
|
O NH2 |
|
O |
|
|
O O |
|
|
O |
O |
|
|
|
H3C |
O |
CH3 |
Положение С3
Заместитель оказывает существенное влияние на фармакокинетические свойства цефалоспоринов. В
качестве заместителей обычно используют азот и серусодержащие ГЦ системы. Введение заместителей с четвертичным аммониевым азотом приводит к увеличению АБ активности соединения (особенно в отношении Гр-)
|
H3C |
CH3 |
|
|
N O H COOH |
|
|
S |
N |
|
S |
O O |
|
|
|
N |
N |
N |
|
H2N |
|
|
COO |
2011/2012
2

Жерносек А.К. Лекции по фармацевтической химии
Положение С4
Введение алкоксигрупп уменьшает АБ активность, причём тем сильнее, чем больше атомов С содержится в алкоксильном остатке
Положение S5
Образование сульфоксидов уменьшает биологической активности, замена S на O или C повышает её
COONa
H OCH3 N N
N
 N
N
 O
O N
N N
N CH3
CH3
HO |
O O |
N |
S |
|
|
|
COONa |
NH2 H N
O O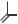
 N
N
 Cl COOH
Cl COOH
У иминоцефалоспоринов Z-изомеры (син-изомеры) более активны, чем E-изомеры (анти-изомеры).
|
OCH3 |
H3CO |
H |
|
N |
H |
N |
||
S |
N R |
S |
N R |
|
O |
O |
|||
N |
N |
|||
H2N |
|
H2N |
|
Положение С6
Введение заместителей приводит к полной потере АБ свойств
Положение С7
Изменение N-ацильного заместителя - основной способ модификации фармакологических свойств ЦС и используется для получения ПС ЦС. Введение CH3O- (цефамицины) или N-формиламиногруппы повышает устойчивость в отношении БЛ
H OCH3
S 
 N S
N S
O O

 N
N 
 O NH2Цефокситин
O NH2Цефокситин
COONa O
ЦЕФАЗОЛИН НАТРИЯ
(CEFAZOLIN SODIUM)
|
|
H |
H3C |
N |
|
|
|
||
N |
N |
N |
S S |
N |
|
|
|
||
N O |
|
N |
S |
|
N |
O |
|||
|
|
COONa |
|
|
|
|
|
|
натрия (6R,7R)-3-[[(5-метил-1,3,4-тиадиазол-2-ил)сульфанил]- метил]-8-оксо-7-[(1H-тетразол-1-илацетил)амино]-5-тиа-1- азабицикло[4.2.0]окт-2-ен-2-карбоксилат
Порошок для приготовления раствора для инъекций по 500 и 1000 мг.
ЦЕФАЛЕКСИН МОНОГИДРАТ
(CEFALEXIN MONOHYDRATE)
NH2 H |
|
|
N |
|
S |
O O |
N |
H2O |
CH3 |
||
|
|
COOH |
(6R,7R)-7-[[(2R)-2-амино-2-фенилацетил]амино]-3-метил- 8-оксо-5-тиа-1-азабицикло[4.2.0]окт-2-ен-2-карбоновой кислоты моногидрат
Капсулы по 250 и 500 мг; порошок для приготовления 100 мл суспензии для приёма внутрь 125 мг/5 мл и 250 мг/мл.
ЦЕФАКЛОР
(CEFACLOR)
NH2 |
H |
|
|
|
|
|
|
|||
|
|
|
|
N |
|
|
|
S |
||
|
|
|
|
|
|
|
|
|
|
H2O |
|
O |
O |
|
N |
|
|
Cl |
|||
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
COOH |
|
(6R,7R)-7-[[(2R)-2-амино-2-
фенилацетил]амино]-3-хлор-8-оксо-5- тиа-1-азабицикло[4.2.0]окт-2-ен-2- карбоновая кислота
Порошок для приготовления суспензии
(60 мл) 250 мг/5 мл.
2011/2012
3

Жерносек А.К. Лекции по фармацевтической химии
|
ЦЕФОПЕРАЗОН НАТРИЯ |
|
|
|
|
|
|
|
|||||||||||||
|
(CEFOPERAZONE SODIUM) |
|
|
|
|
ГЕПАЦЕФ |
|||||||||||||||
|
|
|
O |
|
|
O O |
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
МЕДОЦЕФ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
N |
|
|
N |
NH H |
|
|
|
|
|
N |
|
N ЦЕФОБИД |
||||||
H3C |
|
|
|
|
|
|
|
N |
|
|
|
S |
N |
|
|
N CH3 |
|||||
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
HO |
|
|
|
|
O |
O |
|
N |
|
|
S |
||||||||
|
|
|
|
|
COONa |
||||||||||||||||
натрия (6R,7R)-7-[[(2R)-2-[[(4-этил-2,3- |
|
||||||||||||||||||||
диоксопиперазин-1-ил)карбонил]амино] - |
|
|
|
|
|
|
|
||||||||||||||
2-(4-гидроксифенил)ацетил]амино]-3- |
|
|
|
|
|
|
|
||||||||||||||
[[(1-метил-1Н-тетразол-5-ил)сульфанил] |
|
|
|
|
|
|
|
||||||||||||||
метил]-8-оксо-5-тиа-1-азабицикло[4.2.0] |
|
|
|
|
|
|
|
||||||||||||||
окт-2-ен-2-карбоксилат |
|
|
|
|
|
|
|
|
|
|
|||||||||||
Порошок для приготовления раствора для инъекций по 1000 мг.
ЦЕФОТАКСИМ НАТРИЯ |
|
БИОТАКСИМ |
|||
(CEFOTAXIME SODIUM) |
|
ВАЛОРАН |
|||
|
OCH3 |
|
|
СПОРИМ |
|
N |
|
|
ЦЕФАНТРАЛ |
||
H |
|
|
ЦЕФОСИН |
||
|
N |
S |
|
||
S |
|
КЛАФОРАН |
|||
O |
N |
O CH3 |
ЦЕФАБОЛ |
||
N |
|||||
H2N |
O |
COONa |
O |
|
|
|
|
||||
натрия (6R,7R)-3-[(ацетилокси)метил]-7- [[(2Z)-2-(2-аминотиазол-4-ил)-2- (метоксиимино)ацетил]амино]-8-оксо-5- тиа-1-азабицикло[4.2.0]окт-2-ен-2- карбоксилат
Порошок для приготовления раствора для инъекций по 500 и 1000 мг.
ЦЕФУРОКСИМ НАТРИЯ |
ЗИНАЦЕФ |
|
(CEFUROXIME SODIUM) |
||
АКСЕТИН |
||
|
|
|
|
OCH3 |
|
|
БИОФУРОКСИМ |
N |
|
H |
|
|
КИМАЦЕФ |
|
O |
|
|
N |
|
S |
МЕГАСЕФ |
|
|
|
||||
O |
N |
O NH2 |
|
O |
O |
|
COONa |
натрия (6R,7R)-3-[(карбамоилокси)метил]-7-[[(Z)- (2-фуранил)-2-(метоксиимино)ацетил]амино]-8-оксо- 5-тиа-1-азабицикло[4.2.0]окт-2-ен-2- карбоксилат
Порошок для приготовления раствора для инъекций по 250, 750 И 1500 мг.
ЦЕФУРОКСИМ АКСЕТИЛ |
ЗИННАТ |
||||
(CEFUROXIME AXETIL) |
|||||
ЗИНЕКС |
|||||
|
OCH3 |
|
|
||
|
|
|
МЕГАСЕФ |
||
|
N H |
|
|
ЦЕТРИТ |
|
O |
N |
S |
|
||
|
ЦЕФУРОКС |
||||
|
|
|
|||
|
O |
N |
O |
NH2 |
|
|
O |
|
O O O |
||
|
|
O |
|||
|
|
H3C |
O |
CH3 |
|
(1RS)-1-(ацетокси)этил (6R,7R)-3-[(карбамоилокси)метил]-7-[[(Z)- (2-
фуранил)-2-(метоксиимино)ацетил]амино]-8-оксо-5-тиа-1-азабицикло [4.2.0]окт-2-ен-2-карбоксилат
Таблетки ПО по 250 и 500 мг; порошок для приготовления суспензии для приёма внутрь
125 мг/5 мл.
ЦЕФТРИАКСОН НАТРИЯ |
|
РОЦЕФИН |
||||
(CEFTRIAXONE SODIUM) |
|
БИОТРАКСОН |
||||
|
|
OCH3 |
|
|
|
ЛОРАКСОН |
|
|
|
|
|
МЕДАКСОН |
|
|
N |
H |
|
|
|
РОСИН |
|
|
N |
|
S |
CH3 |
ТРИКСОЦЕФ* |
S |
O O |
|
|
ЦЕФАКСОН |
||
H |
N |
N |
S |
N N |
ЦЕФАМЕД |
|
N |
|
|
COONa |
N |
3,5H2O |
|
2 |
|
|
|
ONa |
||
|
|
|
|
|
|
|
динатрия (6R,7R)-7-[[(2Z)-(2—аминотиазол-4- |
O |
|
||||
ил)(метоксиимино)ацетил]амино]-3-[[(2-метил-6-оксидо- 5-оксо-2,5-дигидро-1,2,4-тиазин-3-ил)сульфанил]метил]- 8-оксо-5-тиа-1-азабицикло[4.2.0]окт-2-ен-2-карбоксилат
Порошок для приготовления раствора для инъекций по 250, 500,1000 и 2000 мг.
ЦЕФТАЗИДИМ |
|
ФОРТУМ |
|||
(CEFTAZIDIME) |
|
||||
|
БИОТУМ |
||||
|
H3C |
|
CH3 |
|
|
|
|
|
ЛОРАЗИДИМ |
||
|
O |
H |
COOH |
|
ЦЕФТУМ |
|
N |
|
|
|
|
S |
|
N |
|
S |
|
N O |
|
N |
N |
5H2O |
|
|
|
||||
H2N |
O |
|
|||
|
|
|
COO |
|
|
(6R,7R)-7-[[(Z)-2-(2-амино-1,3-тиазолил-4)-2- [(1-карбокси-1-метилэтокси)имино]ацетилl]амино]-8-
оксо-3-[(1-пиридинио)метил]-5-тиа-1-азабицикло[4.2.0] окт-2-ен-2-карбоксилат пентагидрат
Порошок для приготовления раствора для инъекций по 250, 500, 1000 и 2000 мг.
2011/2012
4

Жерносек А.К. Лекции по фармацевтической химии
CПОСОБЫ ПОЛУЧЕНИЯ ЦЕФАЛОСПОРИНОВ
Исходным веществом для синтеза является 7-АЦК, |
||||||||
которую получают из цефалоспорина С, |
|
|
||||||
синтезируемого БТ способом. В отличие от 6-АПК |
||||||||
7-АЦК сложно получить ферментативным |
|
|
||||||
гидролизом, основным методом получения 7-АЦК |
||||||||
является химическое дезацилирование. |
|
|
||||||
|
O |
H |
|
|
|
|
|
|
HO |
N |
|
S |
NaClO/HCOOH |
|
|
||
|
|
|
|
|
||||
|
NH2 |
O |
N |
|
O |
CH3 |
|
|
|
COOH |
O |
|
COOH |
|
O |
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
||
|
O |
Цефалоспорин С |
|
|
|
|
||
|
|
|
|
|
|
|
|
|
N |
S |
|
H2O |
H2N |
S |
|
|
|
|
N |
O |
CH |
|
O O |
N |
O |
CH3 |
O |
COOH |
O |
3 |
O |
7-АЦК COOH |
|
O |
|
|
HOOC |
|
|
|||||
|
иминолактон |
|
|
|
|
|
|
|
При получении ЦС проводят ацилирование 7-АЦК по |
||||||||||||||
аминогруппе и модификацию ацетилоксиметильной |
||||||||||||||
группы: |
|
|
|
|
|
|
|
|
|
CH3 |
|
|
||
H2N |
|
S |
|
|
|
|
|
|
|
|
|
|
||
|
N |
|
|
O |
CH |
|
+ N |
N |
|
O |
CH3 |
|
||
|
|
|
3 |
|
O CH3 |
|
|
|||||||
O |
|
COOH |
|
O |
|
N |
N |
O |
|
|
||||
|
|
|
|
|
ангидрид тетразолилуксусной |
|
||||||||
|
|
|
|
|
H |
|
|
и триметилуксусной кислот |
|
|||||
|
|
|
|
|
|
|
5-метил-1,3,4-тиадиазол- |
N N |
|
|||||
|
|
|
N |
|
N |
|
|
S |
|
2-меркаптан |
|
|
||
|
|
N |
|
|
|
|
|
|
|
H3C |
|
S |
SH |
|
- (CH3)3COOH |
N |
|
O |
|
|
N |
|
O |
CH - CH COOH |
|||||
|
|
N |
|
|
O |
|
|
|
|
|
3 |
|
3 |
|
|
|
|
|
|
|
|
COOH |
O |
|
|
|
|||
|
|
|
H |
|
H3C |
|
|
|
||||||
|
|
|
|
|
|
|
N |
|
|
|
|
|
|
|
N |
N |
|
N |
|
S |
|
S |
N |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Цефазолин |
|
|||||
N |
O |
|
N |
|
|
S |
|
|
||||||
N |
O |
|
|
|
|
|
|
|
|
|||||
|
|
|
|
COOH |
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|||
КАРБАПЕНЕМЫ
Карбапенемы – АБ, в основе структуры которых лежит БЦ система, состоящая из конденсированных -
лактамного и пирролидинового колец.
Известно около 20 природных карбапенемов. Важнейшие - оливановая кислота (Streptomyces olivaceus) и тиенамицин (S. cattleya). Это АБ ШСД,
относительно малотоксичны, но химически очень нестабильны.
|
|
OHH H |
|
|
|
|
OH H H |
|
|
H |
C |
|
S |
OH |
H |
C |
|
S |
NH2 |
3 |
|
N |
|
3 |
|
N |
|
||
|
|
|
|
|
|
|
|
||
|
|
O |
COOH |
|
|
|
O |
COOH |
|
|
|
|
|
|
|
|
|
 Тиенамицин инактивируется цистамином, при этом атом азота цистамина взаимодействует с аминогруппой тиенамицина. Защитить аминогруппу ацилированием или метилированием не удаётся.
Тиенамицин инактивируется цистамином, при этом атом азота цистамина взаимодействует с аминогруппой тиенамицина. Защитить аминогруппу ацилированием или метилированием не удаётся.
 Введение в молекулу остатка гуанидина стабилизирует молекулу, но получение такого соединения оказывается очень сложным.
Введение в молекулу остатка гуанидина стабилизирует молекулу, но получение такого соединения оказывается очень сложным.
1980 - синтез N-формидоильное производного тиенамицина
|
OH |
|
|
H |
H3C |
|
|
|
|
|
|
S |
N NH |
|
|
|
N |
|
|
|
O |
|
|
|
|
|
COOH |
|
|
|
|
|
|
|
|
H3C |
|
|
Имипенем |
|||
|
|
H3C |
|
|
|
|
разрушается |
|
|
|
|
|
|
||||
|
|
H N |
|
|
дегидропептидазой |
|||
NH2 |
|
O |
почек I типа с |
|||||
|
|
S |
|
|
|
|
образованием |
|
HOOC |
|
|
COONa токсичных продуктов. |
|||||
|
|
|
|
|||||
Его применяют только совместно! с циластатином – ингибитором ДПП I типа.
При модификации |
|
|
|
|
|
|
|
|
H H3C |
CH |
заместителя в 3-м |
|
|
|
|
|
|
|
|
N |
3 |
|
OH |
|
|
|
|
|
N |
|
||
положении и введении |
|
|
|
CH3 |
|
|||||
H C |
|
|
|
|
O |
|
||||
CH - в 4-е положение |
|
|
|
|
|
|
|
|
||
3 |
3 |
|
|
|
|
|
|
|
|
|
получен меропенем, |
|
|
|
|
|
|
|
S |
|
|
который не разрушается |
|
|
N |
|
|
|
|
|
||
O |
|
|
|
|
|
|||||
ДГП и более активен в |
|
|
|
COOH |
|
|
||||
|
|
|
|
|
|
|
||||
отношении Гр-.
2011/2012
5

Жерносек А.К. Лекции по фармацевтической химии
COOH
|
|
|
H |
H |
|
|
|
N |
|
OH |
|
|
N |
|
|
CH3 |
|
||
H3C |
|
|
O |
|
|
S |
|
||
|
N |
|
Эртапенем |
|
O |
|
|
||
|
COOH |
|
|
|
|
|
|
|
|
|
|
|
H |
O O |
CH3 |
|
CH3 |
N |
|
HO |
|
|
N S NH2 |
|
|
S |
|
||
|
N |
|
H |
|
O |
|
|
|
|
|
COOH |
Дорипенем |
||
|
|
|||
Связь структуры и действия
 Карбапенемы имеют малый размер молекул и находятся в растворе в виде цвиттер-ионов, поэтому хорошо проникают в периплазматическое пространство микробной клетки.
Карбапенемы имеют малый размер молекул и находятся в растворе в виде цвиттер-ионов, поэтому хорошо проникают в периплазматическое пространство микробной клетки.
 Транспорт карбапенемов через внешнюю мембрану происходит не только через пориновые каналы, но и через каналы D2- белков.
Транспорт карбапенемов через внешнюю мембрану происходит не только через пориновые каналы, но и через каналы D2- белков.
 Карбапенемы способны связываться с ПСБ 2-го типа, который имеется у МО, устойчивым ко многим антибиотикам
Карбапенемы способны связываться с ПСБ 2-го типа, который имеется у МО, устойчивым ко многим антибиотикам
 Карбапенемы - АБ ультраширокого спектра действия. К ним чувствительны Гр+ и многие Граэробные и анаэробные микроорганизмы.
Карбапенемы - АБ ультраширокого спектра действия. К ним чувствительны Гр+ и многие Граэробные и анаэробные микроорганизмы.
 Устойчивы к БЛ, разрушающим пенициллины и цефалоспорины.
Устойчивы к БЛ, разрушающим пенициллины и цефалоспорины.
 Могут быть использованы для лечения полимикробных и смешанных аэробно-анаэробных инфекций, а также для первичной терапии инфекционного процесса до определения его бактериальных возбудителей.
Могут быть использованы для лечения полимикробных и смешанных аэробно-анаэробных инфекций, а также для первичной терапии инфекционного процесса до определения его бактериальных возбудителей.
J01DH Карбапенемы
J01DH02 Меропенем
J01DH51 Имипенем и ингибитор фермента
Как у пенамов и цефемов атом С(5) в карбапенемовом ядре имеет R-конфигурацию. Конфигурация атома С(6) не R, а S.
|
H H |
H |
R |
|
|
|
R3 |
4 |
2 |
|
|
||
|
5 |
|
|
|
||
|
|
|
|
|
|
|
|
6 |
N |
|
3 |
S |
R1 |
O 7 |
|
2 |
||||
1 |
|
|
|
|||
|
|
|
|
COOH |
|
|
Положение С3
Модификация молекулы в данном положении может приводить к повышению устойчивости соединения к действию кислот и БЛ. Введение амидиновой группы в 2-тиоэтильный фрагмент карбапенема повышает активность антибиотика в отношении Гр-.
Положение С3
Введение метильной группы повышает устойчивость антибиотика к действию дегидропептидаз почек.
Положение С6
Даже при отсутствии заместителя АБ действие вещества сохраняется. Максимальной АБ обладают карбапенемы, содержащие в 6 -положении 1R- гидроксиэтильную группу. Она защищает -лактамное
кольцо и обеспечивает устойчивость к действию БЛ. 6-Ациламидные производные карбапенема химически нестабильны и биологически неактивны
ИМИПЕНЕМ |
ТИЕНАМ |
|
(IMIPENEM) |
||
ИМИЦЕНЕМ-ТФ* |
||
|
OH |
|
|
ЦИЛАПЕНЕМ* |
H3C |
|
|
H |
|
S |
N NH |
|
|
N |
|
|
O |
|
|
|
|
COOH |
|
|
|
|
|
(5R,6S)-6-[(R)-1-гидроксиэтил]-3- [[2- [(иминометил)амино]этил] тио]-7-оксо-1- азабицикло [3.2.0]гепт-2-ен-2-карбоновая кислота
Порошок для приготовления раствора для инъекций (инфузий), суспензии для инъекций
по 250/250 мг или 500/500 мг.
Только вместе с циластатином!
2011/2012
6
Жерносек А.К. Лекции по фармацевтической химии
МЕРОПЕНЕМ |
|
|
|
|
МЕРОНЕМ |
|
(MEROPENEM) |
|
|
|
|
БОРИНЕМ* |
|
|
|
|
|
|
|
МЕТРИЛ |
|
|
|
H |
C |
CH3 |
РЕПЛОНЕМ |
|
|
H |
3 |
N |
САЙРОНЕМ |
|
OH |
CH3 |
N |
|
|
|
ТИВОМЕР |
H3C |
|
|
O |
|
|
|
|
S |
|
|
|
||
O |
N |
3H2O |
|
|
||
COOH |
|
|
|
|
||
|
|
|
|
|
||
(4R,5S,6S)-3-[[(3S,5S)-5-(диметилкарбамоил)-3-
пирролидинил]тио]-6-[(1R)-1-гидроксиэтил]-4-метил-7-оксо-1- азабицикло[3.2.0]гепт-2-ен-2-карбоновая кислота, тригидрат
Порошок для приготовления раствора для инъекций (в/в) по 500 и 1000 мг.
CПОСОБЫ ПОЛУЧЕНИЯ КАРБАПЕНЕМОВ
Природные карбапенемы синтезируются МО в незначительных количествах и очень неустойчивы, поэтому имипенем и меропенем получают путём полного химического синтеза
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
O |
|
|
|
|
|
|
|
|
O |
CH2C6H5 |
|
|
OCH2C6H5 CH CHO |
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
C6H5H2C O H N R |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
NH |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
дибензиловый эфир L- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
аспарагиновой кислоты |
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
OH |
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
H C |
|
|
|
|
|
|
|
|
OCH |
|
C H |
|
|
|
H3C |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
6 |
5 |
|
|
|
|
|
|
|
|
|
|
|
O -N2 |
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
NH |
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
NH |
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|||||||||||
|
|
|
OH |
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
HN |
|
|
OCH2C6H5 |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
O |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
1) Si(CH3)3Cl |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
H3C |
|
|
|
|
|
|
H3C |
|
|
|
|
|
|
|
|
|
|
|
Имипенем |
||||||||||||||||||
|
|
|
|
|
|
|
|
|
O2) HS(CH2)2NH2 |
|
|
|
|
|
|
|
S |
|
|
||||||||||||||||||
|
|
|
O |
|
|
N |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N |
|
|
|
|
|
|
NH |
|||
|
|
|
|
|
|
|
|
|
3) HCOOH + NH3 |
O |
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
COOH H |
N |
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
OCH |
C H |
5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
2 |
|
6 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
МОНОБАКТАМЫ
Монобактамы – антибиотики, являющиеся производными 3-аминомонобактамовой
кислоты .
Продуценты монобактамов - бактерии родов
Acetobacterium, Gluconobacterium, Chromobacterium,
отдельные виды рода Pseudomonas. Впервые монобактамы были описаны в конце 1970-х – начале 1980-х годов. До этого считалось, что антимикробной активностью могут обладать только бициклические -лактамы
Практическое применение имеет лишь один представитель монобактамов – азтреонам (получают путём полного химического синтеза!).
|
|
H3C |
|
|
|
|
|
Монобактамы |
|||
|
|
COOH |
J01DF |
||||||||
|
H3C |
|
|
||||||||
|
|
|
|
|
|
|
|
J01DF01 Азтреонам |
|||
|
|
|
|
|
|
||||||
|
|
N O |
H |
|
|
|
|
||||
|
|
|
|
|
|
|
|||||
S |
N |
|
|
|
|
N |
|
|
CH3 |
||
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|||||
|
|
O |
|
|
|
|
|
|
|
||
H2N |
|
|
|
|
|
O |
|
N SO3H |
|||
АБ узкого спектра действия. Активен в отношении Гр- и обладает устойчивостью по отношению к БЛ. Используется при тяжелых инфекциях, вызванных Грмикрофлорой, устойчивой к другим антибиотикам. Вводится только парентерально (в/м и в/в). Хорошо проникает в различные ткани и органы.
Связь структуры и действия
|
|
H |
H |
H R |
|
R |
3 |
N |
2 |
||
|
|
3 |
N2 |
||
|
|
O |
|
||
|
|
O |
4 |
1 R1 |
|
Положение N1
В N-незамещённом монобактаме ациламидная связь слишком прочна, поэтому АБ у такого соединения отсутствует. Основная роль ЭА группы (чаще всего – SO3H), находящейся при атоме азота, заключается в ослаблении ациламидной связи
2011/2012
7
Жерносек А.К. Лекции по фармацевтической химии
Положение С2
Введение метильной или карбамоилоксиметильной группы увеличивает устойчивость антибиотика по отношению к БЛ, однако с увеличением размера заместителя АБ активность уменьшается.
Положение С3
Данный атом должен иметь S-конфигурацию. Наиболее активны монобактамы, содержащие в 3 -
положении такой же N-ацильный фрагмент, что и цефалоспорины 3-го и 4-го поколений. Введение в 3 -положение метоксиили N-формиламиногруппы
повышает устойчивость антибиотика по отношению к БЛ.
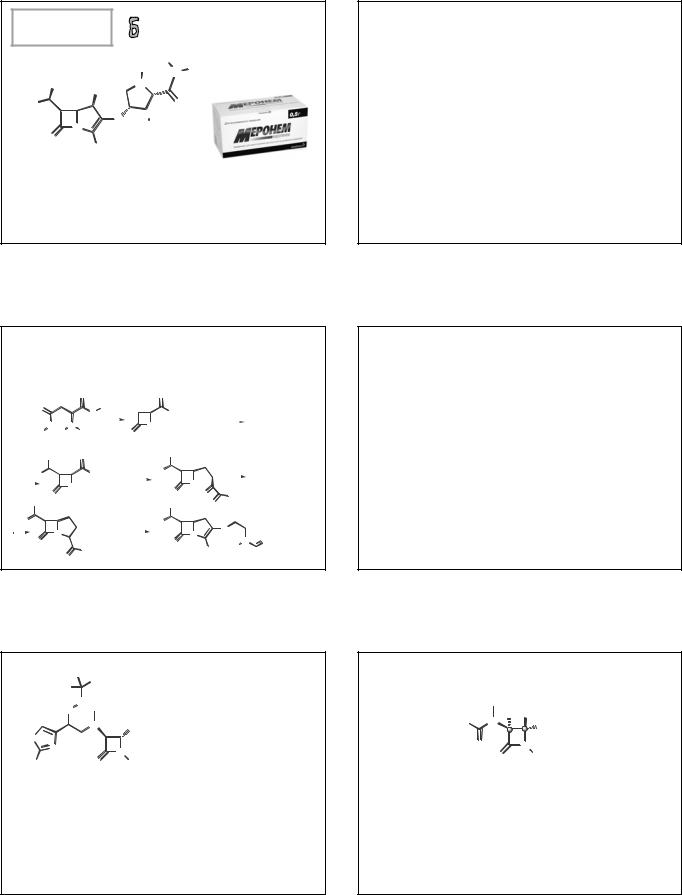
АЗТРЕОНАМ АЗАКТАМ
(AZTREONAM) АЗТРЕАБОЛ
|
|
H3C |
COOH |
|
|
H3C |
|
|
|
|
|
N O H |
|
|
S |
|
|
N |
CH3 |
N |
O |
|
|
|
|
|
N SO3H |
||
H2N |
|
|
O |
|
(Z)-2-[[[(2-амино-4-тиазолил)[[(2S,3S)-2-метил-4-оксо-1-
сульфо-3-азетидинил]карбамоил]метилен]амино]окси]-2- метилпропановая кислота
Порошок для приготовления раствора для инъекций по 500 и 1000 мг.
Ингибиторы бета-лактамаз |
|
|
|
|
|
|
СУБСТРАТНЫЙ ПРОФИЛЬ БЛ |
|
|
|
|
|||||||||||
-Лактамазы – ферменты, катализирующие |
|
|
|
|
|
|
|
|
|
|
||||||||||||
гидролиз амидной связи в -лактамном |
|
ПЕНИЦИЛЛИНАЗЫ |
|
|
БЛ ШИРОКОГО |
|||||||||||||||||
кольце пенициллинов, цефалоспоринов, |
|
|
||||||||||||||||||||
|
|
|
|
|
СПЕКТРА |
|
|
|||||||||||||||
карбепенемов и монобактамов. |
|
|
|
|
|
|
|
|
|
ДЕЙСТВИЯ |
|
|
||||||||||
|
H |
|
|
|
|
|
|
H |
|
|
|
|
|
ЦЕФАЛОСПОРИНАЗЫ |
|
|
|
|
|
|||
R |
N |
S |
CH |
3 |
|
R |
N |
|
S |
CH |
3 |
|
|
|
|
|
|
|
|
|
|
|
|
O |
N |
|
-лактамаза |
|
N |
|
Природные пенициллины и аминоП легко |
|
|
|
|
||||||||||
|
CH |
|
H2O |
O |
|
CH |
|
|
|
|
||||||||||||
|
O |
|
|
3 |
|
HOOC |
H |
|
|
3 |
разрушаются при действии БЛ. Устойчивость |
|
|
|
||||||||
|
|
COOH |
|
|
|
|
|
COOH |
карбоксиП и изоксазолП значительно выше. ЦС I |
|
||||||||||||
|
|
|
|
|
|
|
пенициллоиновая кислота |
|
||||||||||||||
|
|
|
|
|
|
|
сравнительно легко гидролизуются БЛ, в ЦС III |
|
|
|||||||||||||
H2N |
S |
|
|
|
-лактамаза H2N |
|
S |
|
|
|
|
|||||||||||
|
|
|
|
+ CH3COOH |
(особенно цефуроксим) устойчивы к действию многих |
|||||||||||||||||
|
N |
|
O |
|
|
CH3 H2O |
HOOC |
N |
|
БЛ. Карбапенемы и азтреонам также высокоустойчивы |
||||||||||||
O |
|
|
|
|
|
|
|
|
|
CH2 |
|
по отношению к большинству БЛ. |
|
|
|
|
|
|||||
COOH |
O |
|
|
|
|
COOH |
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
цефалоспороиновая кислота |
|
|
|
|
|
|
|
|
|
|
|||||
|
СОЕДИНЕНИЯ, СПОСОБНЫЕ ИНГИБИРОВАТЬ БЛ |
Суицидные ингибиторы – вещества, которые |
|
|
|
|||||||||||||||||
|
расщепляются при взаимодействии с ферментом. |
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
Продукты разрушения ковалентно связываются с |
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
активным центром фермента и необратимо |
|
|
|
|
|||||
|
ОБРАТИМЫЕ |
|
|
|
НЕОБРАТИМЫЕ |
|
ингибируют его. |
|
|
|
|
|
|
|
|
|||||||
|
ИНГИБИТОРЫ |
|
|
|
ИНАКТИВАТОРЫ |
|
По химическому строению СИ являются - |
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
Оксациллин |
|
|
|
|
|
|
|
|
|
лактамными соединениями. К ним относятся: |
|
|
|
||||||||
|
Азтреонам |
|
|
Модификаторы |
|
|
Вещества, |
клавулановая кислота (производное оксопенема) |
|
|||||||||||||
|
ЦС III |
|
|
|
|
S-диоксиды пенамов |
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
аминокислот |
|
|
блокирующие |
|
|
O |
|
O |
O |
O |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
АЦ фермента |
|
O |
S |
|
N |
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
CH3 |
S |
|
N |
N |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N |
N |
|
CH3 |
N |
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH |
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
3 |
|
|
|||||
|
|
|
|
|
|
СУИЦИДНЫЕ ИНГИБИТОРЫ |
COOH |
O |
COOH O |
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
COOH |
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
2011/2012 |
|
|
|
|
|
|
|
|
|
|
8

Жерносек А.К. Лекции по фармацевтической химии
Ингибиторы БЛ входят в состав комбинированных лекарственных средств, содержащих бета-лактамные АБ (обычно аминопенициллины или пиперациллин), разрушающиеся БЛ.
|
|
NH2 |
H |
|
|
|
|
|
|
|||||||
|
|
N |
S |
|
|
CH3 |
||||||||||
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N |
|
|
|
|
|
|
||||||
|
|
O |
|
|
|
|
|
|
|
|
|
|
CH3 |
|||
|
|
|
|
|
O |
|
|
|
|
|
||||||
Данные ЛС получают путём |
|
|
|
|
|
|
|
|
|
|
|
O |
||||
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
O |
|
|
||||||||
смешивания в определённом |
|
|
|
|
|
|
|
|
|
|||||||
соотношении АБ и ингибитора или |
|
|
|
|
|
|
O |
|
|
|
||||||
путём их химической сшивки. |
|
|
|
|
|
|
|
O |
||||||||
|
|
|
|
|
O |
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
CH3 |
||||||||
Сультамицин |
|
|
N |
|
|
|
||||||||||
|
|
|
S |
CH3 |
||||||||||||
|
|
|
O |
|||||||||||||
|
|
|
|
|
|
|
|
|
O |
|
|
|
||||
Связь структуры и действия
Клавулановая кислота - природное соединение. Её продуцентом является Streptomyces clavuligerus.
Антимикробная активность КК невелика, поэтому в качестве самостоятельного ЛС она не используется. КК малотоксична. Её основным недостатком является невысокая химическая устойчивость. В состав ЛС КК обычно входит в виде калиевой соли.
6 |
5 |
O 4 |
OH |
||||
7 |
|
|
|
|
|
|
|
|
N |
3 |
|
|
|||
|
|
||||||
O |
1 |
2 |
|
|
|
||
|
|
|
|
COOH |
|
||
Положение C2
Превращение карбоксильной группы в сложноэфирную (метиловый, бензиловый эфиры) или её удаление не изменяет биологической активности соединения.
Положение C3
При гидрировании двойной связи ингибирующая активность уменьшается. Замена OH-группы на амино-, дибензиламино-, фенилили N- формиламиногруппу значительно увеличивает активность
Положение O4
Тиоаналог КК обладает менее выраженными ингибирующими свойствами, чем природное соединение
СУЛЬБАКТАМ НАТРИЯ
(SULBACTAM SODIUM)
O S O CH3
O
 N
N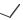
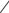
 CH3 COONa
CH3 COONa
натрия (2S,5R)-3,3-диметил-7-оксо-4- тиа-1-азабицикло[3.2.0]гептан-2- карбоксилат 4,4-диоксид
Применяется обычно вместе с цефоперазоном или ампициллином в виде порошка для приготовления раствора для инъекций.
СУЛЬПЕРАЗОН
СУЛЬПЕРАЦЕФ
СУЛАЦИЛЛИН
СУЛЬБАЦИН
СУЛЬТАСИН
КАЛИЯ КЛАВУЛАНАТ
(POTASSIUM CLAVULANATE)
(субстанция)
|
|
|
|
|
O |
|
OH |
АУГМЕНТИН |
||||
|
|
|
|
|
|
|
|
|
|
|
|
АМКЛАВ |
O |
|
|
N |
|
|
АМОКЛАВ |
||||||
|
|
|
|
COOK |
|
|
АМОКСИКОМБ |
|||||
|
|
|
|
|
|
|
||||||
калия (Z)-(2R,5R)-3-(2- |
и др. |
|||||||||||
|
||||||||||||
гидроксиэтилиден)-7-оксо-4-окса-1- азабицикло[3.2.0]гептан-2-карбоксилат
Чаще всего применяется вместе с амоксициллином в виде таблеток ПО, порошка для приготовления суспензии для приёма внутрь и порошка для приготовления раствора для инъекций.
2011/2012
9
Жерносек А.К. Лекции по фармацевтической химии
МЕТОДЫ КОНТРОЛЯ КАЧЕСТВА ЦЕФАЛОСПОРИНОВ
1. Физико-химические и химико-аналитические свойства
Внешний вид и растворимость
Большинство цефалоспоринов представляют собой натриевые соли соответствующих кислот. Данные вещества являются белыми или почти белыми порошками (некоторые могут быть желтоватыми), которые легко растворимы в воде (табл. 1). Некоторые цефалоспорины (особенно цефазолина натриевая соль) гигроскопичны. Цефалексин, цефаклор и натриевые соли цефтриаксона и цефтазидима являются кристаллогидратами.
Кислотные формы цефалоспоринов (цефалексин, цефтазидим) и эфиры (цефуроксима аксетил) мало растворимы в воде. В этиловом спирте как солевые, так и кислотные формы антибиотиков данной группы растворяются хуже, чем в воде. Все формы цефалоспоринов практически нерастворимы в хлороформе и эфире.
Таблица 1
Физические свойства лекарственных веществ группы цефалоспоринов
Вещество |
Внешний |
|
|
Растворимость |
|||
вода |
этанол |
|
другие |
||||
|
|
вид |
|
|
|||
|
|
|
|
|
|
|
|
Цефазолина |
белый или почти |
легко |
очень |
|
|
||
натриевая |
белый |
порошок, |
|
мало |
|
|
|
соль (ЦЗ) |
очень |
гигроско- |
|
|
|
|
|
|
пичен, |
обладает |
|
|
|
|
|
|
полиморфизмом |
|
|
|
|
||
|
|
|
|
|
|||
Цефалексин |
белый или почти |
1:100 |
практи- |
1:30 в 0,2% HCl, растворим в |
|||
(ЦЛ) |
белый |
кристал- |
|
чески |
|
растворах щелочей, практиче- |
|
|
лический |
поро- |
|
нерас- |
|
ски нерастворим в хлорофор- |
|
|
шок |
|
|
|
творим |
|
ме и эфире |
|
|
|
|
|
|
||
Цефаклор |
Белый или слегка |
мало |
|
|
ПрН в метаноле и в метилен- |
||
(ЦК) |
желтый порошок. |
|
|
|
хлориде |
||
|
|
|
|
|
|
||
Цефоперазо- |
белый или слегка |
легко |
мало |
|
растворим в метаноле |
||
на натриевая |
желтоватый |
по- |
|
|
|
|
|
соль (ЦП) |
рошок, |
гигро- |
|
|
|
|
|
|
скопичен, |
обла- |
|
|
|
|
|
|
дает |
полимор- |
|
|
|
|
|
|
физмом |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2011/2012
