
Экзаменационные тесты по химии
.doc106. "При постоянной температуре давление, производимое данной массой газа обратно пропорционально объему газа". Какой это закон?
-
Бойля-Мариотта
-
Гей-Люссака
-
Менделеева
-
Авогадро
-
Клапейрона
107. Эквивалентная масса кислоты равна…
-
Экислоты=М/основность
-
Экислоты=М/В
-
Экислоты=М/кислотность
-
Экислоты=М/число атомов элемента
-
Экислоты=В/кислотность
108. Какая из формул выражает закон эквивалентов?
109. Молекулярная масса фосфорной кислоты равна...
-
98 г/моль
-
49г/моль
-
78 г/моль
-
64 г/моль
-
100 г/моль
110. Раздел химии, изучающий скорость и механизмы химических реакций, называется..
-
химическая кинетика
-
химическая термодинамика
-
стереохимия
-
биохимия
-
термохимия
111. Что называется скоростью гомогенной реакции?
-
Количество вещества, вступающего в реакцию или образующегося в результате нее за единицу времени в единице объема системы
-
изменение концентрации веществ за единицу времени
-
это изменение давления за единицу времени
-
это изменение плотности реагирующих веществ
-
изменение концентрации веществ за единицу времени на единице поверхности фаз
112. Выберите факторы, влияющие на скорость химической реакции:
-
катализаторы, давление, температура, природа реагирующих веществ, концентрация
-
температура, давление, катализаторы
-
давление, концентрация
-
природа реагирующих веществ, концентрация
-
температура, природа реагирующих веществ, концентрация
113. В каком законе выражается зависимость скорости химической реакции от температуры?
-
в законе Вант-Гоффа
-
в законе Гесса
-
в законе действия масс
-
в законе Гей-Люссака
-
в законе сохранения массы
114. В каком законе выражается зависимость скорости химической реакции от концентрации?
-
в законе действия масс
-
в законе Вант-Гоффа
-
в законе Гесса
-
в законе Гей-Люссака
-
в законе сохранения массы
115. Химическое равновесие-это..
-
такое состояние системы, при котором скорость прямой реакции равна скорости обратной реакции
-
такое состояние системы, при котором скорость прямой реакции больше скорости обратной реакции
-
такое состояние системы, при котором скорость прямой реакции меньше скорости обратной реакции
-
такое состояние системы, при котором скорость прямой реакции не зависит от скорости обратной реакции
-
такое состояние системы, при котором скорость обратной реакции больше скорости прямой реакции
116. Раствор, который находится в динамическом равновесии с избытком растворенного вещества, называется:
-
насыщенным
-
буферным
-
изотоническим
-
пересыщенным
-
ненасыщенным
117. Величина, равная отношению массы растворенного вещества к общей массе раствора-это…
-
массовая доля растворенного вещества
-
молярная концентрация вещества
-
молярная концентрация эквивалента
-
титр раствора
-
молярная доля растворенного вещества
118. Число эквивалентов растворенного вещества, содержащееся в 1 литре раствора, называется:
-
молярной концентрацией эквивалента
-
титром раствора
-
процентной концентрацией
-
молярной концентрацией
-
эквивалентом вещества
119. Электрон-это..
-
отрицательная частица
-
электронейтральная частица
-
возбужденная частица
-
незаряженная частица
-
положительная частица
120. Число эквивалентов растворенного вещества, содержащееся в 1 литре раствора, называется:
-
молярной концентрацией эквивалента
-
титром раствора
-
процентной концентрацией
-
молярной концентрацией
-
эквивалентом
121. Состояние электрона при котором связь с ядром ослабевает, а запас энергии увеличивается, называется...
-
возбужденным
-
ненормальным
-
невозбужденным
-
линейным
-
А и С-вместе
122. Где в периодической системе располагаются благородные газы?
-
в восьмой группе
-
в первой группе
-
во втором периоде
-
во второй группе
-
в седьмой группе
123. Что такое изотопы?
-
атомы, имеющие в ядрах одинаковое число протонов и различное число нейтронов
-
атомы, имеющие в ядрах различное число протонов и одинаковое число нейтронов
-
атомы, имеющие в ядрах одинаковое число нейтронов
-
электронейтральные атомы
-
атомы, имеющие в ядрах одинаковое число протонов и нейтронов
124. Первый постулат Бора:
-
электрон вращается вокруг ядра по определенным круговым орбитам
-
электрон вращается вокруг ядра, поглощая энергию
-
электрон вращается вокруг ядра, не поглощая энергию
-
электрон вращается вокруг ядра хаотично (беспорядочно)
-
электрон вращается вокруг ядра, не излучая энергии
125. Молярная концентрация-это отношение количества вещества (моль) к:
-
объему раствора, л
-
количеству раствора, моль
-
количеству растворителя, моль
-
массе растворителя, кг
-
объему растворителя, мл
126. Раствор, в котором концентрация растворителя меньше концентрации растворенного вещества, называется...
-
концентрированный раствор
-
истинный раствор
-
ненасыщенный раствор
-
разбавленный раствор
-
реальный раствор
127. Раствор, в котором концентрация растворителя больше концентрации растворенного вещества, называется...
-
разбавленный раствор
-
концентрированный раствор
-
истинный раствор
-
ненасыщенный раствор
-
реальный раствор
128. Какая из перечисленных концентраций выражает отношение массы растворенного вещества к массе раствора и измеряется в % или долях единицы?
-
процентная концентрация
-
моляльная концентрация
-
мольная концентрация
-
эквивалентная концентрация
-
молярная концентрация
129. Отношение числа моль растворенного вещества к объему раствора, называется...
-
молярная концентрация
-
процентная концентрация
-
нормальная концентрация
-
титр
-
моляльная концентрация
130. Что означает запись 0,5М раствор НСl?
-
это означает, что в 1 литре раствора содержится 0,5 моль НСl
-
это означает, что в 100 л раствора содержится 0,5 г НСl
-
это означает, что в 0,5 л раствора содержится 1 моль НСl
-
это означает, что в 10 л раствора содержится 0,5 моль НСl
-
это означает, что в 0,5 л раствора содержится 0,5 моль НСl
131. Способность вещества растворяться в воде или другом растворителе, это…
-
растворимость
-
проводимость
-
насыщенность
-
разбавленность
-
кристаллизация
132. Отрицательно заряженные частицы, называется...
-
анионы
-
катионы
-
иониты
-
катоды
-
аноды
133. Положительно заряженные частицы, называется...
-
катионы
-
анионы
-
иониты
-
катоды
-
аноды
134. Какие из перечисленных электролитов относятся к сильным?
-
NaOH, HCl
-
KOH,
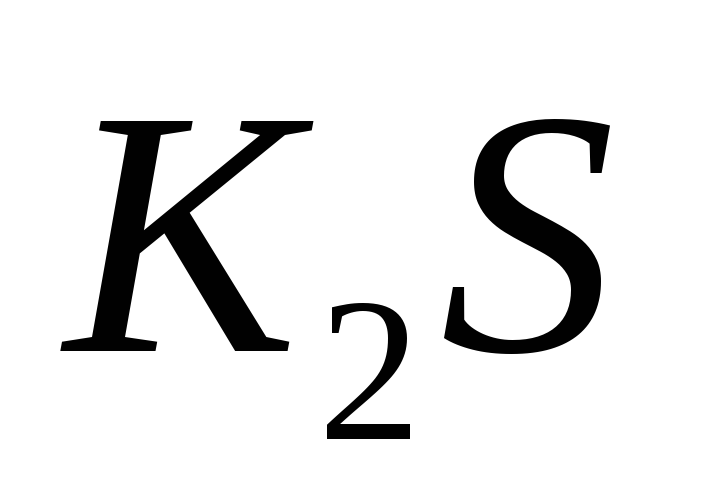
-

-
HCN, KCl
-

135. Что называется степенью диссоциации электролита?
-
отношение числа его молекул, распавшихся на ионы к общему числу его молекул в растворе
-
произведение числа его молекул, распавшихся на ионы к общему числу его молекул в растворе
-
разность между числом его молекул, распавшихся на ионы и общим числом его молекул в растворе
-
cyммa числа его молекул, распавшихся на ионы к общему числу его молекул в растворе
-
равенство чисел его молекул, распавшихся на ионы и общего числа его молекул в растворе
136. Какие значения принимает орбитальное квантовое число?
-
от 0 до (n-1)
-
от +1/2 до -1/2
-
от 5 до -5
-
от –l до +l
-
от 1 до 7
137. Какое из перечисленных соединений будет проявлять амфотерные свойства?
-

-
LiOH
-

-
TlOH
-

138. Заряд электрона равен....
139. Способность атома в молекуле притягивать к себе электроны - это....
-
сродство к электрону
-
энергия ионизации
-
зарядность атома
-
электроотрицательностъ
-
поляризация
140. Кислотные свойства в периоде слева направо....
-
увеличиваются
-
увеличиваются, а затем уменьшаются
-
не изменяются
-
уменьшаются, а затем увеличиваются
-
уменьшаются
141. Основные свойства в главной подгруппе сверху вниз...
-
увеличиваются
-
увеличиваются, а затем уменьшаются
-
не изменяются
-
уменьшаются, а затем увеличиваются
-
уменьшаются
142. Процессу окисления соответствует запись:
143. Второй постулат Бора:
-
при переходе из одной орбиты на другую электрон не излучает электромагнитной энергии
-
при переходе из одной орбиты на другую электрон не излучает и не поглощает энергии
-
при переходе из одной орбиты на другую электрон поглощает квант энергии
-
при переходе из одной орбиты на другую электрон излучает квант энергии
-
при переходе из одной орбиты на другую электрон характеризуется волновыми свойствами
144. Какое значение принимает главное квантовое число?
-
любые положительные значения
-
только отрицательные значения
-
дробные
-
+l/2 и -1/2
-
от +1 до -1
145. Энергетическое состояние атома характеризуется четырьмя квантовыми числами?
-
n, l,
 ,
,

-
l, k, t
-
n, l,
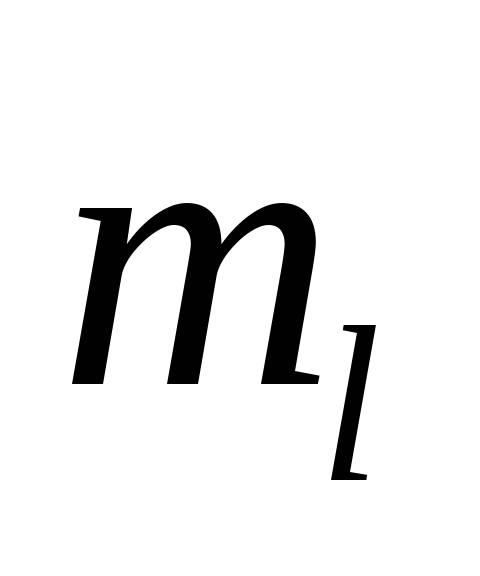 ,
t,
k
,
t,
k -
 ,
k,
l, m
,
k,
l, m -
n, l,
 ,
h
,
h
146. Возможные энергетические состояния электрона в атоме определяется....
-
главным квантовым числом
-
всеми квантовыми числами
-
орбитальным квантовым числом
-
магнитным квантовым числом
-
спиновым квантовым числом
147. Форму электронного облака описывает...
-
орбитальное квантовое число
-
главное и орбитальное квантовое число
-
спиновое квантовое число
-
орбитальное и спиновое квантовое число
-
магнитное и главное квантовое число
148.
Магнитное квантовое число
![]() определяет...
определяет...
-
ориентацию электронного облака в пространстве
-
форму электронного облака
-
запас энергии электрона
-
2 и 3 – вместе
-
собственное состояние электрона
149. Какие значения характерны для магнитного квантового числа?
150. "В атоме не может быть двух электронов, у которых все четыре квантовых числа были бы одинаковыми". Это утверждение является...
-
принципом Паули
-
постулатом Бора
-
правилом Хунда
-
правилом Клечковского
-
периодический закон
151. Математическое выражение закона эквивалентов:
А)
![]()
В)
![]()
С)
![]()
D)
![]()
Е)
![]()
152. Эквивалент вещества измеряется в:
А) г/моль
В) моль/г
С) кг/моль
D) моль/кг
Е) моль
153. Эквивалентом называется:
А) количество вещества, взаимодействующее с 1моль атомов водорода в химических реакциях
В) количество вещества, взаимодействующее с 1моль молекул водорода в химических реакциях
С) количество вещества, взаимодействующее с 1моль атомов кислорода в химических реакциях
D) количество вещества, взаимодействующее с 1моль молекул кислорода в химических реакциях
Е) количество вещества, взаимодействующее с 1моль молекул воды в химических реакциях
154. Химическая формула показывает:
А) качественный и количественный состав молекулы
В) качественный состав и структуру молекулы
С) количественный состав и структуру молекулы
D) порядок соединения атомов в молекуле
Е) количественный состав молекулы
155. Химическое уравнение реакции является выражением закона:
А) сохранения масс
В) сохранения энергии
С) действующих масс
D) периодического
Е) кратных отношений
156. Восстановительные свойства атомов определяются:
А) способностью отдавать электроны
В) способностью принимать электроны
С) линейной зависимостью свойств атомов от радиуса атома
D) периодичностью заполнения электронных оболочек атома
Е) увеличением атомной массы
157. Физический смысл периодического закона заключается в:
А) периодичности увеличения атомных масс
В) периодичности заполнения электронных оболочек атомов
С) способности атомов принимать электроны
D) способности атомов терять электроны
Е) способности атомов образовывать химические связи
158. Физическим смыслом порядкового номера элемента является:
А) заряд ядра атома
В) заряд протона
С) заряд электрона
D) энергия электронов на уровне
Е) атомная орбиталь
159. Период - это ряд элементов, объединенных одинаковым:
А) числом энергетических уровней
В) числом валентных электронов
С) числом s, р-подуровней
D) числом d-подуровней
Е) числом квантовых чисел
160. С увеличением заряда ядра атома металлические свойства элементов:
А) в периодах слева направо ослабевают
В) в периодах слева направо усиливаются
С) в группах сверху вниз уменьшаются
D) в периодах слева направо не изменяются
Е) изменяются линейно
161. Атому хлора, находящемуся в высшей степени окисления, соответствует гидроксид:
А) HClO4
B) HClO3
C) HClO2
D) HClO
E) H2Cl2O4
162. Укажите общую формулу и характер высших оксидов элементов шестой группы:
А) ЭО3, кислотный
В) Э2О3, основной
С) ЭО6, кислотный
D) ЭО3, основной
Е) Э2О6, амфотерный
163. С увеличением степени окисления основной характер оксидов и гидроксидов:
А) ослабевает
В) усиливается
С) не изменяется
D) усиливается, проходя через максимум
Е) ослабевает, проходя через минимум
164.
Какой тип связи осуществлен в молекуле
![]() ?
?
А) донорно-акцепторная
В) ковалентная неполярная
С) ковалентная полярная
D) водородная
Е) металлическая
165. Перекрывание каких орбиталей приводит к образованию π-связи?
А) р-орбиталей
В) s-орбиталей
С) s- и d-орбиталей
D) spd-орбиталей
Е) f-орбиталей
166.
Сколько σ-связей связывает атомы
углерода в молекуле
![]() ?
?
А) 4
В) 3
С) 2
Д) 1
Е) 5
167. Укажите тип связи в молекуле CsF:
А) ионная
В) ковалентная полярная
С) металлическая
D) координативная
Е) ковалентная неполярная
168. Одним из условий образования ковалентной связи по методу ВС является взаимодействие:
А) двух электронов с антипараллельными спинами
В) двух электронов с параллельными спинами
С) электронов с параллельными спинами
D) электронов с антипараллельными спинами
Е) электронов
169. Химическая связь образуется только в случае, если:
А) энергия молекулы будет меньше суммы энергий взаимодействующих атомов
В) энергия молекулы будет больше суммы энергий взаимодействующих атомов
С) энергия системы будет постоянна
D) один из атомов будет иметь энергию, равную энергии молекулы
Е) суммарная энергия атомов будет меньше энергии молекулы
170. Энергия ионизации это:
А) количество энергии, которое необходимо для отрыва электрона от атома и вывода его из сферы действия ядра
В) количество энергии, выделяющееся при образовании отрицательного иона
С) количество энергии, выделяющееся при образовании молекулы
D) способность атома притягивать электронную плотность
Е) способность отдавать электроны
171. Ненаправленна и ненасыщаема:
А) ионная связь
В) ковалентная неполярная связь
С) ковалентная полярная связь
D) металлическая связь
Е) координационная связь
172. Энергия сродства к электрону характеризует:
А) неметаллические свойства атома
В) металлические свойства
С) амфотерность элемента
D) способность атома образовывать простые вещества с ионным типом связи
Е) основные свойства
173. Прочность химической связи характеризует:
А) энергия разрыва
В) энергия ионизации
С) длина связи
D) валентный угол
Е) энергия кристаллической решетки
174. Ковалентная неполярная связь образуется между атомами:
А) имеющими равные значения величин электроотрицательности
В) имеющими различные значения величин электроотрицательности
С) имеющими металлические свойства
D) имеющими восстановительные свойства
Е) имеющими резко отличающиеся значения величин электроотрицательности
175. Количественной оценкой полярности ковалентной связи является:
А) дипольный момент
В) длина связи
С) энергия ионизации
D) валентный угол
Е) гибридизация орбиталей
176.
Определите тип связи в молекуле
![]() :
:
А) ковалентная неполярная
В) ковалентная полярная
С) металлическая
D) координационная
Е) водородная
177. Закон действия масс отражает зависимость скорости реакции от:
А) концентраций реагирующих веществ
В) константы скорости реакции
С) массы катализатора
D) температуры
Е) величины константы равновесия
178. Какое из уравнений есть математическое выражение закона действия масс:
А)
![]()
B)
![]()
C)
![]()
D)
![]()
E)
![]()
179. Химическое равновесие характеризует состояние системы, когда:
А) скорость прямой реакции равна скорости обратной реакции
В) скорость прямой реакции больше скорости обратной реакции
С) скорость прямой реакции меньше скорости обратной реакции
D) идёт только прямая реакция
Е) идёт только обратная реакции
180. Константа скорости реакции есть:
А) коэффициент пропорциональности, равный произведению концентраций реагирующих веществ
В) величина, характеризующая зависимость скорости реакции от концентрации
С) коэффициент пропорциональности, равный отношению концентраций реагирующих веществ
D) величина, не связанная со скоростью реакции
Е) величина, меняющаяся в процессе реакции
181. Правило Вант-Гоффа учитывает влияние на скорость реакции:
А) температуры
В) концентрации
С) давления
D) массы катализатора
Е) агрегатного состояния реагирующих веществ
182. В две ступени протекает диссоциация:
А) угольной кислоты
В) азотистой кислоты
С) соляной кислоты
D) фосфорной кислоты
Е) азотной кислоты
183. Какие ионы могут совместно находиться в растворе:
А)
![]()
В)
![]()
С)
![]()
D)
![]()
Е)
![]()
184. Степенью диссоциации электролита называется:
А) доля его молекул, распавшихся на ионы
В) доля его молекул, не распавшихся на ионы
С) доля молекул растворителя, распавшихся на ионы
D) доля молекул растворителя, не распавшихся на ионы
Е) доля молекул электролита, химически связанного молекулами растворителя
185. Степень диссоциации определяется:
А) отношением числа молекул, распавшихся на ионы в данном растворе, к общему числу молекул электролита в растворе
В) отношением числа молекул электролита к общему числу молекул растворителя
С) отношением числа молекул электролита к общему числу молекул электролита и растворителя
D) отношением числа молекул электролита, распавшихся на ионы, к общему числу молекул растворителя
Е) отношением произведения концентраций ионов к концентрации электролита
186. Связь константы диссоциации со степенью диссоциации выражается уравнением:
А)
![]()
В)
![]()
С)
![]()
D)
![]()
Е)
![]()
187. Константа диссоциации зависит:
А) от природы электролита и растворителя и от температуры
В) только от концентрации растворителя
С) от температуры и концентрации электролита
D) только от природы электролита
Е) только от природы растворителя
188. Степень окисления это:
А) условный заряд атома в молекуле
В) валентность элемента
С) изменяющаяся величина
D) величина, характеризующая способность элемента к реакциям замещения
Е) свойство элемента
189. Окислительно-восстановительные реакции – это реакции:
А) идущие с перемещением электронов от одних частиц к другим
В) идущие с отдачей электронов
С) идущие с присоединением электронов
D) при которых осуществляется только восстановительный процесс
Е) при которых осуществляется только окислительный процесс
190. Восстановление - процесс:
А) присоединения электронов
В) отдачи электронов
С) идущий без изменения степеней окисления
D) который не относится к окислительно-восстановительным реакциям
Е) в результате которого у восстановителя уменьшается положительная степень окисления
191. Восстановитель - это вещество:
А) отдающее электроны
В) принимающее электроны
D) регулирующее скорость реакции
С) являющееся катализатором реакции
Е) являющееся ингибитором реакции
192. Окислитель- это вещество:
А) принимающее электроны и понижающее при этом положительную степень окисления
В) принимающее электроны и повышающее при этом положительную степень окисления
С) отдающее электроны
D) степень окисления которого в процессе не меняется
Е) являющееся катализатором
193. Электродный потенциал металла рассчитывают по уравнению:
А)
![]()
В)
![]()
С)
![]()
D)
![]()
Е)
![]()
194. Какой процесс идет на аноде при электролизе водного раствора сульфата никеля с активным никелевым анодом:
А) окисление никелевого анода
В) окисление воды
С) восстановление катионов никеля
D) восстановление сульфат-ионов
Е) окисление сульфат-ионов
195. Рассчитать ω% раствора сульфата натрия, если в 250 г этого раствора содержится 50 г соли:
А) 20
В) 10
С) 50
D) 100
Е) 25
196. Укажите соли, гидролизующиеся только по катиону:
А)
![]()
B)
![]()
C)
![]()
D)
![]()
E)
![]()
197. Нормальная концентрация раствора определяется:
А) числом эквивалентов, содержащихся в 1000 мл раствора
В) числом молей, содержащихся в 1 л раствора
С) числом эквивалентов, приходящихся на 1000 г растворителя
