
Экзаменационные тесты по химии
.doc1. Химия - это наука о превращениях веществ, а что она изучает?
-
состав и строение веществ
-
различные виды материи
-
явления неживой природы
-
строение ионов
-
атомный состав вещества
2. Наименьшая частица элемента - это...
-
атом
-
молекула
-
изотоп
-
квант
-
эквивалент
3. Явление существования химического элемента в виде нескольких простых веществ, называется...
A) аллотропия
B) квантизация
C) усложнение
D) изотопы
E) ионизация
4. В основе атомно-молекулярного учения лежит принцип дискретности. Что это за принцип?
A) прерывности строения
B) ионного строения
C) электронного строения
D) энергетического строения
E) непрерывности строения
5. Количество вещества, которое в химических реакциях соединяется с 1 моль атомов водорода или замещает 1 моль атомов (ионов) водорода в соединениях, называется:
A) химическим эквивалентом вещества
B) молекулой вещества
C) массой вещества
D) химическим элементом
E) титром раствора
6. О чем свидетельствует способность элементов вступать в соединения определенными порциями?
A) о прерывном строении
B) об отрицательном заряде
C) о положительном заряде
D) о непрерывном строении
E) нет правильного ответа
7. Кто предложил ядерную модель атома?
-
К. Резерфорд
-
Д. Чедвик
-
А. Беккерель
-
А. Эйнштейн
-
Н. Бор
8. Кто сформулировал закон сохранения масс?
-
Ломоносов
-
Планк
-
Томсон
-
Менделеев
-
Дальтон
9. Концентрация показывающая, сколько граммов растворенного вещества содержится в 1 мл раствора, называется:
-
титром
-
массовой долей растворенного вещества в растворе
-
процентной концентрацией
-
молярной концентрацией
-
молярной концентрацией эквивалента
10. Молярная концентрация - это отношение количества вещества (моль) к…
-
объему раствора, л
-
массе раствора, кг
-
массе растворителя, кг
-
количеству растворителя, л
-
объему растворителя, мл
11. Растворимость вещества определяют при постоянной температуре в:
-
насыщенном растворе
-
разбавленном растворе
-
концентрированном растворе
-
ненасыщенном растворе
-
идеальном растворе
12. Молекула-это...
-
наименьшая частица вещества, обладающая его химическими свойствами
-
наибольшая частица вещества, обладающая его физическими свойствами
-
наименьшая частица элемента, обладающая его химическими свойствами
-
наименьшая частица элемента, обладающая его физическими свойствами
-
наименьшая частица элемента, обладающая его амфотерными свойствами
13. В каком году был открыт периодический закон?
A) 1869 г.
B) 1854 г.
C) 1856 г.
D) 1875 г.
E) 1877 г.
14. Как называют малые периоды?
A) типические
B) неэквивалентные
C) идеальные
D) главные
E) побочные
15. Раствор, который содержит очень малое количество растворенного вещества по сравнению с количеством растворителя, называется:
A) разбавленным
B) концентрированным
C) насыщенным
D) буферным
E) изотоническим
16. Молярная доля растворенного вещества - это отношение количества растворенного вещества (моль) к:
A) количеству раствора, моль
B) массе раствора, кг
C) объему раствора, мл
D) массе растворителя, кг
E) объему растворителя, л
17. Из каких периодов состоит побочная подгруппа?
A) из больших
B) из средних
C) из малых и больших
D) из малых и средних
E) из больших и средних
18. Формулировка периодического закона:
A) свойства элементов и их соединений находятся в периодической зависимости от заряда ядра атомов
B) свойства элементов не зависят от заряда ядра атомов элемента
C) свойства элементов и их соединений находятся в периодической зависимости от электроотрицательности атома
D) свойства элементов и их соединений не зависят от заряда ядра
E) свойства элементов и их соединений зависят от порядкового номера элемента
19. В процентах может быть выражена:
A) массовая доля растворенного вещества
B) молярная концентрация
C) молярная концентрация эквивалента
D) титр раствора
E) моляльная концентрация
20. Реакции, протекающие с изменением степени окисления элементов называются:
A) окислительно-восстановительными реакциями
B) реакциями нейтрализации
C) обратимыми реакциями
D) необратимыми реакциями
E) реакциями осаждения
21. Отдача электронов, которая сопровождается повышением степени окисления элемента, называется:
A) окислением
B) восстановлением
C) нейтрализацией
D) осаждением
E) диссоциацией
22. Вещество, которое отдает электроны в ходе окислительно-восстановительной реакции, называется:
A) восстановителем
B) индикатором
C) катализатором
D) ингибитором
E) окислителем
23. Вещество, которое принимает электроны в ходе окислительно-восстановительной реакции, называется:
A) окислителем
B) катализатором
C) индикатором
D) ингибитором
E) восстановителем
24.
Степень окисления серы в
![]() равна:
равна:
A) +6
B) +2
C) +4
D) -2
E) -4
25. Высшая степень окисления элемента главной подгруппы соответствует:
A) номеру группы, в которой расположен элемент
B) номеру периода, в которой расположен элемент
C) порядковому номеру элемента
D) числу энергетических уровней
E) номеру подгруппы, в которой расположен элемент
26. Часть внутренней энергии системы, которую можно превратить в полезную работу при постоянном давлении и постоянной температуре, называется:
A) энергией Гиббса, G
B) энтальпией, Н
C) энтропией, S
D) тепловым эффектом реакции,
E) связанной энергией
27. Однородная система, все части которой имеют одинаковые свойства и не имеют поверхностей раздела, называется
A) гомогенной
B) гетерогенной
C) закрытой
D) окислительно-восстановительной
E) изолированной
28. Наука, которая устанавливает связь между различными видами энергии, изучает возможность, направленность и пределы самопроизвольно текущих процессов, называется:
A) термодинамикой
B) кинетикой
C) аналитической химией
D) физической химией
E) кинематикой
29. "Если на систему, находящуюся в равновесии оказать внешнее воздействие Т, С, Р, то равновесие сместится в сторону ослабления оказанного воздействия". Это:
A) принцип Ле Шателье
B) закон сохранения массы
C) закон действующих масс
D) закон сохранения энергии
E) закон Гесса
30. Вещества, небольшие количества которых сильно замедляют скорость химической реакции, называются:
А) ингибиторами
B) индикаторами
C) ферментами
D) промоторами
E) каталитическими ядами
31. Реакции, протекающие одновременно в двух противоположных направлениях, называются:
A) обратимыми
B) простыми
C) сложными
D) быстрыми
E) необратимыми
32. Изменение молярной концентрации реагирующих веществ или продуктов реакции в единицу времени называется
A) скоростью химической реакции
B) фазовым равновесием
C) обратимой реакцией
D) эквивалентной точкой
E) активацией
33. Неустойчивое состояние реагирующих веществ, когда старые связи еще полностью не разрушены, а новые связи еще не образовались, называется
A) активированным комплексом (переходным состоянием)
B) комплексным соединением
C) комплексоном
D) энергией активации
E) химическим равновесием
34. Раздел химии, изучающий законы и механизм протекания химических реакций, влияние внешних условий на них, называется:
A) химической кинетикой
B) аналитической химией
C) химическим эквивалентом
D) химической термодинамикой
E) физической химией
35. Энергия, необходимая для перевода 1 моль неактивных молекул в активное состояние, называется:
A) энергией активации
B) внутренней энергией
C) свободной энергией
D) энергией Гиббса
E) потенциальной энергией
36. При увеличении температуры на каждые 10 градусов скорость химической реакции увеличивается в:
A) 2-4 раза
B) 7-9 раз
C) 3-5 раз
D) 5-7 раз
E) 10 раз
37. Скорость гомогенной химической реакции при постоянной температуре прямо пропорциональна произведению молярных концентраций реагирующих веществ, взятых в степенях, равных коэффициентам, стоящим в уравнении реакции. Это формулировка:
A) закона действующих масс
B) закона Гесса
C) закона сохранения энергии
D) второго закона термодинамики
E) закона сохранения массы веществ
38. Скорость химической реакции зависит от:
A) температуры, концентрации, присутствия катализатора, природы веществ
B) концентрации веществ и присутствия катализатора
C) температуры, природы реагирующих веществ
D) температуры и концентрации веществ
E) температуры и катализатора
39. Реакции, протекающие в несколько стадий - это реакции:
A) сложные
B) простые
C) гомогенные
D) гетерогенные
E) медленные
40. В математической записи правила Вант-Гоффа для определения скорости реакции гамма является:
A) температурным коэффициентом реакции
B) константа ионной скорости реакции
C) скоростью реакции при температуре
D) константой равновесия реакции
E) изотоническим коэффициентом
41. Атом или ион, занимающий центральное положение в комплексном соединении, называется:
A) комплексообразователем
B) лигандом
C) координационным числом
D) внешней координационной сферой
E) гелем
42. Соединения, в состав которых входят сложные частицы, способные к самостоятельному существованию в растворах и в расплавах, называются:
A) комплексными
B) буферными
C) высокомолекулярными
D) индикаторами
E) катализаторами
43. Комплексообразующую способность центрального атома (комплексообразователя) характеризует:
A) координационное число
B) дентантность лиганд
C) константа устойчивости комплексного иона
D) константа нестойкости комплексного иона
E) заряд комплексного иона
44. Частицы (ионы и молекулы), которые располагаются вокруг комплексообразователя в комплексном соединении, называются:
A) лигандами (аддендами)
B) внешней сферой
C) константой устойчивости
D) комплексообразователем
E) растворителем
45.
Комплексное соединение![]() относится
к:
относится
к:
A) аквакомплексам
B) хелатным комплексам
C) аммиакатам
D) карбонильным комплексам
E) ацидокомплексам
46.
Чему равен заряд комплексного иона
![]()
A) 0
B) -2
C) +2
D) -3
E) +1
47. Выберите правильную формулу гидроксида висмута
A)
![]()
B)
![]()
C)
![]()
D)
![]()
E)
![]()
48. Для восстановления менее активных металлов из водных растворов солей применяют ли щелочные металлы?
A) нет
B) да
C) некоторые из щелочных металлов
D) при определенных условиях
E) нет правильного ответа
49.
Определите степень окисления центрального
атома в комплексе
![]()
A) +3
B) +2
C) +1
D) -1
E) -3
50.
Даны оксиды
![]() .
У какого оксида сильнее выражены
кислотные свойства?
.
У какого оксида сильнее выражены
кислотные свойства?
A)
![]()
B)
![]()
C) выражены в равной степени
D) не проявляют кислотных свойств вообще
E)
![]() не
проявляет кислотные свойства, а
не
проявляет кислотные свойства, а
![]() -
проявляет
-
проявляет
51. Как следует изменить температуру равновесной системы, чтобы повысить выход хлора
![]()
A) понизить
B) повысить
C) не изменять температуру
D) температура не влияет
E) нет правильного ответа
52. В ряду гидроксидов LiOH-CsOH основные свойства
A) усиливаются
B) ослабевают
C) не изменяются
D) становятся амфотерными
E) сначала ослабевают, затем усиливаются
53. Из перечисленных формул укажите кислотный оксид
A)
![]()
B)
![]()
C) ВаО
D)
![]()
E) СаО
54. Плотность углекислого газа по водороду равна
A) 22
B) 12
C) 11
D) 29
E) 44
55. Какие металлы получают электролизом только расплавов солей
A) Nа
B) Hg
C) Cu
D) Fe
E) Mg
56. Из следующих соединений укажите кислую соль
A)
![]()
B)
![]()
C)
![]()
D)
![]()
E)
![]()
57.
Заряд комплексного иона в формуле
![]()
A) -4
B) +2
C) +4
D) -2
E) 0
58. Укажите металл, который может взаимодействовать с растворами щелочей
A) Zn
B) Ca
C) Na
D) Li
E) Ва
59. Энергия ионизации у атомов:
A) уменьшается в главной подгруппе с увеличением атомной массы
B) возрастает в главной подгруппе с увеличением атомной массы
C) возрастает в главной и побочной подгруппах
D) уменьшается в главной и побочной подгруппах
E) возрастает в главной подгруппе с уменьшением атомной массы
60.
В соединениях
![]() кристаллическая
решетка
кристаллическая
решетка
A) молекулярная
B) ионная
C) атомная
D) металлическая
E) аморфная
61. Энтропия - это....
A) количественная мера беспорядка частиц в системе
B) величина, показывающая теплоту образования вещества
C) изобарно-изотермический потенциал
D) величина теплового эффекта реакции
E) количественная мера упорядоченности частиц в системе
62. Скорость каких реакции увеличивается с повышением температуры?
A) эндотермических
B) экзотермических
C) любых
D) только окислительно-восстановительных
E) термодинамических
63.
Укажите основность кислоты
![]() :
:
A) 3
B) 1
C) 2
D) 4
E) 2,5
64.
Даны две кислоты:
![]() и
и
![]() - окислительные свойства ярче проявляет…
- окислительные свойства ярче проявляет…
A)
![]()
B)
![]()
C) в равной степени
D) не являются окислителями
E) являются восстановителями
65. Какой из перечисленных металлов способен реагировать с водой на холоде?
A) Na
B) Zn
C) Sn
D) Pb
E) Сu
66. Энтальпия – это...
A) величина, показывающая теплоту образованных веществ
B) количественная мера беспорядка частиц в системе
С) величина теплового эффекта реакции
D) изобарно-изотермический потенциал
Е) энергия системы
67. Укажите формулу Менделеева-Клапейрона:
A)
![]()
B)
![]()
C)
![]()
D)
![]()
E)
![]()
68. Чему равны давление и температура газа при нормальных условиях:
A)
![]()
B)
![]()
C)
![]()
D)
![]()
E)
![]()
69. Укажите формулу связи молярной массы и молярного объема:
A)
![]()
B)
![]()
C)
![]()
D)
![]()
E)
![]()
70.
Укажите основность уксусной кислоты
![]()
-
1
-
2
-
3
-
4
-
0
71. Укажите формулу закона действующих масс применительно к уравнению A + B→C + D
72. С какими веществами кислород реагирует при нормальных условиях?
-
Na
-
СО
-
Fe
-
Pt
-
Сu
73."Царская водка" - это...?
-
смесь
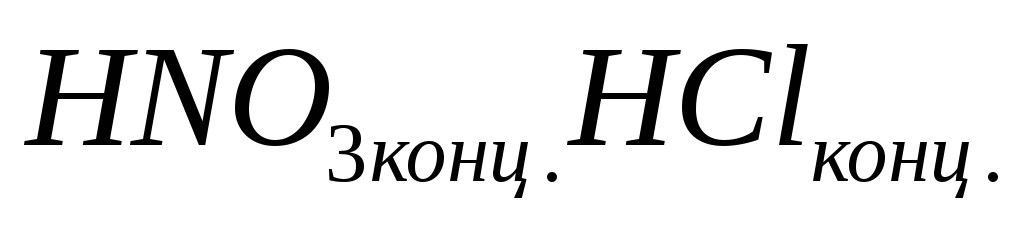
-
смесь
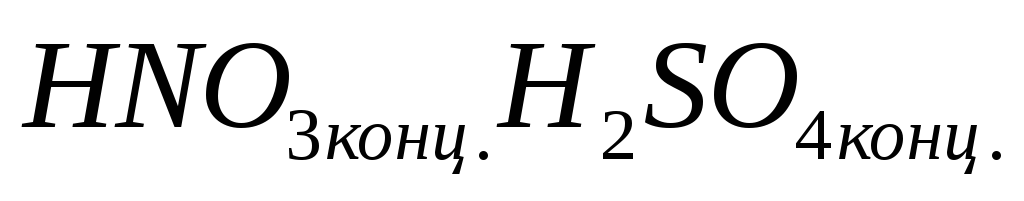
-
смесь

-
смесь
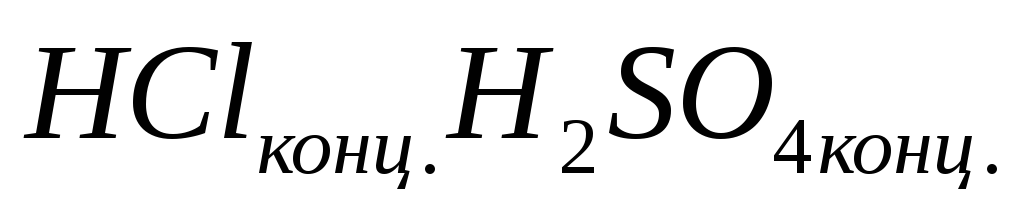
-
смесь
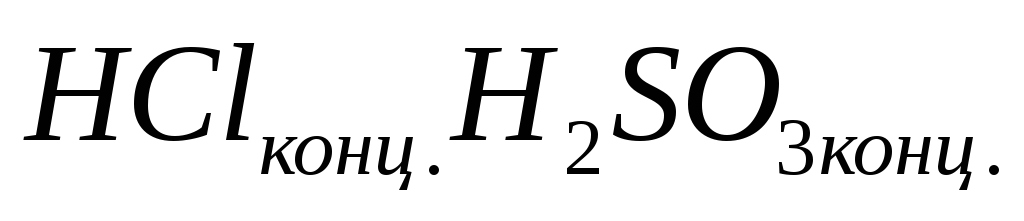
74. У какого элемента степень окисления переменная?
-
S
-
Са
-
Аl
-
Ti
-
К
75.
Какой кислоте соответствует оксид
![]() ?
?
76. Какая кислота показывает самую сильную кислую среду?
77. Какие соли определяют жесткость воды?
78. Галогены:
-
элементы VII группы главной подгруппы
-
элементы VII группы побочной подгруппы
-
р-элементы VII группы главной подгруппы
-
s-элементы VII группы побочной подгруппы
-
s- и р-элементы VII группы побочной подгруппы
79.
В соединениях:
![]()
-
степени окисления хрома равны:+3,+6
-
степени окисления хрома равны:+3
-
степени окисления хрома равны:+3,+4,+6
-
степени окисления хрома равны:+6
-
степени окисления хрома равны:+6, +2
80. Из соединений укажите ортоформу кислоты
81. В большом периоде с увеличением атомной массы, притяжение электрона будет:
-
увеличиваться
-
уменьшаться
-
не изменится
-
возрастает для s- и р-элементов
-
убывает для s- и р-элементов
82. В какой кислоте растворяется золото?
83. Степени окисления золота:
-
устойчивая +3
-
не устойчивая +1, +3
-
устойчивая +1
-
не устойчивая +1,+2
-
устойчивая +1, +3
84.
Электронная формула какого атома
приведена![]() :
:
-
V
-
Ti
-
Cr
-
Nb
-
Ta
85.
Электронная формула какого атома
приведена
![]() :
:
-
Se
-
S
-
Те
-
Po
-
As
86. Из приведенных формул кислот укажите дикислоту:
87. Укажите формулу дисерной кислоты
88. Укажите формулу перхлората калия:
-
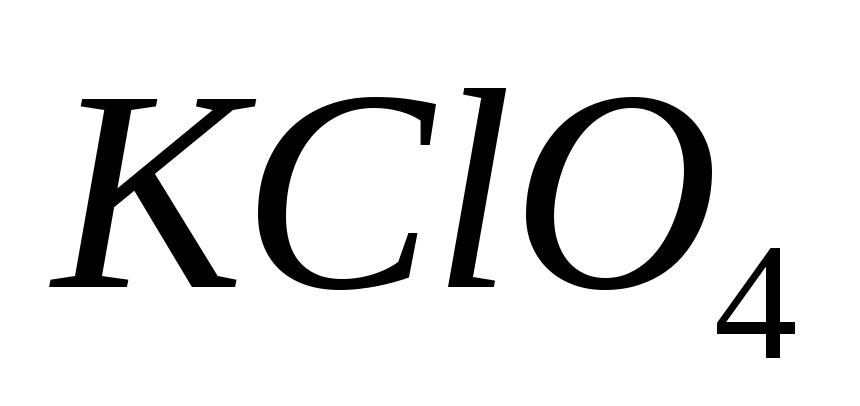
-
КСl
-
КСlО
-
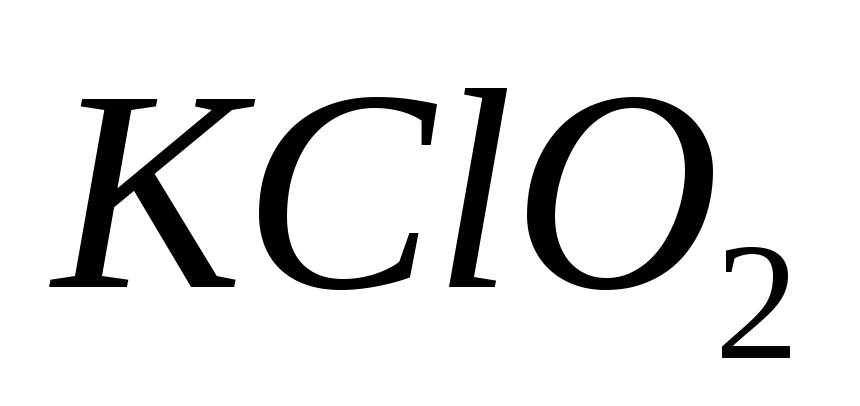
-
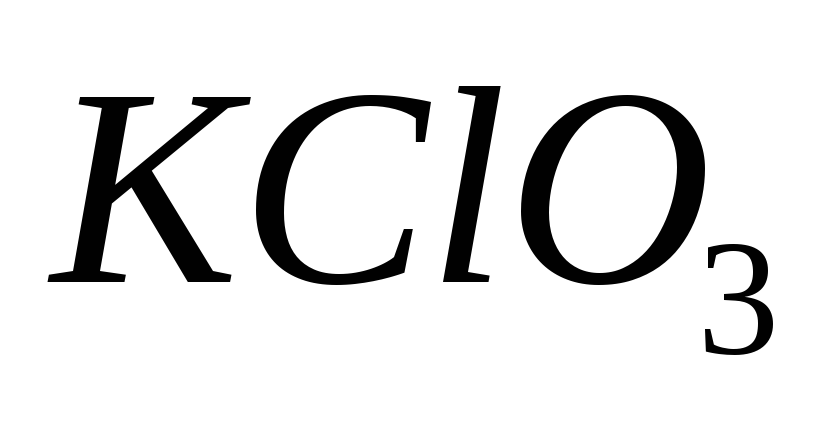
89. Выберите ряд кислот в орто-форме:
90.
Молярная масса эквивалента оксида
![]()
-
13,33 г/моль
-
26,67 г/моль
-
80 г/моль
-
5,33 г/моль
-
16 г/моль
91.
Молярная масса эквивалента карбоната
кальция
![]() :
:
-
50 г/моль
-
100 г/моль
-
4 г/моль
-
20 г/моль
-
1/2 моль
92. Молярная масса эквивалента серной кислоты равна
-
49 г/моль
-
98 г/моль
-
30 г/моль
-
16 г/моль
-
90 г/моль
93. Эквивалент химического элемента зависит от
-
его валентности в соединении
-
температуры
-
атмосферного давления
-
осмотического давления
-
присутствия катализатора
94. Верно ли утверждение, что соотношения между массами элементов, входящих в состав данного соединения, постоянны и не зависят от способов получения этого соединения?
-
верно
-
неверно
-
верно, только для газов
-
верно, только для жидкостей
-
верно, только для твердых веществ
95. Химический эквивалент вещества имеет размерность:
-
г/моль
-
моль
-
моль/л
-
г/мл
-
моль/кг
96. С помощью какого уравнения можно вычислить мольные массы газов?
-
уравнение Клапейрона-Менделеева
-
уравнение Гей-Люссака
-
уравнение Томсона
-
уравнение Бойля-Мариотта
-
уравнение Эйнштейна
97. Что означает эквивалент вещества?
-
равноценный
-
пропорциональный
-
непропорциональный
-
неравноценный
-
устойчивый
98. Единица измерения молярной концентрации эквивалента вещества:
-
моль/л
-
моль
-
г/моль
-
г/мл
-
моль/кг
99. В чем выражается молекулярная масса вещества?
-
безразмерная величина
-
в граммах
-
в молях
-
в литрах
-
в г/моль
100. Для идеального газа мольный объем при нормальных условиях равен...
-
22,4 л/моль
-
22,4 моль/л
-
22,7л
-
22,467 л/моль
-
22,8 моль
101. Количество вещества (моль) в 1 кг растворителя показывает:
-
моляльная концентрация
-
молярная концентрация
-
молярная концентрация эквивалента
-
процентная концентрация
-
массовая доля вещества
102. Найти уравнение состояния идеального газа
-
PV =mRT/M
-
PV=QM/RT
-
PV=MR/m
-
PV=mRT
-
PV=mRM
103. Массовая доля растворенного вещества определяется как:
-
отношение массы растворенного вещества к массе раствора
-
количество растворенного вещества в 1 литре раствора
-
количество эквивалентов растворенного вещества в 1 литре раствора
-
количество граммов растворенного вещества в 1 мл раствора
-
количество вещества в 1 кг растворителя
104. Вещества взаимодействуют друг с другом в количествах, пропорциональных их..
-
эквивалентам
-
объемам
-
молярным массам
-
эквивалентам и объемам
-
давлению
105. Какое из определений выражает закон Авогадро?
-
в равных объемах любых газов, взятых при одной и той же температуре и одинаковом давлении содержится одинаковое число молекул
-
в равных объемах любых твердых веществ при одной и той же температуре содержится одинаковое число молекул
-
в равных объемах любых газов, взятых при одной и той же температуре и одинаковом давлении, содержится разное число молекул
-
в равных объемах любых газов, взятых при одной и той же температуре, но при разном давлении, содержится разное число молекул
-
в равных объемах любых газов, взятых при разных температурах и одинаковом давлении, содержится одинаковое число молекул
