
5. Класифікація електродів і гальванічних елементів.
Електродом першого роду називають метал або неметал, занурений в розчин, який містить його йони.
Електрод першого роду можна представити у вигляді схеми:
МZ+ | М. Рівняння електродної реакції:
МZ+ + ze ↔ M
У відповідності з правилами ІЮПАК реакцію, що відбувається на електроді, записують зліва направо, як реакцію відновлення. Підстановка активностей речовин, що приймають участь в електродній реакції, в загальне рівняння електродного потенціалу:
дає для електрода першого роду:
Електрод другого роду складається з металу, покритого шаром його важкорозчинної солі і зануреного в розчин, який містить йони цієї солі. Електрод другого роду записують у вигляді схеми А- | МА, М. Рівняння електродної реакції:
МА+ zе ↔М + Аz- .
У відповідності з рівнянням потенціал електрода другого роду можна записати у вигляді:
Враховуючи сталість аM і аMA, отримаємо
З цього рівняння випливає, що електрод другого роду оборотний до аніона. Електроди другого роду широко застосовуються в електрохімічних вимірюваннях як електроди порівняння.
Найбільш широке розповсюдження у практиці мають хлоросрібний та каломельний електроди.
Однак, окислювально-відновними або редокс-електродами називають тільки ті електроди, метал яких не бере участі в електродній реакції, а тільки переносить електрони від відновника до окислювача. Для цього використовують звичайно благородний метал. Окислювально-відновний електрод записують: Red, Ох |Рt, а електродну реакцію можна виразити
загальним рівнянням
Ох + zе ↔ Red
Електродний потенціал дорівнює:
Гальванічний елемент - джерело живлення, в якому використовується різниця електродних потенціалів двох металів, занурених у електроліт.
Найпростішим гальванічним елементом є елемент Вольти, в якому використовуються цинковий і мідний електроди, занурені в розчин сірчаної кислоти. Кожен із електродів зокрема разом із електролітом, в який він занурений, утворює напівелемент. На поверхні кожного з металів, занурених в електроліт, виникає подвійний електричний шар внаслідок переходу частини атомів металу в розчин у вигляді йонів. Як наслідок, кожен із металів отримує електричний заряд. Якщо з'єднати електроди провідником, то заряд стікатиме від електрода з більшим потенціалом, до електрода з меншим потенціалом, утворюючи електричний струм. При цьому потенціали електродів вирівнюватимуться, що призведе до порушення рівноваги між електродом і електролітом. Це, в свою чергу, викликає перехід нових атомів із електроду в електроліт. В результаті в замкненому колі підтримується електричний струм, який супроводжується розчиненням електродів. На малюнку праворуч показана схема дещо складнішого але досконалішого елемента, в якому кожен із металів перебуває в окремому електроліті. Електроліти з'єднані між собою соляним мостом. Активна маса електроду — це суміш, яка складається з речовини, хімічна енергія яких під дією заряду перетворюється на електричну енергию (активна речовина), і речовин, які покращують її провідність і певні физико-хімічні властивості.
Принцип дії гальванічного елемента використовується в електрохімічних батареях і акумуляторах.
6.
Активність йонів Активність
йонів –
це ефективна, умовна концентрація. а
= f ×
с,де а –
активність йонів; f
– коефіцієнт
активності; с –
концентрація йонів.Записуючи
рівняння електролітичної дисоціації,
необхідно слідкувати не тільки за
балансом атомів в обох частинах рівнянь,
але й за балансом зарядів йонів.Приклади
рівнянь електролітичної дисоціації
для різних груп електролітів:сильних
кислот: 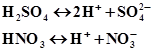 сильних
основ:
сильних
основ:  cередніх
солей:
cередніх
солей: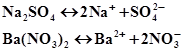 Cередні
і слабкі електроліти (кислоти і основи)
дисоціюють постадійно, причому ступінь
дисоціації кожної наступної стадії
зменшується. При записі рівнянь дисоціації
необхідно слідкувати за балансом зарядів
на кожній стадії (однакова сума
зарядів в лівій і правій частинах
рівняння). Слабкі
кислоти: H3PO4
↔
Cередні
і слабкі електроліти (кислоти і основи)
дисоціюють постадійно, причому ступінь
дисоціації кожної наступної стадії
зменшується. При записі рівнянь дисоціації
необхідно слідкувати за балансом зарядів
на кожній стадії (однакова сума
зарядів в лівій і правій частинах
рівняння). Слабкі
кислоти: H3PO4
↔![]() H+
+ H2PO
H+
+ H2PO![]() (
(![]() 1) H2PO
1) H2PO![]() ↔
↔![]() H+
+ HPO
H+
+ HPO![]() (
(![]() 2)HPO
2)HPO![]() ↔
↔![]() H+
+ PO
H+
+ PO![]() (
(![]() 3)a1
> a2
> a3. Слабкі
основи:
Fe(OH)3
↔ Fe(OH)
3)a1
> a2
> a3. Слабкі
основи:
Fe(OH)3
↔ Fe(OH)![]() + OH–
(
+ OH–
(![]() 1) Fe(OH)
1) Fe(OH)![]() ↔ FeOH2+
+ OH–
(
↔ FeOH2+
+ OH–
(![]() 2) FeOH2+
↔ Fe3+
+ OH–
(
2) FeOH2+
↔ Fe3+
+ OH–
(![]() 3) a1
> a2
> a3
.У
випадку кислих і основних солей слід
мати на увазі, що процес їх дисоціації
здійснюється у дві стадії: перша – як
сильного електроліту – солі і друга –
дисоціація утвореного на першій стадії
гідро- або гідроксойона – як слабкого
електроліту. Наприклад,кислі
солі:
3) a1
> a2
> a3
.У
випадку кислих і основних солей слід
мати на увазі, що процес їх дисоціації
здійснюється у дві стадії: перша – як
сильного електроліту – солі і друга –
дисоціація утвореного на першій стадії
гідро- або гідроксойона – як слабкого
електроліту. Наприклад,кислі
солі: ![]() основні
солі:
основні
солі:![]()
![]() Для
того, щоб показати стан електролітів в
розчині, рівняння хімічних реакцій
представляють в йонному (йонно-молекулярному)
вигляді. В йонних рівняннях сильні (які
добре дисоціюють) електроліти записують
у йонному вигляді, а слабкі і середні
електроліти, нерозчинні і газоподібні
речовини – у молекулярному вигляді.
При складанні таких рівнянь спочатку
необхідно написати молекулярне
рівняння, відтак повне йонно-молекулярне,
а потім скорочене йонно-молекулярне
рівняння (скоротити однакові йони в
обох частинах). В йонно-молекулярному
рівнянні повинен зберігатися баланс
зарядів.Приклад
1. Напишіть
молекулярні і йонно-молекулярні рівняння
реакції взаємодії між такими речовинами
у водному розчині:а)
К2S i HCI;
б) NiSO4 i NaOH; в) AI(OH)3 i
NaOH;г)
NaHCO3 i KOH; д) (CuOH)NO3 i
HNO3.Розв’язання. а) K2S
+ 2 HCl = 2 KCl +
H2S – молекулярне рівняння; 2
К+ + S2 - + 2 H+ + 2 Cl- = 2 K+ + 2 Cl- + H2S –
повне йонно-молекулярне рівняння;S2
- + 2 H+ = H2S –
скорочене йонно-молекулярне
рівняння;б) NiSO4
+ 2NaOH = Ni(OH)2 + Na2SO4;Ni2
+ + SO42 - + 2Na+ + 2OH - = Ni(OH)2 + 2Na+ + SO4 2
-; Ni2
+ + 2OH - = Ni(OH)2;в) Аl(ОН)3
+ 3NaOH = Na3AIO3 +
3H2O;Al(OH)3
+ 3Na+ + 3OH - = 3Na+ + AIO33- + 3H2O;
Al(OH)3 + 3OH - = AlO33- + 3H2O;г) 2NaHCO3
+ 2KOH = Na2CO3 + K2CO3 + 2H2O;2Na+
+ 2НС
Для
того, щоб показати стан електролітів в
розчині, рівняння хімічних реакцій
представляють в йонному (йонно-молекулярному)
вигляді. В йонних рівняннях сильні (які
добре дисоціюють) електроліти записують
у йонному вигляді, а слабкі і середні
електроліти, нерозчинні і газоподібні
речовини – у молекулярному вигляді.
При складанні таких рівнянь спочатку
необхідно написати молекулярне
рівняння, відтак повне йонно-молекулярне,
а потім скорочене йонно-молекулярне
рівняння (скоротити однакові йони в
обох частинах). В йонно-молекулярному
рівнянні повинен зберігатися баланс
зарядів.Приклад
1. Напишіть
молекулярні і йонно-молекулярні рівняння
реакції взаємодії між такими речовинами
у водному розчині:а)
К2S i HCI;
б) NiSO4 i NaOH; в) AI(OH)3 i
NaOH;г)
NaHCO3 i KOH; д) (CuOH)NO3 i
HNO3.Розв’язання. а) K2S
+ 2 HCl = 2 KCl +
H2S – молекулярне рівняння; 2
К+ + S2 - + 2 H+ + 2 Cl- = 2 K+ + 2 Cl- + H2S –
повне йонно-молекулярне рівняння;S2
- + 2 H+ = H2S –
скорочене йонно-молекулярне
рівняння;б) NiSO4
+ 2NaOH = Ni(OH)2 + Na2SO4;Ni2
+ + SO42 - + 2Na+ + 2OH - = Ni(OH)2 + 2Na+ + SO4 2
-; Ni2
+ + 2OH - = Ni(OH)2;в) Аl(ОН)3
+ 3NaOH = Na3AIO3 +
3H2O;Al(OH)3
+ 3Na+ + 3OH - = 3Na+ + AIO33- + 3H2O;
Al(OH)3 + 3OH - = AlO33- + 3H2O;г) 2NaHCO3
+ 2KOH = Na2CO3 + K2CO3 + 2H2O;2Na+
+ 2НС![]() +
2К + +
2ОН- =
2Na+ + CO32 - + 2K+ + CO32- + 2H2O;
2HC
+
2К + +
2ОН- =
2Na+ + CO32 - + 2K+ + CO32- + 2H2O;
2HC![]() + 2OH - = 2CO32 - + 2H2O;або HC
+ 2OH - = 2CO32 - + 2H2O;або HC![]() +
OH - = CO32 - + H2O;д) (CuOH)NO3
+ HNO3 = Cu(NO3)2 + H2O;CuOH+
+ N
+
OH - = CO32 - + H2O;д) (CuOH)NO3
+ HNO3 = Cu(NO3)2 + H2O;CuOH+
+ N![]() +
H+ + N
+
H+ + N![]() =
Cu2 + + 2N
=
Cu2 + + 2N![]() +
H2O;CuOH+
+ H+ = Cu2 + + H2O.Необхідно
врахувати, що реакції (а) і (б) відбуваються
практично до кінця, тому що в результаті
реакції відбувається зв’язування йонів
з утворенням слабкого електроліту (Н2S)
і осаду (Ni(OH)2),
а реакції (в), (г), (д) рівноважні
і положення рівноваги зміщено в бік
утворення слабшого електроліту (Н2О).При
складанні молекулярного рівняння за
даним скороченим йонно-молекулярним
рівнянням необхідно врахувати, що
кожному йону в йонно-молекулярному
рівнянні повинен відповідати сильний
електроліт в молекулярному рівнянні.
Тому при переході від скороченого до
повного йонно-молекулярного рівняння
до кожного йона необхідно додати такі
протилежно заряджені йони, щоб цій
парі відповідав сильний електроліт. Приклад
2. Складіть
молекулярні рівняння реакції, які
виражені скороченими йонно-молекулярними
рівняннями:а) АІ(ОН)3
+ 3 Н + = АІ 3 + + 3 Н2О;б) НСО3
- + ОН - = Н2О + С
+
H2O;CuOH+
+ H+ = Cu2 + + H2O.Необхідно
врахувати, що реакції (а) і (б) відбуваються
практично до кінця, тому що в результаті
реакції відбувається зв’язування йонів
з утворенням слабкого електроліту (Н2S)
і осаду (Ni(OH)2),
а реакції (в), (г), (д) рівноважні
і положення рівноваги зміщено в бік
утворення слабшого електроліту (Н2О).При
складанні молекулярного рівняння за
даним скороченим йонно-молекулярним
рівнянням необхідно врахувати, що
кожному йону в йонно-молекулярному
рівнянні повинен відповідати сильний
електроліт в молекулярному рівнянні.
Тому при переході від скороченого до
повного йонно-молекулярного рівняння
до кожного йона необхідно додати такі
протилежно заряджені йони, щоб цій
парі відповідав сильний електроліт. Приклад
2. Складіть
молекулярні рівняння реакції, які
виражені скороченими йонно-молекулярними
рівняннями:а) АІ(ОН)3
+ 3 Н + = АІ 3 + + 3 Н2О;б) НСО3
- + ОН - = Н2О + С![]() .Розв’язання.а)
повне йонно-молекулярне рівняння:АІ(ОН)3
+ 3 H + + 3 Cl - = Al 3 + + 3 Cl - + 3 H2O (як
протийон до Н+ використано
йон Сl–, оскільки
пара цих йонів утворює сильний
електроліт НСІ).Молекулярне
рівняння: Аl(ОН)3
+ 3НСl = АlСl3 + 3Н2О; б)
повне йонно-молекулярне рівняння:Na
+ + HCO3 - + Na + + OH - = H2O + 2 Na + +
C
.Розв’язання.а)
повне йонно-молекулярне рівняння:АІ(ОН)3
+ 3 H + + 3 Cl - = Al 3 + + 3 Cl - + 3 H2O (як
протийон до Н+ використано
йон Сl–, оскільки
пара цих йонів утворює сильний
електроліт НСІ).Молекулярне
рівняння: Аl(ОН)3
+ 3НСl = АlСl3 + 3Н2О; б)
повне йонно-молекулярне рівняння:Na
+ + HCO3 - + Na + + OH - = H2O + 2 Na + +
C![]() .Молекулярне рівняння:NaHCO3
+ NaOH = H2O + Na2CO3.Йонні
реакції обміну в розчинах електролітівРеакції
за участю електролітів спрямовані у
бік утворення неелектроліту або
слабкого електроліту. Ці реакції
практично відбуваються до кінця в таких
випадках:а)
при утворенні осаду важкорозчинних
речовин:AgNO3
+ NaCI = AgCI¯ + NaNO3скорочене
йонно-молекулярне рівняння буде мати
вигляд:Ag+
+ CI - = AgCI¯;б)
при утворенні газоподібних летких
речовин:Na2CO3
+ 2HCI = NaCI + CO2 + H2O або
йонно-молекулярне рівняння реакції:СO32
- + 2H+ = CO2 + H2O;в)
при утворенні таких малодисоційованих
речовин (слабких електролітів), як
вода, комплексні йони і інші: NaOH
+ HCI = NaCI + H2O або
йонно-молекулярне рівняння реакції:OH
- + H + = H2O;при
утворенні комплексних йонів:
.Молекулярне рівняння:NaHCO3
+ NaOH = H2O + Na2CO3.Йонні
реакції обміну в розчинах електролітівРеакції
за участю електролітів спрямовані у
бік утворення неелектроліту або
слабкого електроліту. Ці реакції
практично відбуваються до кінця в таких
випадках:а)
при утворенні осаду важкорозчинних
речовин:AgNO3
+ NaCI = AgCI¯ + NaNO3скорочене
йонно-молекулярне рівняння буде мати
вигляд:Ag+
+ CI - = AgCI¯;б)
при утворенні газоподібних летких
речовин:Na2CO3
+ 2HCI = NaCI + CO2 + H2O або
йонно-молекулярне рівняння реакції:СO32
- + 2H+ = CO2 + H2O;в)
при утворенні таких малодисоційованих
речовин (слабких електролітів), як
вода, комплексні йони і інші: NaOH
+ HCI = NaCI + H2O або
йонно-молекулярне рівняння реакції:OH
- + H + = H2O;при
утворенні комплексних йонів:![]() FeCl3
+ 6 KCNS = K3[Fe(CNS)6] + 3KCl або
йонно–молекулярне рівняння реакції:Fe3
+ + 6CNS – = [Fe(CNS)6]3–.Нагадаємо,
що при складанні йонно–молекулярних
рівнянь реакцій всі сильні електроліти
записуються в йонній формі. Середні і
слабкі електроліти та неелектроліти
записуються в молекулярній
формі. Список
використанної літератури:1.
http://intranet.tdmu.edu.ua/auth.php2.
http://idndist.lp.edu.ua/
FeCl3
+ 6 KCNS = K3[Fe(CNS)6] + 3KCl або
йонно–молекулярне рівняння реакції:Fe3
+ + 6CNS – = [Fe(CNS)6]3–.Нагадаємо,
що при складанні йонно–молекулярних
рівнянь реакцій всі сильні електроліти
записуються в йонній формі. Середні і
слабкі електроліти та неелектроліти
записуються в молекулярній
формі. Список
використанної літератури:1.
http://intranet.tdmu.edu.ua/auth.php2.
http://idndist.lp.edu.ua/
