
10.Оксикарб.кисл
.pdf
Глава 10. ОКСИКАРБОНОВЫЕ КИСЛОТЫ
=============================================================
Оксикарбоновые кислоты – это производные карбоновых кислот, содержащие наряду с карбоксильными группами (–CОOН) одну или несколько гидроксильных групп (– OН).
В зависимости от строения углеводородного радикала оксикарбоновые кислоты подразделяют на алифатические (спиртокислоты) и ароматические (фенолокислоты). Число карбоксильных групп в молекуле оксикислоты определяет еѐ основность. По числу спиртовых гидроксилов (соединѐнных с углеводородным радикалом) различают монооксикарбоновые кислоты (с одним гидроксилом), диоксикарбоновые кислоты (с двумя гидроксилами) и т.д. Существует также понятие атомность оксикислот. Это число гидроксилов, включая и входящие в состав карбоксильных групп. Так, гликолевая кислота НО–СН2–СООН является монооксикарбоновой, одноосновной двухатомной кислотой.
=============================================================
10.1. АЛИФАТИЧЕСКИЕ ОКСИКАРБОНОВЫЕ КИСЛОТЫ
============================================================
10.1.1. НОМЕНКЛАТУРА И ИЗОМЕРИЯ АЛИФАТИЧЕСКИХ ОКСИКАРБОНОВЫХ КИСЛОТ
Для оксикарбоновых кислот широко используют тривиальные названия и названия, соответствующие заместительной номенклатуре ИЮПАК:
|
|
|
|
|
|
|
ФОРМУЛА |
|
ТРИВИАЛЬНАЯ |
ЗАМЕСТИТЕЛЬНАЯ |
||||||||||||||
ОКСИКИСЛОТЫ |
НОМЕНКЛАТУРА |
НОМЕНКЛАТУРА |
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
гликолевая |
оксиуксусная кислота, |
|||
CH2 |
|
|
|
|
C OH |
|
|
|
кислота |
гидроксиэтановая кислота |
||||||||||||||
|
|
|
|
|
|
|||||||||||||||||||
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
молочная кислота |
α-оксипропионовая |
||
CH3 |
|
|
|
|
|
CH |
|
|
|
C OH |
|
|
кислота; 2-гидрокси- |
|||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
пропановая кислота |
|||||||
O |
C |
|
|
|
CH |
|
|
|
|
CH2 |
|
|
C |
O |
яблочная кислота |
оксиянтарная кислота; |
||||||||
HO |
|
|
|
|
|
|
|
|
|
OH |
|
гидроксибутандиовая |
||||||||||||
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
кислота |
||||
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|||||
O |
C |
|
|
|
CH |
|
|
|
CH |
|
|
C |
O |
винная кислота |
α-,α'- диоксиянтарная |
|||||||||
HO |
|
|
|
|
|
|
|
OH |
|
кислота; 2,3-дигидрокси- |
||||||||||||||
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
бутандиовая кислота |
||||
|
|
|
|
|
|
|
|
|
OH |
|
|
OH |
|
|
|
|
||||||||
Простейшие оксикислоты обычно называют по их природным источникам (молочная, яблочная и др.). Строгое следование правилам заместительной номенклатуры ИЮПAK требует называть группу ОН гидрокси-, тем не менее в русской химической литературе для ОН-группы прочно укоренилось название окси–. При этом за родоначальное принимается тривиальное или
212

систематическое название карбоновой кислоты. Положение гидроксильной группы в углеводородной цепи обозначается буквами греческого алфавита (при использовании тривиального названия родоначальной структуры) или цифрами (при использовании систематического названия родоначальной структуры).
Для алифатических оксикарбоновых кислот характерна структурная изомерия, обусловленная различной структурой углеводородного радикала, связанного с карбоксильной группой (как в 2-гидроксибутановой и 2-метил-2- гидроксипропановой кислотах), и разным положением ОН-группы в углеводородной цепи (как в 2-гидроксибутановой и 3-гидроксибутановой кислотах):
|
|
|
|
ОН |
|
|
|
ОН |
|
|
|
|
|
ОН |
|
|||||||
4 |
|
3 |
2 |
|
|
1 |
4 |
3 |
|
|
2 |
|
1 |
3 |
2 |
|
|
|
1 |
|||
CH3 |
|
CH2 |
|
CH |
|
COOH |
CH3 |
|
CH |
|
CH2 |
COOH |
CH3 |
|
C |
|
|
COOH |
||||
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
3-гидроксибутановая кислота |
|
|
CH3 |
|||||||||||
2-гидроксибутановая кислота |
2-метил-2-гидроксипропановая |
|||||||||||||||||||||
кислота
Кроме того, в ряду оксикислот часто встречается оптическая изомерия (вид пространственной изомерии), проявляющаяся в способности некоторых соединений вращать плоскополяризованный луч света на определѐнный угол α вправо или влево. Если луч обычного света пропустить через призму Николя, то выходящий свет будет плоскополяризованным. В таком луче электромагнитные колебания совершаются только в одной плоскости. Эту плоскость называют плоскостью поляризации. Если при прохождении поляризованного света через оптически активное вещество плоскость поляризации поворачивается вправо, это вещество называют правовращающим (обозначается знаком «+»), если влево – левовращающим (обозначается знаком
«–»).
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
источниксвета |
призма Николя |
плоскополяризо- |
кювета с оптически |
|
|
|||||
|
|
(пполяризатор) |
ванный свет |
активным веществом |
|
|
||||
Обязательным условием для проявления веществом оптической активности является асимметрия (отсутствие симметрии) его молекул. Одной из причин возникновения асимметрии органических молекул является наличие в их структуре sp3-гибридизованного атома углерода, связанного с четырьмя различными заместителями. Такой атом углерода называется асимметрическим или хиральным (от греч. χειρ – рука) и обозначается
|
|
H |
O |
||
|
|
|
|
|
|
CH3 |
|
C* |
|
C OH |
|
|
|
||||
|
|
|
|
||
звѐздочкой С*. Например, молочная кислота |
|
OH |
содержит в |
||
своей структуре асимметрический атом углерода и существует в виде двух оптических изомеров (энантиомеров, зеркальных изомеров):
213

|
СООН |
|
|
СООН |
||
|
|
|
||||
|
|
|
|
|
|
|
|
С* |
|
|
*С |
||
Н |
|
ОН |
|
НО |
|
Н |
|
|
СН3 |
|
|
СН3 |
|
|
|
зеркало |
||||
|
|
|
|
|
||
С помощью проекционных формул Фишера строение оптических антиподов молочной кислоты изображается так:
|
COOH |
|
COOH |
||||
H |
|
|
OH |
HО |
|
|
H |
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
CH3 |
|
CH3 |
||||
Асимметрический атом углерода (С*) в формулах Фишера расположен в точке пересечения вертикальной и горизонтальной линий и обычно не обозначается символом. Один изомер вращает луч поляризованного света в одну сторону на угол , второй – в противоположную сторону, но на тот же угол . Если смешать равные количества двух оптических изомеров (в соотношении 50/50) и поместить их в кювету, то вращение луча поляризованного света не наблюдается, так как левовращающий изомер компенсирует действие правовращающего. Смесь 50/50 двух оптических изомеров называется рацемической смесью.
10.1.2. СПОСОБЫ ПОЛУЧЕНИЯ АЛИФАТИЧЕСКИХ ОКСИКАРБОНОВЫХ КИСЛОТ
10.1.2.1. ПОЛУЧЕНИЕ α-ОКСИКАРБОНОВЫХ КИСЛОТ
Из альдегидов или кетонов через нитрилы оксикислот. При взаимодействии альдегидов или кетонов с цианистоводородной кислотой образуются нитрилы α-оксикислот, гидролизом которых получают α- оксикислоты. Причѐм из линейных альдегидов получают линейные, а из любых кетонов – разветвлѐнные оксикислоты:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
O |
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
HCl |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
R |
|
|
|
CH |
|
|
|
|
C |
|
|
|
|
+ NH4Cl |
|||||||||||||
R |
|
|
O |
HCN |
|
|
|
|
|
2H2O |
|
|
|
|
|
|
|
|
|
OH |
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
C |
R |
|
|
C |
|
|
|
N |
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
H |
|
|
|
|
|
|
|
|
NaOH |
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ NH4OH |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R |
|
|
|
|
CH |
|
|
|
|
|
C |
|
|
|
|
|
|
|||||||||||
альдегид |
|
|
нитрил линейной |
|
|
|
|
|
|
|
|
|
|
O Na+ |
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
оксикарбоновой |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|||||||||||
|
|
|
|
|
|
|
|
|
кислоты |
|
|
|
|
|
|
|
|
|
|
|
HCl |
|
|
|
|
|
O |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH |
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R |
|
|
C OH |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
- NaCl |
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
линейная 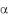 оксикарбоновая кислота
оксикарбоновая кислота
214

|
|
O |
|
|
|
OH |
|
|
|
|
OH |
O |
|
||||||||||||||
R |
|
|
|
|
|
R' |
HCN |
|
|
|
|
|
C |
|
|
|
|
2H2O; HCl |
|
|
|
|
|
|
|
||
|
C |
|
R |
|
C |
|
|
|
N |
|
R |
|
C |
|
C |
+ NH4Cl |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
R' |
|
|
|
|
R' |
|
|
||||||||||
|
кетон |
|
нитрил разветвлѐнной |
|
|
|
разветвлѐнная |
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
оксикарбоновой кислоты |
|
|
оксикарбоновая кислота |
|
|||||||||||||||
Гидролиз α-галогенкарбоновых кислот. При кипячении с водой или под действием водных растворов щелочей галоген в α-галогенкарбоновых кислотах замещается гидроксильной группой:
|
|
|
|
Cl |
O |
|
|
|
|
|
OH |
O |
|||||
|
|
|
|
|
|
|
|
H2O |
|
|
|
|
|
|
|
||
CH3 |
|
CH2 |
|
CН |
|
C OH |
CH3 |
|
CH2 |
|
CН |
|
C OH |
||||
|
|
|
- HCl |
|
|
|
|||||||||||
2-хлорбутановая кислота |
|
|
2-гидроксибутановая кислота |
||||||||||||||
Неполное окисление -гликолей. -Гликоли, содержащие одну ОН-
группу у первичного атома углерода, могут быть окислены до α-оксикислот:
|
|
|
|
|
[ O ] |
|
|
|
|
O |
[ O ] |
|
|
O |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
CH2 |
|
|
CH2 |
|
|
CH2 |
|
C |
|
|
|
CH2 |
|
C |
OH |
|
|
|
|
- Н2О |
|
H |
|
|
||||||||||
OH |
|
OH |
|
|
|
|
|
OH |
|
|
|||||||
|
|
|
OH |
|
|
|
|
|
|
|
|
||||||
этиленгликоль |
|
|
гликолевый альдегид |
|
гликолевая кислота |
||||||||||||
10.1.2.2. ПОЛУЧЕНИЕ β-ОКСИКАРБОНОВЫХ КИСЛОТ
По реакции Реформатского. При взаимодействии альдегидов или кетонов со сложными эфирами α-галогенкарбоновых кислот в присутствии цинка образуются β-оксикарбоновые кислоты:
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
OZnBr |
|
|
O |
||||
R |
|
C |
|
|
|
|
|
|
CH2 |
|
|
|
|
|
|
Zn |
R |
|
|
|
|
|
|
|
||||||
|
H |
+ |
Br |
|
|
|
|
C |
OC2H5 |
|
|
C |
|
CH2 |
|
C |
OC2H5 |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
альдегид |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|||||||||||
|
|
|
|
этиловый эфир |
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
бромуксусной кислоты |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
OН |
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
2 H2O |
R |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
C |
|
|
CH2 |
|
|
C OH |
+ |
ZnOHBr + C2H5OH |
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
оксикарбоновая кислота |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
OZnBr |
|
|
O |
||||||||
R |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH2 |
|
|
|
|
|
|
Zn |
R |
|
|
|
|
|
|
|
|||
|
|
C |
|
R' + |
|
Br |
|
|
|
|
C |
OC2H5 |
|
|
C |
|
CH2 |
|
C |
OC2H5 |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R' |
|
|
||||||
|
кетон |
|
|
|
|
этиловый эфир |
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
бромуксусной кислоты |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
OН |
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
2 H2O |
R |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
C |
|
|
CH2 |
|
|
C OH |
+ |
ZnOHBr + C2H5OH |
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
R' |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
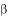 оксикарбоновая кислота (разветвлѐнная)
оксикарбоновая кислота (разветвлѐнная)
215

Эта реакция характерна также для ароматических альдегидов:
|
|
|
|
|
|
C |
O |
|
+ Br |
|
CH2 |
|
|
|
|
|
O |
Zn |
|
|
|
|
|
|
OZnBr |
|
|
O |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
H |
|
|
|
C |
OC2H5 |
|
|
|
|
|
|
C |
|
CH2 |
|
C |
OC2H5 |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
бензальдегид |
|
|
|
|
|
|
этиловый эфир |
|
|
|
|
|
|
|
H |
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
бромуксусной кислоты |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
2 H2O |
|
|
|
|
|
|
OН |
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
CН |
|
|
|
CH2 |
|
|
|
C OH |
+ |
ZnOHBr + |
C2H5OH |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
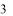 гидрокси-3-фенилпропановая кислота
гидрокси-3-фенилпропановая кислота
Гидратация α,β-ненасыщенных карбоновых кислот. α,β-
Ненасыщенные карбоновые кислоты присоединяют воду в присутствии минеральных кислот. Направление присоединения определяется здесь влиянием карбоксильной группы на поляризацию двойной связи и осуществляется против правила Марковникова:
O
CH2 CН C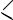 OH + H OН
OH + H OН
пропеновая кислота (акриловая кислота)
|
OH |
|
|
|
O |
|
H2SO4 |
|
|
|
|
|
|
|
|
|
|
|
||
|
CH2 |
|
CН2 |
|
C OH |
|
|
|
|
||||
3-гидроксипропановая кислота
10.1.3. ХИМИЧЕСКИЕ СВОЙСТВА АЛИФАТИЧЕСКИХ ОКСИКАРБОНОВЫХ КИСЛОТ
Химические свойства оксикарбоновых кислот определяются в основном наличием в их молекулах карбоксильных и гидроксильных групп. Поэтому оксикислоты дают все реакции, свойственные карбоновым кислотам и спиртам, причѐм в некоторые из них одновременно могут вступать и СООН и ОНгруппа. Имеют место также специфические химические свойства алифатических оксикарбоновых кислот, обусловленные взаимным влиянием карбоксильной и гидроксильной групп.
Диссоциация. Оксикарбоновые кислоты, как правило, являются более сильными кислотами, чем незамещѐнные кислоты с тем же числом атомов углерода. Это обусловлено электроноакцепторным влиянием ОН-группы. Так, гидроксиэтановая кислота (рКа=3,83) более сильная, чем этановая (рКа=4,76):
OH |
|
|
|
OH |
|
|
|
||||||||
|
|
|
O |
|
|
|
|
|
|
|
O |
+ H+ |
|||
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH2 C O |
|
H |
|
|
|
CH2 C |
|
|
|||||||
|
|
|
|
O |
|||||||||||
|
|
|
|
|
|||||||||||
гидроксиэтановая кислота |
|
|
|
|
|
|
|
|
|
|
|||||
(гликолевая кислота) |
|
|
|
|
|
|
|
|
|
|
|||||
216

|
|
O |
|
|
|
|
|
|
O |
+ H+ |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 C O |
|
H |
|
|
|
CH3 C |
|
|
|||||
|
|
|
|
O |
|||||||||
|
|
|
|
|
|||||||||
этановая кислота |
|
|
|
|
|
|
|
|
|
||||
(уксусная кислота) |
|
|
|
|
|
|
|
|
|
||||
Влияние гидроксила на карбоксильную группу в оксикислоте передается по индуктивному эффекту и быстро затухает по цепи атомов углерода, поэтому чем ближе спиртовый гидроксил находится к карбоксильной группе, тем сильнее оксикислота. Таким образом, -оксикислоты сильнее, чем - оксикислоты с тем же числом углеродных атомов.
Образование солей. При взаимодействии со щелочами оксикарбоновые кислоты в первую очередь превращаются в соли кислот, а затем могут образовываться и алкоголяты:
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
Na+ |
|
|
|
||||||
|
|
O |
|
OH |
|
O |
|
|
O |
O |
|||||||||||||
|
|
|
|
NaOH |
|
|
|
|
|
NaOH |
|
|
|
|
|
|
|||||||
CH2 |
|
C |
|
CH2 |
|
C |
|
|
|
+ |
CH2 |
|
C |
|
|
+ |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
OH - H2O |
|
|
|
|
|
|
|
|
||||||||||||||
O Na |
- H2O |
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O Na |
||||||||
гликолевая кислота |
|
гликолевокислый |
|
|
|
|
динатриевая соль |
||||||||||||||||
|
|
|
|
|
|
|
натрий |
|
|
|
|
|
гликолевой кислоты |
||||||||||
Образование эфиров. Оксикарбоновые кислоты при нагревании в присутствии кислотного катализатора реагируют со спиртами, образуя
сложные эфиры по СООН-группе (реакция этерификации):
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
||||
|
|
|
|
|
|
O |
|
|
|
H2SO4 |
|
|
|
O |
+ |
H2O |
|||||||
R |
|
CH |
|
C |
OH |
+ R' |
|
OH |
|
|
|
R |
|
CH |
|
C |
O |
|
R' |
||||
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
эфир I |
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Дальнейшее нагревание со спиртом и H2SO4 может привести к образованию смешанного эфира (сложного по СООН и простого по ОНгруппе):
|
|
OH |
|
|
O |
|
|
|
|
|
H2SO4 |
|
|
O |
|
R' |
O |
+ |
H2O |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
R |
|
CH |
|
C |
|
|
+ R' |
|
OH |
R |
|
CH |
|
|
C |
|||||||||||
|
|
O |
|
R' |
|
|
|
|
|
|
O |
|
R' |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
эфир II |
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
При гидролизе эфира II расщепляется сложноэфирная остаѐтся простой эфир оксикислоты:
|
|
O |
|
|
R' |
O |
|
|
|
|
H2SO4 |
|
|
O |
|
|
R' |
O |
|||||
|
|
|
|
|
|
|
|
||||||||||||||||
R |
|
|
|
|
|
|
C |
|
|
+ H2O |
|
R |
|
|
|
|
|
|
C |
||||
|
CH |
|
|
|
|
CH |
|
||||||||||||||||
|
|
O |
|
R' |
|
|
|
|
|
OH |
|||||||||||||
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
эфир II |
|
|
|
|
|
|
|
эфир III |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
группировка и
+ R' OH
Ацилированием оксикислоты получают сложный эфир по ОН-группе:
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
|
R' |
|
|
||
|
|
OH |
|
O |
|
|
|
O |
|
|
|
O |
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
+ |
HCl |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
R CH |
|
C OH + |
R' C |
Cl |
|
R CH |
|
|
|
C |
OH |
|||||||||||||
|
|
|
|
|
|
|
||||||||||||||||||
эфир IV
217

Ацилированием эфира I получают дважды сложный эфир (и по СООН, и по ОН-группе):
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|||
|
|
OH |
|
O |
|
R |
|
C |
O |
|
|
|
O |
|
|
C |
|
R |
O |
+ |
HCl |
||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
R |
|
CH |
|
C O |
|
R' |
+ |
|
Cl |
|
R |
|
CH |
|
|
|
C |
O |
|
R' |
|||||||||
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
эфир I |
|
|
|
|
|
|
|
эфир V |
|
|
|
|
|
|||||||||||||||
Таким образом, оксикислоты могут дать 5 видов эфиров.
Образование амидов. При взаимодействии оксикарбоновых кислот с аммиаком образуются аммониевые соли оксикислот, которые при нагревании в сухом виде отщепляют воду и превращаются в амиды оксикарбоновых кислот:
|
|
OH |
|
O |
|
|
|
|
OH |
|
O |
|
|
|
|
|
OH |
O |
|
||||
|
|
|
|
|
NH3 |
|
|
|
|
|
|
t |
|
|
|
|
|
|
|
||||
R |
|
CH |
|
C OH |
R |
|
CH |
|
C O- NH4+ |
|
R |
|
CH |
|
C NH2 |
||||||||
|
|
|
|
|
|
|
- H2O |
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||||||
оксикарбоновая кислота |
|
|
|
аммониевая соль |
|
|
|
|
|
|
амид |
|
|
||||||||||
|
|
|
|
|
|
|
|
оксикарбоновой кислоты |
|
|
|
оксикарбоновой кислоты |
|||||||||||
|
|
|
Взаимодействие с PCl5, PCl3, SOCl2, SO2Cl2. Под действием галогенидов |
||||||||||||||||||||
фосфора (III) или фосфора (V), а также |
тионилхлорида SOCl2 |
и |
|||||||||||||||||||||
сульфурилхлорида |
|
SO2Cl2 в молекуле оксикислоты |
и спиртовый, |
и |
|||||||||||||||||||
карбоксильный гидроксилы замещаются галогенами с образованием галогенангидридов галогенкарбоновых кислот:
|
|
OH |
|
O |
|
|
|
Cl |
|
O |
||
|
|
|
|
|
|
|
|
|
|
|
||
R |
|
CH |
|
C OH + 2PCl5 |
|
R |
|
CH |
|
C Cl + 2HCl + 2POCl3 |
||
|
|
|
|
|
||||||||
Взаимодействие с галогеноводородами. Под действием галогеноводородов в молекуле оксикислоты замещается галогеном лишь спиртовый гидроксил и образуются галогенкарбоновые кислоты:
|
|
OH |
|
|
O |
|
|
|
|
Cl |
O |
|
||||
|
|
|
|
|
|
+ HCl |
|
|
|
|
|
|
|
|
||
R |
|
CH |
|
C |
OH |
|
R |
|
CH |
|
C |
OH |
+ H2O |
|||
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Окисление оксикарбоновых кислот. Оксикарбоновые кислоты,
содержащие первичную спиртовую группу, при окислении превращаются в альдегидокислоты, остальные – в кетонокислоты. Альдегидная группа далее может окислиться до карбоксильной:
OH |
|
O |
|
О |
|
|
O |
|
|
|
O |
|
О |
|
O |
|
|
|
O |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
CH2 |
|
C |
C |
|
C |
C |
|
C |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
OH - H2O |
H |
|
OH |
|
|
|
НO |
|
OH |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
гликолевая кислота |
|
|
|
|
глиоксалевая кислота |
|
|
|
щавелевая кислота |
||||||||||||
|
|
|
|
|
|
|
|
|
(альдегидокислота) |
|
|
|
|
|
|
|
|
||||
218
|
|
OH |
|
|
O |
|
|
|
|
|
O |
|
|
O |
|
|||
|
|
|
|
|
|
|
О |
|
|
|
|
|
|
|
|
|
||
R |
|
CH |
|
C |
OH |
|
|
|
R |
|
C |
|
C |
OH |
+ H2O |
|||
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
кетонокислота
Восстановление α-оксикарбоновых кислот. α-Оксикарбоновые кислоты легко восстанавливаются в карбоновые кислоты, например, при действии йодистого водорода:
|
|
OH |
|
|
O |
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ I2 + H2O |
||
R |
|
CH |
|
C |
OH |
+ 2 HI |
|
R |
|
CH2 |
|
C |
OH |
||
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
оксикислота |
|
|
карбоновая кислота |
|
|||||||||
Помимо перечисленных алифатические оксикарбоновые кислоты имеют ряд специфических химических свойств.
Расщепление -оксикислот. При нагревании в присутствии концентрированной серной кислоты α-оксикислоты расщепляются с образованием карбонильного соединения (альдегида или кетона) и муравьиной кислоты, которая в условиях реакции распадается на оксид углерода (II) и воду:
O
 H O
H O
RC  C
C OH
OH  H
H 









H2SO4 |
|
|
O |
+ |
|
|
O |
tо |
R C H |
H |
|
C OH |
|||
|
|
|
|
|
|
|
|
|
альдегид |
|
|
|
|||
|
|
|
|
|
|||
|
|
|
|
|
CО |
|
H2О |
|
|
O |
|
|
|
H |
O |
H2SO4 |
|
|
O |
+ |
H |
|
O |
|||||
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
R C R' |
||||||||||||
R C C OH |
tо |
|
C OH |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
кетон |
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
R' |
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CО |
|
H2О |
Дегидратация оксикислот. Эта реакция позволяет различить α-, β-, γ- оксикислоты.
-Оксикарбоновые кислоты. В реакцию вступают две молекулы α- оксикислоты, отщепляются две молекулы воды (межмолекулярная дегидратация) с образованием шестичленного циклического сложного эфира,
лактида:
R |
|
|
CH |
|
|
C |
O |
|
|
R |
|
CH |
|
|
C |
O |
|
|||||||
|
|
|
|
OH |
t |
o |
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||||||
OH OH |
|
|
|
|
O |
|
|
|
|
O |
+ |
2 H O |
||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|||||||||||
НO |
|
|
|
|
|
O C |
|
|
CH |
|
|
R |
|
|||||||||||
O |
|
C |
|
|
CH |
|
R |
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
оксикислота |
|
|
|
|
|
лактид |
|
|
|
|||||||||||||
-Оксикарбоновые кислоты. При нагревании -оксикарбоновые кислоты подвергаются внутримолекулярной дегидратации с образованием α,β- ненасыщенных кислот:
219

|
|
OH |
|
|
|
|
|
O |
to |
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ H2O |
|||
R |
|
CH |
|
CН |
2 |
|
C |
R |
|
CH |
|
CН |
|
C |
|||||
|
|
|
OH |
|
|
|
|
OH |
|||||||||||
|
|
|
|
|
|
|
|||||||||||||
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
оксикислота |
|
|
, ненасыщенная кислота |
|
||||||||||||
- и -Оксикарбоновые кислоты. Уже при комнатной температуре происходит внутримолекулярная дегидратация - и -оксикарбоновых кислот с образованием циклических сложных эфиров – лактонов:
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
CН2 |
CН R |
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
R CH CН2 CН2 C OH |
|
|
|
|
|
|
|
+ |
H2O |
||||||||||||
|
CН2 |
|
|
C |
O |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
оксикислота |
|
|
лактон |
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
10.1.4. ОТДЕЛЬНЫЕ ПРЕДСТАВИТЕЛИ АЛИФАТИЧЕСКИХ ОКСИКАРБОНОВЫХ КИСЛОТ
Г л и к о л е в а я к и с л о т а (гидроксиэтановая кислота, OH
оксиуксусная кислота) CH2 CООН .
Впервые получена окислением этиленгликоля – отсюда тривиальное название. Содержится в незрелом винограде, свекловичном соке. В промышленности ее получают электролитическим восстановлением щавелевой кислоты на свинцовых электродах или омылением хлоруксусной кислоты и еѐ солей при длительном кипячении с водой в присутствии порошка мрамора:
OH
|
|
|
|
|
|
|
|
4 |
Н |
|
|
|
|
|
|
|
|
|
|
|
||||
НООС |
|
CООН |
|
CH2 |
|
|
CООН + |
H2O |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
щавелевая кислота |
|
|
|
|
|
|
|
|
|
|
|
гликолевая кислота |
|
|||||||||||
Cl |
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
CH2 |
|
CООН + H2O |
|
|
|
|
CH2 |
|
|
CООН + |
НCl |
|||||||||||||
|
|
|
|
|
||||||||||||||||||||
хлоруксусная кислота |
|
|
|
|
|
|
|
|
|
гликолевая кислота |
|
|||||||||||||
Cl |
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
CH2 |
|
CООК + H2O |
|
|
|
|
CH2 |
|
|
CООН + |
КCl |
|||||||||||||
|
|
|
|
|
||||||||||||||||||||
|
калиевая соль |
|
|
|
|
|
|
|
|
|
|
|
гликолевая кислота |
|
||||||||||
хлоруксусной кислоты |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
М о л о ч н а я |
к и с л о т а |
(2-гидроксипропановая кислота, - |
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
* |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
оксипропионовая кислота) |
CH3 |
|
CH |
|
CООН . |
|
||||||||||||||||||
Открыта Шееле в 1780 г. в кислом молоке. Молочная кислота содержит один асимметрический атом углерода, поэтому она существует в виде двух оптически активных энантиомеров и оптически неактивной рацемической формы:
220

|
COOH |
|
COOH |
|
||||
H |
|
|
OH |
HО |
|
|
H |
D + L = r |
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
CH3 |
|
CH3 |
|
||||
D ( )-молочная кислота |
L (+)-молочная кислота |
(+)-молочная кислота |
||||||
L (+)-Молочная кислота содержится в кислой капусте, соленых огурцах и др. (образуется при закисании некоторых продуктов). Закисание этих продуктов вызывается жизнедеятельностью молочнокислых бактерий, попадающих из воздуха и вызывающих молочнокислое брожение сахаристых веществ, например, глюкозы:
|
|
|
|
OH |
|||
C6H12O6 |
молочнокислое брожение |
|
|||||
|
2 CH3 |
|
CH |
|
CООН |
||
|
|
|
|||||
Молочная кислота обладает бактерицидным действием, очень гигроскопична, поэтому ее 80%-ный раствор применяют в медицине для прижиганий. Используется также в текстильном производстве и кожевенной промышленности. При интенсивной физической работе молочная кислота накапливается в мышцах, давая характерную боль. Соли и сложные эфиры молочной кислоты называют лактатами. Лактаты кальция и железа (II) применяются в качестве лекарственных препаратов при недостатке в организме кальция и железа соответственно.
Я б л о ч н а я к и с л о т а (гидроксибутандиовая кислота,
OH
оксиянтарная кислота) CH2 * .
НООС CH CООН
Впервые выделена Шееле в 1785 г. из яблок. Яблочная кислота содержит один асимметрический атом углерода, поэтому она существует в виде двух оптически активных энантиомеров и оптически неактивной рацемической формы:
|
COOH |
|
COOH |
|
||||
H |
|
|
OH |
HО |
|
|
H |
D + L = r |
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
CH2СООН |
|
CH2СООН |
|
||||
D (+)-яблочная кислота |
L ( |
)-яблочная кислота |
(+)-яблочная кислота |
|||||
В природе встречается L(–)-яблочная кислота. Она содержится в незрелых яблоках, в ягодах рябины, клюквы, малины, барбариса и др. Плоды рябины и барбариса используются для ее получения. В промышленности широко применяется L(–)-яблочная кислота в производстве вина, фруктовых вод и кондитерских изделий. В медицине еѐ применяют как составную часть слабительных средств и препаратов от хрипоты.
221
