
- •Глава 21. Теоретические представления химической кинетики
- •21.1. Элементарная теория активных столкновений для бимолекулярных реакций
- •21.2. Мономолекулярные реакции
- •21.3. Теория активированного комплекса (переходного состояния)
- •21.3.1. Поверхность потенциальной энергии
- •21.3.2. Основное уравнение теории активированного комплекса
- •21.3.3. Свободная энергия активации
- •21.3.4. Сравнение теорий активных столкновений и переходного состояния
- •21.4. Реакции в растворах
21.3. Теория активированного комплекса (переходного состояния)
В основе теории лежит представление о том, что в ходе химической реакции начальная конфигурация атомов в реагирующих молекулах переходит в конечную путем непрерывного изменения межатомных расстояний.
Рассмотрим простой случай реакции между атомом А и двухатомной молекулой ВС:
А + ВС АВ + С
Реакция проходит с наименьшей затратой энергии, если атомы расположены на одной линии, а ход реакции можно описать, используя два межатомных расстояния r1иr2:
А + В–CА ------- В ---------CА–В+C
|r1|r2 | |
![]() |
|
![]() |
|
|
|
![]() |
|![]() |
|
В процессе реакции расстояние r1уменьшается, аr2увеличивается, при этом образуется промежуточная конфигурация А---В---С, в которой связь В–С ослаблена, но окончательно не разорвана, а связь А–В начала образовываться. Такая конфигурация и получила названиепереходного состояния(Поляни и Эванс), илиактивированного комплекса(Эйринг, 1935). Активированный комплекс мгновенно разлагается, поэтому нельзя считать, что это хотя и неустойчивая, но все же в принципе доступная для выделения промежуточная форма. В теории постулируется, что активированный комплекс всегда превращается в конечные вещества, т.е. атомы, достигнув конфигурации активированного комплекса, продолжают двигаться по инерции в направлении образования продуктов реакции.
21.3.1. Поверхность потенциальной энергии
При изменении межатомных расстояний изменяется и потенциальная энергия системы U. В принципе возможен полный теоретический расчет функцииU=f(r1,r2), однако ввиду очень больших трудностей, применяются полуэмпирические методы с использованием аппарата статистической механики. Вычисленные значенияUможно представить в виде поверхности потенциальной энергии (рис. 21.3). Построение таких диаграмм сложно и обычно пользуются изображениями проекций изоэнергетических сечений на плоскостьr1–r2(рис. 21.4). Каждая линия на графике отвечает определенному уровню энергии в зависимости от межатомных расстояний, числа показывают условные величины этих энергий.
Рис. 21.3. Поверхность
потенциальной энергии
Рис.21.4. Проекция
поверхности
потенциальной энергии
Рис. 21.5. Энергетический
профиль пути реакции
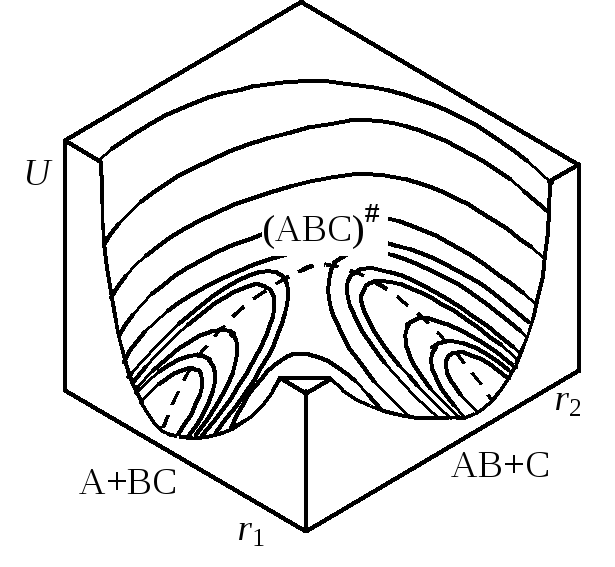


Если разрезать поверхность потенциальной энергии вдоль пути реакции перпендикулярно плоскости r1–r2и развернуть поверхность сечения в одну плоскость, то получим кривую сечения, имеющую максимум, которую называютпрофилем пути реакции(рис. 21.5). Точка максимума, как говорилось выше, отвечает переходному состоянию А--В--С, а высотаEпредставляет энергию активации – разность между потенциальной энергией активированного комплекса и начальных продуктов, т.е. ту энергию, которой должны обладать частицы, чтобы преодолеть потенциальный барьер и образовать продукты реакции.
Для обратной реакции АВ + С А + ВС конфигурация активированного комплекса та же, что и для прямой, но путь реакции проходит в противоположном направлении с энергией активацииE2. Разность энергий активации прямой и обратной реакции представляет собой тепловой эффект реакции:
E=E2–E1=H
