
Пример 1. 100 дм3 газа, находящегося под давлением 506,5 кПа, сжали до объема 40 дм3 при постоянной температуре. Каково давление сжатого газа?
Решение. По закону Бойля-Мариотта (выражение (1.14)):
![]()
Тогда 506,5 кПа*100 дм3 = р240 дм3. Вычислим р2 = 1266250 Па = 1,27МПа.
Ответ: 1,27 МПа.
Пример 2. 100 дм3 газа нагрели от 204 К до 353 К. Во сколько раз увеличился объем, если давление не изменилось?
Решение. По закону Гей-Люссака (выражение (1.16)):
![]() .
.
Значит,
объем увеличился в
![]() =
1,2 раза.
=
1,2 раза.
Ответ: объем смеси увеличился в 1,2 раза.
Пример 3. Газ при температуре 303 К и давлении 1,8-10s Па занимает объем 1 м3. Каким будет его объем при н. у.?
Решение. Из объединенного газового закона (выражение (1.18)) следует:
![]() .
.
где ро, Vо, То - значения параметров при н. у.;
р1 V1, Т1 - в реальных условиях.
Тогда
![]() .
.
Ответ: 1,6 м3.
Пример 4. Вычислите массу аммиака в баллоне емкостью 1,2 дм3 при температуре 300 К и давлении 244,5 кПа.
Решение. W(NH3) = 17 г/моль.
Из уравнения Менделеева-Клапейрона (выражение (1.20)) следует:

Ответ: 2 г.
Пример 5. Рассчитайте плотность азота при давлении 506,5 кПа и температуре 343 К.
Решение. М(N2) = 28 г/моль.
Из уравнения Менделеева-Клапейрона (выражение (1.20)) следует:
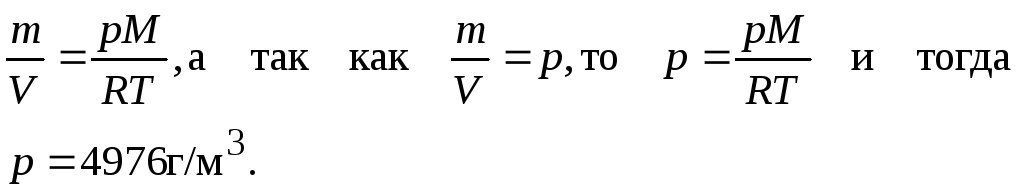
Ответ: 4976 г/м3.
Уравнение Менделеева-Клапейрона можно использовать для расчета параметров не только индивидуальных газов, но и газовых смесей.
Пример 6. Рассчитайте массовые и объемные доли газов СО2 и N2 в смеси, если при температуре 313 К и давлении 405,3 кПа смесь объемом 5 дм3 имеет массу 31,15г.
Решение. р = 31,15 г/5 дм3 = 6,23 г/дм3.
М(СО2) = 44 г/моль, М(N2) = 28 г/молъ.
По уравнению Менделеева-Клапейрона (выражение (1.20)) найдем среднюю молярную массу газовой смеси:
![]()
Если в смеси количеством 1 моль находится х моль СО2, то содержание N2 (1 -д:) моль. Тогда х • 44 + (l - х)• 28 = 40, х = 0,75.
Значит, мольные доли газов соответственно равны: х(СО2) = 0,75 (75 %) и х (N2) = 0,25 (25 %).
Объемные доли имеют те же значения.
Масса СО2 в 1 моль смеси 0,75 моль44 г/молъ = 33 г, а масса N2 -0,25 моль28 г/моль = 7 г. Значит,
![]()
Ответ: w(СО2) = 0,825; (СО2) = 0,75; w(N2) = 0,175; (N2) = 0,25.
Пример 7. Вычислите относительную плотность пропана по водороду и воздуху.
Решение. М(СзН8) = 44 г/моль.
![]() .
.
Ответ: относительная плотность пропана по водороду равна 22, по воздуху - 1,52.
Пример 8. Массовые доли газов СН4 и СО в смеси равны 16 % и 84 % соответственно. Определите плотность смеси по оксиду углерода (IV).
Решение. М(СН4) = 16 г/моль, М(СО) = 28 г/моль.
В 100 г
смеси находится 16 г СН4
и 84 г СО. Количества газов n(CH4
)=![]() = 1 моль и n(СО)
=
= 1 моль и n(СО)
=![]() =
3 моль.
=
3 моль.
Масса (1 + 3) моль газовой смеси равна 100 г,
1 моль - х г.
Откуда
х=![]() =
25 г.
=
25 г.
4 моль
Это масса 1 моль, значит, М = 25 г/моль.
И тогда Dсо2
=![]() = 0,57
= 0,57
Задачу
можно было решить иначе, используя
формулу D
=![]()
(напомним, что mt и т2 - массы равных объемов, а, следовательно, равных количеств газов).
100 г смеси содержат 4 моль газов. Масса 4 моль СО2 равна 4 моль44 г/моль = 176 г. Тогда
![]()
Ответ: 0,57.
Пример 1. Определите тепловой эффект реакции получения водорода из природного газа:
СН4 + 2Н2О (г) = СО2 + 4Н2.
Решение. rН°=/НCОг -fHCH4 -2fH0H2O
Подставляя значения величин энтальпий образования (приложение Б) (в кДж/моль), получаем:
rН° = 1 моль(-393,51 кДж/моль)- 1 моль(-74,85 кДж/моль)-
- 2 моль (241,82 кДж/моль) = 164,98 кДж.
Ответ: rН° = 164,98 кДж.
Можно также рассчитать значение энтальпии образования одного из исходных веществ или продуктов реакции, если известны энтальпии образования остальных реагентов и энтальпия химической реакции. Например, энтальпию образования вещества М в уравнении (2.13) можно определить по видоизмененному уравнению (2.14):
fH°M=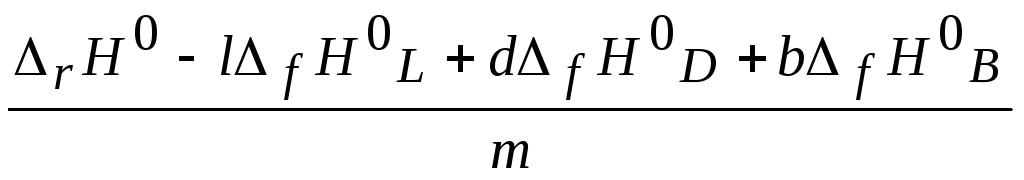 .
.
Пример 2. Рассчитайте стандартную энтальпию образования пропана С3Н8, если стандартная энтальпия реакции его сгорания равна rН° = -2043,86 кДж.
Решение. С3Н8 + 5О2 = ЗСО2 + 4Н2О (г).
В соответствии с уравнением (2.14) запишем:
fН°C3H4=3/НCОг +4fHH2O® -rH0.
Подставив значение fН° и справочные данные из приложения Б, получим:
fН°C3H4=3моль (-393,51 кДж/моль) +
+ 4 моль (- 241,82 кДж/моль) - (2043,86 кДж)/ моль =
= -103,85 кДж/моль.
Ответ: fН°C3H4 =-103,85 кДж/моль.
Пример 3. Рассчитайте теплоту сгорания этанола при температуре 298 К:
Решение. С2Н5ОН (ж) + ЗО2 = 2СО2 + ЗН2О (г).
В соответствии с уравнением (2.14):
СН°C2Н5ОН=2fН°CО2+3fН°Н2О®-fН°C2Н5ОН Подставляя данные fН°из приложения Б, получаем стандартную теплоту сгорания этанола:
Ответ: СН°с2н5он =-1234,7 кДж
Пример 4. Рассчитайте энтропию реакции CH4 + Н2О = СО + ЗН2 при стандартных состояниях реагентов и продуктов процесса. Решение. В соответствии с уравнением (2.15) запишем:
rS°= S0CO+3S0H2-S0CH4-S0H2O® = 1 моль• 197,54 Дж/моль • К + 3 моль • 130,58 Дж/моль • К -1 моль • 186,19 Дж/моль • К -1 моль • 188,7 Дж/моль • К = 214,39Дж/К.
Ответ: rS° = 214,39 Дж/К.
Пример 5- Определите, возможно ли самопроизвольное протекание реакции СаО (т) + СО2 (г) = CaCO3 (т) при стандартных условиях.
Решение. Воспользуемся уравнением (2.14):
rH°=fH°CaCO3-fH°CaO-fH°CO2 =-178,8кДж.
Воспользуемся уравнением (2.15):
rS0 = S0CaCO3 - S0CaO - S°C02 = -160,6 Дж/К.
Воспользуемся уравнением (2.17):
rG°298 = rH°298 - 298rS0298 = -130,24 кДж.
Ответ: для стандартного состояния (р = 100 кПа и Т = 298 К) данная реакция возможна. При высоких температурах, когда |rH°|<| TrS0|, энергия Гиббса реакции станет положительной и реакция становится невозможной в прямом направлении.
Пример 1. В сосуде смешали хлор и водород. Смесь нагрели. Через 5 с концентрация хлороводорода в сосуде стала равной 0,05 моль/дм3. Определите среднюю скорость образования хлороволорода (моль/дм3 с).
Решение. Определяем изменение концентрации хлороводорода в сосуде через 5 с после начала реакции:
с(HCl)=c2-c1,
где с2, с1 - конечная и начальная молярная концентрация HСl.
с (НСl) = 0,05 - 0 = 0,05 моль/дм3.
Рассчитаем среднюю скорость образования хлороводорода, используя уравнение (3.1):
![]()
Ответ: 7 = 0,01 моль/дм3 с.
Пример 2. В сосуде объемом 3 дм3 протекает реакция:
C2H2 + 2H2C2H6.
Исходная масса водорода равна 1 г. Через 2 с после начала реакции масса водорода стала равной 0,4 г. Определите среднюю скорость образования С2Н6 (моль/дм'с).
Решение. Масса водорода, вступившего в реакцию (mпрор (H2)), равна разнице между исходной массой водорода (mисх (Н2)) и конечной массой непрореагировавшего водорода (тк (Н2)):
тпрор.(Н2)= тисх (Н2)-mк(Н2); тпрор (Н2)= 1-0,4 = 0,6 г.
Рассчитаем количество водорода:
![]() =
0,3 моль.
=
0,3 моль.
Определяем количество образовавшегося С2Н6:
-
по уравнению: из 2 моль Н2 образуется 1 моль С2Н6;
-
по условию: из 0,3 моль Н2 образуется х моль С2Н6.
![]() ;
;
 n(С2Н6)
= 0,15 моль.
n(С2Н6)
= 0,15 моль.
Вычисляем концентрацию образовавшегося С2Н6:
![]()
Находим изменение концентрации С2Н6:
![]() 0,05-0
= 0,05 моль/дм3.
Рассчитаем среднюю скорость образования
С2Н6, используя уравнение (3.1):
0,05-0
= 0,05 моль/дм3.
Рассчитаем среднюю скорость образования
С2Н6, используя уравнение (3.1):
![]() .
.
Ответ:
![]() =0,025 моль/дм3
с.
=0,025 моль/дм3
с.
Пример 3. Написать кинетическое уравнение закона действия масс для реакции:
2NO (г) + С12 (г) = 2NOCl (г).
Решение. Уравнение (3.5) для данной химической реакции имеет :ледующий вид:
![]() .
.
Для гетерогенных химических реакций в уравнение закона действующих масс входят концентрации только тех веществ, которые находятся в газовой или жидкой фазах. Концентрация вещества, находящегося в твердой фазе, обычно постоянна и входит в константу скорости.
Пример 4. Написать кинетическое уравнение закона действия масс для реакций:
a)4Fe(т) + 3O2(г) = 2Fe2O3(т);
б) СаСОз (т) = СаО (т) + СО2 (г).
Решение. Уравнение (3.5) для данных реакций будет иметь следующий вид:
a)![]() 6)
6)![]()
Поскольку карбонат кальция - твердое вещество, концентрация которого не изменяется в ходе реакции, т. е. в данном случае скорость реакции при определенной температуре постоянна.
Пример 5. Во сколько раз увеличится скорость реакции окисления оксида азота (II) кислородом, если концентрации реагентов увеличить в два раза?
Решение. Записываем уравнение реакции:
2NO + О2= 2NO2.
Обозначим начальные и конечные концентрации реагентов соответственно с1(NO), cl(O2) и c2(NO), c2(O2). Точно так же обозначим начальную и конечную скорости реакций: vt, v2. Тогда, используя уравнение (3.5), получим:
![]() .
.
По условию с2(NO) = 2c1 (NO), с2(О2) =2с1(О2).
Находим v2 =к[2c1(NO)]2 2cl(O2).
Находим, во сколько раз увеличится скорость реакции:
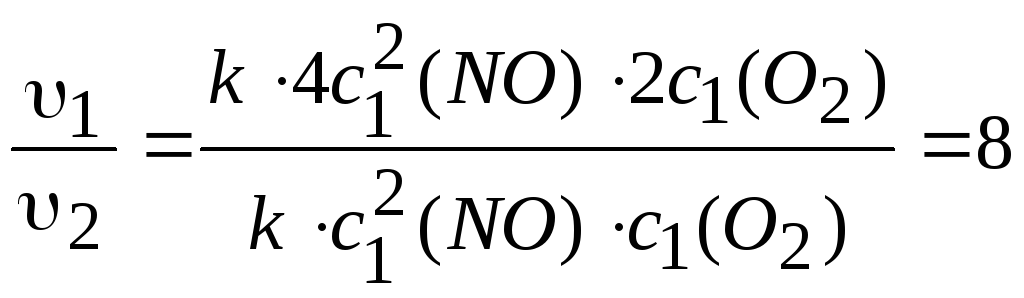
Ответ: в 8 раз.
Пример 6. Во сколько раз возрастет скорость химической реакции между газообразными веществами, реагирующими по уравнению А + В = С, если увеличить давление в системе в 2 раза?
Решение. Используя уравнение (3.5), выражаем скорость реакции до увеличения давления:
![]() .
.
Кинетическое уравнение после увеличения давления будет иметь следующий вид:
![]() .
.
При увеличении давления в 2 раза объем газовой смеси согласно закону Бойля-Мариотта (рУ = const) уменьшится также в 2 раза. Следовательно, концентрация веществ возрастет в 2 раза.
Таким
образом, с2(А)
=
2c1(A),
c2(B)
= 2с1{В).
Тогда
![]()
Определяем, во сколько раз возрастет скорость реакции при увеличении давления:
![]()
Ответ: в 4 раза.
Пример 7. Для реакции 4NH3 + 5О2 = 4NO + 6Н2О начальные концентрации NH3 и О2 равны соответственно 2 моль/дм3 и 3 моль/дм3- Определите их концентрации в момент времени, когда прореагирует 30 % NH3.
Решение. В подобных задачах подразумевается, что объем реакционной системы со временем не изменяется. Пусть объем системы равен 1 дм3, тогда концентрации реагентов, как следует из формулы
![]() ,
,
численно равны их количествам, т. е. n(NH3) = 2 моль и n(О2) = 3 моль. Далее решаем задачу с использованием количества вещества, а затем определяем концентрации по формуле
![]() .
.
Рассчитываем количество прореагировавшего аммиака:
nпрор(NH3) = n1(NH3) 0,3 = 20,3 = 0,6 моль. Тогда количество оставшегося аммиака равно:
n2 (NH3 ) = 2 - 0,6 = 1,4 моль,
а его концентрация:
c2(NH3)
=
![]() =
l,4
моль /дм3.
=
l,4
моль /дм3.
Находим количество прореагировавшего кислорода. Согласно уравнению реакции 4 моль NH3 реагирует с 5 моль O2, а 0,6 моль прореагировавшего NH3 будет взаимодействовать с х моль О2.
4 моль МН3 - 5 моль О2;
0,6 моль NH3 - х моль О2.
Отсюда
х =
![]() =
0,75 моль.
=
0,75 моль.
Тогда количество оставшегося кислорода равно: n2(O2)=n1(O2)-nпрор (O2)=3-0,75 = 2,25моль;
с2
(О2
)=
![]() =
2,25 моль/ дм3.
=
2,25 моль/ дм3.
Ответ: 1,4 моль/дм3 NН5; 2,25 моль/дм3 О2.
Пример 8. На сколько градусов надо повысить температуру, что бы скорость реакции возросла в 27 раз? Температурный коэффициент реакции равен 3.
Решение. Используем выражение (3.6):
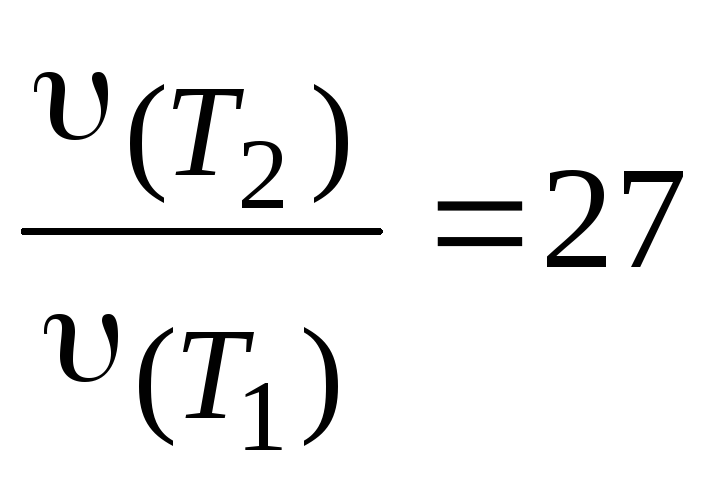 .
.
Получаем:
27 =
![]() ,
,
![]() =
3, Т
= 30.
=
3, Т
= 30.
Ответ: на 30 градусов.
Пример 9. При температуре 293 К реакция протекает за 2 мин. За какое время будет протекать эта реакция при температуре 273 К, если γ = 2.
Решение. Из уравнения (3.8) следует:
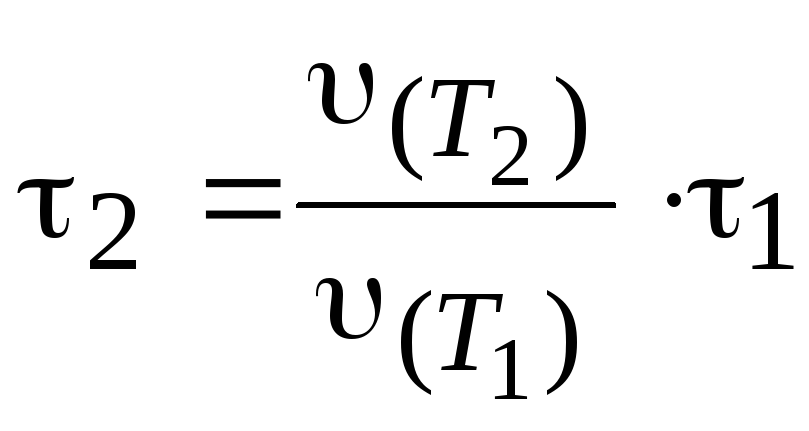 .
.
Используем
уравнение (3.6), поскольку
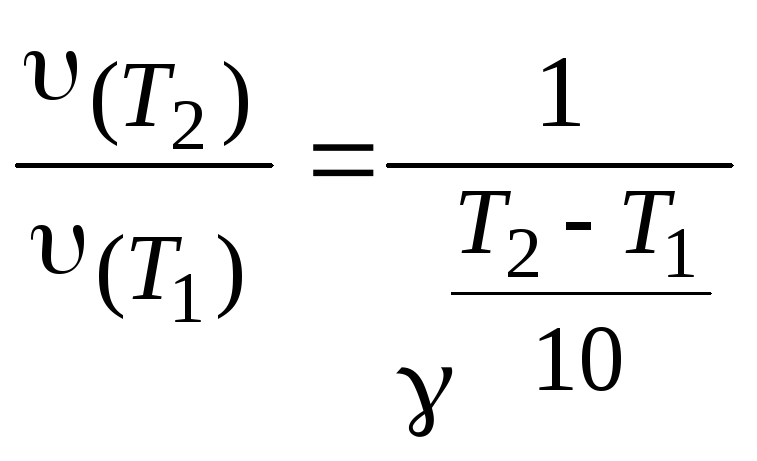 Получим:
Получим:

 мин.
мин.
Ответ: 8 мин.
Пример 10. Энергия активации некоторой реакции в отсутствие катализатора равна 75,24 кДж/моль, с катализатором - 50,14 кДж/моль. Во сколько раз возрастает скорость реакции в присутствии катализатора, если реакция протекает при температуре 298 К? Решение. Воспользуемся уравнением (3.11). Подставляя в уравнение данные
Еа = 75,24 кДж / моль = 75,24 103 Дж / моль и
Еа(кат)=- 50,14 кД/моль= 50,14 103 Дж /моль, получим
![]()
Окончательно
находим:
![]()
Таким образом, снижение энергии активации на 25,1 кДж/моль привело к увеличению скорости реакции в 25 000 раз.
Ответ: в 2.5104 раз.
Пример 11. Для реакции синтеза аммиака
N2(r) + 3H2(r)2NH3(r)
равновесные концентрации N2, Н2 и NH3 равны соответственно 3 моль/дм3, 2 моль/дм3 и 0,3 моль/дм3. Найдите исходные концентрации N2 и Н2 и константу равновесия реакции.
Решение. Пусть объем системы равен 1 дм" и в холе реакции q изменяется. Обозначим равновесные концентрации как [H2], [N2], [NH3], исходные - как с(Н2), c(N2), концентрации и количество прореагировавшего вещества - с(Н2)прор c(N2)прор. n(N2)прор и n(Н2)прор.
с(Н2) = [Н2] + с(H2)поор;
c(N2) = [N2]+ c(N1)w.
Находим количество прореагировавшего азота n(N2)прор и вoдopoд n(Н2)прор. по количеству образовавшегося аммиака. Составляем пропорции согласно уравнениям реакций: i
на образование 2 моль NH3 расходуется 1 моль N2, i
на образование 0,3 моль NH3 расходуется х моль N2.
Отсюда х = 0,15 моль - количество прореагировавшего азота n(N2)прор=0,15 моль.
Находим концентрацию прореагировавшего N2:
c(N2)
=
![]() =
0,15 моль/дм3 I
=
0,15 моль/дм3 I
Аналогично определяем количество прореагировавшего водород на образование 2 моль NH3 расходуется 3 моль Н2, на образование 0,3 моль NH3 расходуется y моль Н2.
Отсюда у = 0,45 моль, л(Н2)прор = 0,45 моль. Находим концентрацию прореагировавшего Н2:
с(Н2)
=
![]() = 0,45 моль/дм3.
= 0,45 моль/дм3.
Следовательно, исходные концентрации азота и водорода равны:
с(Н2) = [Н2] + c(H2)прор = 3 + 0,15 = 3,15 моль/лм3;
c(N2) = [N2] + c(N2)прор = 2 + 0,45 = 2,45 моль/дм3.
Находим константу равновесия, используя выражение (3.13):

Ответ: с(Н2) = 3,15 моль; c(N2) = 2,45 моль; Кр = 3,7510 -3. Подставляя константу равновесия в уравнение (3.12), получаем:
![]() (3.14)
(3.14)
Пример 12. Какое влияние на состояние равновесия реакции
S(k)+O2(г)SO2(г)+Q
окажут: а) повышение температуры; б) увеличение давления; в) введение дополнительной порции серы или кислорода; г) введение в систем; катализатора?
Решение. Повышение температуры сместит равновесие влево, и сторону эндотермической реакции.
Поскольку количества молекул газов в обеих частях уравнения равны (по 1 моль), то изменение давления не влияет на смешение равновесия.
Изменение концентрации серы (твердое вещество) также не изменит равновесие, а увеличение концентрации кислорода сместит равновесие вправо: быстрее пойдет прямая реакция, в которой кислород расходуется.
Так как катализатор в равной мере ускоряет как прямую, так и обратную реакцию, то введение его в систему не приводит к смещению химического равновесия.
Приготовление растворов
Пример 1. Какие массы хлорида натрия и воды нужно взять, чтобы приготовить 1 кг раствора с массовой долей соли 5 %?
Решение. Вариант I
В 100 г раствора должно быть 5 г NaCl,
в 1000 г раствора должно быть х г NaCl.
Откуда
![]()
Если соли нужно 50 г, то воды 1000 - 50 = 950 г.
Вариант II
Из выражения (4.1) находим массу вещества:
т(вещества) = wm(pacmвopa), т(вещества) = 10000,05 = 50 г.
Из выражения (4.2) находим массу растворителя (воды):
т(растворителя) = т{раствора) - т(вещества);
т(растворителя) = 1000 - 50 = 950 г.
Ответ: 50 г соли и 950 г воды.
Пример 2. Какая масса воды необходима для растворения 108 г соли, чтобы получить раствор с массовой долей соли 30 %?
Решение. Вариант I
В 100 г раствора должно быть 30 г соли, в х г раствора должно быть 108 г соли. Откуда
![]() .
.
Значит, воды нужно 360 - 108 = 252 г.
Вариант II
Из выражения (4.1) находим массу раствора:
т(раствора)
=![]() ;
т(раствора)
=
;
т(раствора)
= ![]() =
360 г.
=
360 г.
Из выражения (4.2) находим массу растворителя (воды):
т{растворителя) = т(раствора) — т{вещества);
т(растворителя) = 360 — 108 = 252 г.
Ответ: 252 г воды.
Разбавление растворов
Пример 3. К 300 см3 раствора (р = 1,07 г/см3) с массовой долей H2SO4 10 % добавили 180 г воды. Какой стала массовая доля кислоты в полученном растворе?
Решение. Находим массу раствора:
т{раствора) = V(pacтвopa) p,
m(pacmвopa) = 3001,07 = 321 г.
Из выражения (4.1) находим массу вещества:
т(вещества) = wm(pacmвopa);
т(вещества) = 321 0,1 = 32,1 г.
Масса раствора после добавления воды составила
321 г + 180 г = 501 г.
Подставляя полученные значения в уравнение, выражающее массовую долю, получим:
![]() .
.
Ответ: массовая доля H2SO4 в растворе 6,4 %.
Пример 4. Какую массу столового уксуса, в котором массовая доля СНзСООН 9 %, можно приготовить из 90 г уксусной эссенции с массовой долей СН3 СООН 80 %?
Решение. Из выражения (4.1) находим массу вещества уксусной кислоты:
т{вещества) — w2(вещества) т(раствора)2,;
т{вещества) = 90 0,8 = 72 г.
Учитывая, что масса вещества в первом и втором растворах одинакова, из выражения (4.1) находим массу раствора уксусной кислоты (9 %):
т(раствора)=![]() =
800 г.
=
800 г.
Ответ: 800 г.
Укрепление растворов. Раствор можно укрепить, т. е. повысить массовую долю растворенного вещества разными способами. Например, добавить определенное количество растворенного вещества, или прибавить более концентрированный раствор, или подвергнуть упариванию.
Пример 5. 200 г водного раствора с массовой долей КС1 15 % упарили. Определите:
а) какова массовая доля КС1 в полученном растворе, если его масса после упаривания составляет 150 г;
б) массу испарившейся воды, если массовая доля КС1 повысилась до 25 %.
Решение. а) Учитывая, что содержание КС1 в растворе при упаривании не изменилось, из выражения (4.1) находим массу вещества:
т(вещества) = wm(pacmвopa); т(вещества) =2000,15 = 30 г.
Из выражения (4.1) находим массовую долю вещества в полученном растворе:
w(КС1)=![]() = 0,2 = 20%.
= 0,2 = 20%.
б) Пусть испарилось х г воды, тогда из уравнения (4.1), выражающего массовую долю, находим:
![]() .
.
Найдем х = 80.
Ответ: а) 20 %; б) 80 г.
Пример 6. Какую массу соли СаС12 нужно добавить к 100 см3 раствора (р = 1,02 г/см3) с массовой долей этой соли 5 %, чтобы получить раствор с массовой долей 7,5 %?
Решение. Пусть нужно добавить х г соли. Используя формулу (4.1), составим уравнение, выражающее массовую долю СаС12 в растворе:
 Откуда
х
= 2,76.
Откуда
х
= 2,76.
Ответ: 2,76 г.
