
Порядок работы
Определение поверхностного натяжения раствора хлорида натрия. Налив в сосуд дистиллированной воды при комнатной температуре, находят Δh0. Затем наливаем в сосуд 5%-ый раствор хлорида натрия, находим Δhc. По табличным значениям а0 и найденным величинам Δh0 и Δhc определяют аc. Повторяем опыт для 10%, 15%, x% растворов. Полученные данные заносятся в таблицу 1. При комнатной температуре можно исследовать зависимость, аc от концентрации раствора и убедиться в том, что с ростом концентрации хлорида натрия коэффициент поверхностного натяжения аc увеличивается. По построенному градуировочному графику, графическим методом найдите неизвестную концентрацию x% раствора.
Таблица 1
|
Определяемые величины |
Примечания |
|||||||||
|
Δhc |
|
|
|
|
|
|
|
|
a0 |
Δh0t |
|
ac |
|
|
|
|
|
|
|
|
|
|
Особенности молекулярного строения жидкостей
Обычные жидкости изотропны, структурно они являются аморфными телами. Для внутреннего строения жидкостей характерен ближний порядок в расположении молекул (упорядоченное расположение ближайших частиц). Расстояния между молекулами невелики, силы взаимодействия значительны, что приводит к малой сжимаемости жидкостей: небольшое уменьшение расстояния между молекулами вызывает появление больших сил межмолекулярного отталкивания.
Подобно твердым телам, жидкости мало сжимаемы и обладают большой плотностью, подобно газам, принимают форму сосуда, в котором находятся. Такой характер свойств жидкостей связан с особенностями теплового движения их молекул. В газах молекулы движутся беспорядочно, на малых отрезках пути — поступательно, в расположении частиц отсутствует какой-либо порядок. В кристаллических телах частицы колеблются около определенных положений равновесия — узлов кристаллической решетки. По теории Я. И. Френкеля молекулы жидкости, подобно частицам твердого тела, колеблются около положений равновесия, однако эти положения равновесия не являются постоянными. По истечении некоторого времени, называемого временем «оседлой жизни», молекула скачком переходит в новое положение равновесия на расстояние, равное среднему расстоянию между соседними молекулами.
Вычислим среднее расстояние между молекулами жидкости. Можно мысленно представить весь объем жидкости разделенным на небольшие одинаковые кубики с ребром 5. Пусть в среднем в каждом кубике находится одна молекула. В этом случае 5 можно рассматривать как среднее расстояние между молекулами жидкости. Объем жидкости равен V = &3N, где N — общее количество молекул жидкости. Если п — концентрация молекул (количество молекул в 1 м3), то N = nV. Из этих уравнений получаем
(7.18)
![]()
.
Среднее время «оседлой жизни» молекулы называют временем релаксации т. С повышением температуры и понижением давления время релаксации сильно уменьшается, что обусловливает большую подвижность молекул жидкости и меньшую ее вязкость.
Для того чтобы молекула жидкости перескочила из одного положения равновесия в другое, должны нарушиться связи с окружавшими ее молекулами и образоваться связи с новыми соседями. Процесс разрыва связей требует затраты энергии Еа (энергии активации), выделяемой при образовании новых связей. Такой переход молекулы из одного положения равновесия в другое является переходом через потенциальный барьер высотой £а. Энергию для преодоления потенциального барьера молекула получает за счет энергии теплового движения соседних молекул. Зависимость времени релаксации от температуры жидкости и энергии активации выражается формулой, вытекающей из распределения Больцмана (см. § 2.4).
![]()
где т0 — средний период колебаний молекулы около положения равновесия.
![]()
(7.20)
Эта скорость мала по сравнению со средней скоростью движения молекул в газе. Так, например, для молекул воды она в 20 раз меньше, чем для молекул пара при той же температуре.
Поверхностное натяжение
На поверхностях раздела жидкости и ее насыщенного пара, двух несмешиваемых жидкостей, жидкости и твердого тела возникают силы, обусловленные различным межмолекулярным взаимодействием граничащих сред.
Каждая молекула, расположенная внутри объема жидкости, равномерно окружена соседними молекулами и взаимодействует с ними, но равнодействующая этих сил равна нулю. На молекулу, находящуюся вблизи границы двух сред, вследствие неоднородности окружения действует сила, не скомпенсированная другими

Поверхностное натяжение (коэффициент поверхностного натяжения) определяется отношением работы, затраченной на создание некоторой поверхности жидкости при постоянной температуре, к площади этой поверхности:
(7.21)
![]()
Условием устойчивого равновесия жидкостей является минимум энергии поверхностного слоя, поэтому при отсутствии внешних сил или в состоянии невесомости жидкость стремится иметь минимальную площадь поверхности при данном объеме и принимает форму шара.
Поверхностное натяжение может быть определено не только энергетически. Стремление поверхностного слоя жидкости сократиться означает наличие в этом слое касательных сил — сил поверхностного натяжения. Если выбрать на поверхности жидкости некоторый отрезок длиной I (рис. 7.8), то можно условно изобразить эти силы стрелками, перпендикулярными отрезку.
Поверхностное натяжение равно отношению силы поверхностного натяжения к длине отрезка, на котором действует эта сила:
(7.22)
Из
школьного курса физики![]() известно,
что оба определения, (7.21) и (7.22), тождественны.
Приведем значения поверхностного
натяжения для некоторых жидкостей при
температуре 20 °С (табл.
15).
известно,
что оба определения, (7.21) и (7.22), тождественны.
Приведем значения поверхностного
натяжения для некоторых жидкостей при
температуре 20 °С (табл.
15).
Таблица 15
|
Жидкость |
а, Н/м |
Жидкость |
а, Н/м |
|
Вода |
0,0725 |
Ртуть |
0,47 |
|
Желчь |
0,048 |
Спирт |
0,022 |
|
Молоко |
0,05 |
Сыворотка крови |
0,06 |
|
Моча |
0,066 |
Эфир |
0,017 |
Поверхностное натяжение зависит от температуры. Вдали от критической температуры значение его убывает линейно при увеличении температуры. Снижения поверхностного натяжения можно достигнуть введением в жидкость поверхностно-активных веществ, уменьшающих энергию поверхностного слоя.
Смачивание и несмачивание. Капиллярные явления
На границе соприкосновения различных сред может наблюдаться смачивание или несмачивание.
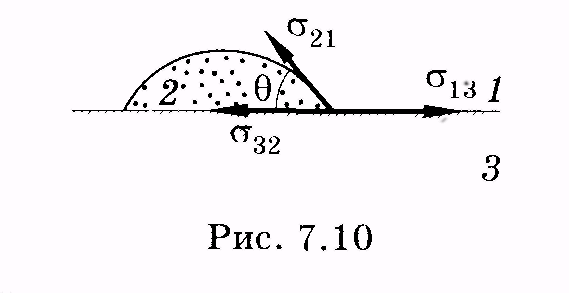
На рисунках показана капля жидкости на поверхности другой, не смешивающейся с ней жидкости (рис. 7.9) и на поверхности твердого тела (рис. 7.10 и 7.11). На поверхностях раздела каждых двух сред (1 и 3, 2 и 1, 3 и 2) действуют силы поверхностного натяжения (показаны стрелками). Если эти силы разделить на длину окружности капли (границы трех сред), то получим соответственно σ13, σ21, σ32.
Угол 9 между смачиваемой поверхностью и касательной к поверхности жидкости, отсчитываемый через нее, называют краевым.
За меру смачивания принимают величину
(7.23)
![]()
Если σ32 < σ13 (см. рис. 7.10), то θ < π/2, и жидкость смачивает твердое тело, поверхность которого в этом случае называется гидрофильной. В случае σ32 < σ13 (см. рис. 7.11) θ > π/2, жидкость не смачивает тело, поверхность его в этом случае называют гидрофобной. Несмачивающая жидкость не протекает через малые отверстия в твердом теле. При σ32 - σ13 > σ21 краевой угол определить нельзя, так как cos 6 не может быть больше единицы. В этом случае капля растекается по поверхности твердого тела до тех пор, пока не покроет всей его поверхности или пока не образуется мономолекулярный слой. Такой случай является идеальным смачиванием


. К нему с некоторым приближением можно отнести растекание спирта или воды по чистой поверхности стекла, нефти по воде и пр.
Под действием сил поверхностного натяжения поверхностный слой жидкости искривлен и оказывает дополнительное по отношению к внешнему давление Δр. Поверхностный слой подобен упругой оболочке, например резиновой пленке. Результирующая сил поверхностного натяжения искривленной поверхности направлена в сторону вогнутости (к центру кривизны). В случае сферической поверхности, радиус кривизны которой r, дополнительное давление
Δр = 2 σ/r. (7.24)
Искривление поверхности (мениск), в частности, возникает в узких (капиллярных) трубках в результате смачивания или несмачивания жидкостью их поверхности. При смачивании образуется вогнутый мениск (рис. 7.12). Силы давления направлены от жидкости наружу, т. е. вверх, и обусловливают подъем жидкости в капилляре. Это равновесное состояние, показанное на рисунке, наступает тогда, когда давление ρgh уравновесит Δр.
![]()
где R- радиус капилляра
Поэтому [(см. (7.24)] получаем
(7.25)
![]()
![]()

(7.26)
![]()
т. е. зависит от свойств жидкости и материала капилляра, а также от его радиуса.
В случае несмачивания cos θ < 0 и формула (7.26) покажет высоту опускания жидкости в капилляре.
Капиллярные явления определяют условия конденсации паров, кипения жидкостей, кристаллизации и т. п. Так, например, на молекулу

пара (рис. 7.13; точка А) над вогнутым мениском жидкости действует больше молекул жидкости и, следовательно, большая сила, чем при выпуклом мениске (показаны стрелками). Это видно из рис. 7.13, на котором штриховыми линиями условно показаны сферы молекулярного действия, а заштрихованные участки — объемы жидкости, молекулы которых притягивают выделенную молекулу пара. В результате этого возникает капиллярная конденсация в смачиваемых тонких трубках даже при
сравнительно малой влажности воздуха. Благодаря этому пористые вещества могут задерживать значительное количество жидкости из паров, что приводит к увлажнению белья, ваты в сырых помещениях, затрудняет сушку гигроскопических тел, способствует удержанию влаги в почве и т. п. Наоборот, несмачивающие жидкости не проникают в пористые тела. С этим связана, например, непроницаемость для воды перьев птиц, смазанных жиром.
Рассмотрим поведение пузырька воздуха, находящегося в капилляре с жидкостью. Если давление жидкости на пузырек с разных сторон одинаково, то оба мениска пузырька будут иметь одинаковый радиус кривизны, и силы дополнительного давления будут уравновешивать друг друга Fv = —F2 (рис. 7.14, а). При избыточном давлении с одной из сторон, например при движении жидкости, мениски деформируются, изменятся их радиусы кривизны (рис. 7.14, б), дополнительное давление Ар с разных сторон станет неодинаковым. Это приведет к такому воздействию на жидкость со стороны пузырька воздуха (газа), которое затруднит или прекратит движение жидкости. Такие явления могут происходить в кровеносной системе человека.
Попавшие в кровь пузырьки воздуха могут закупорить мелкий сосуд и лишить кровоснабжения какой-либо орган. Это явление, называемое эмболией, может привести к серьезному функциональному расстройству или даже летальному исходу. Так, воздушная эмболия может возникнуть при ранении крупных вен: проникший в ток крови воздух образует воздушный пузырь, пре-

пятствующий прохождению крови. Пузырьки воздуха не должны попадать в вены при внутривенных вливаниях.
Газовые пузырьки в крови могут появиться у водолазов при быстром подъеме с большой глубины на поверхность, у летчиков и космонавтов при разгерметизировании кабины или скафандра на большой высоте (газовая эмболия). Это обусловлено переходом газов крови из растворенного состояния в свободное — газообразное — в результате понижения окружающего атмосферного давления. Ведущая роль в образовании газовых пузырьков при уменьшении давления принадлежит азоту, так как он обусловливает основную часть общего давления газов в крови и не участвует в газообмене организма и окружающего воздуха.
СВОБОДНАЯ ЭНЕРГИЯ ПОВЕРХНОСТИ ЖИДКОСТИ
На
молекулы, находящиеся в поверхностном
слое жидкости, действуют добавочные
силы — силы поверхностного
натяжения. Изменяя
величину поверхности жидкости, эти
силы могут совершать работу. Поэтому
поверхностный слой обладает (по
сравнению с остальной массой жидкости)
добавочной свободной энергией.
Величину этой свободной энергии
легко вычислить на таком примере (рис.).
Рассмотрим рамку ABCD,
па которой находится
пленка жидкости; сторона CD
— подвижная. На сторону
CD,
если ее длина равна
l,
действует сила поверхностного натяжения
F=σ•
l,
где σ — коэффициент
поверхностного натяжения. Эта сила
стремится уменьшить поверхность
жидкости, т. е. передвинуть сторону
CD
в положение C'D'.
При этом совершается
работа dA
= F-dx
— σ
ldx
= σ
• dS,
где dS
— изменение площади
поверхности жидкости. Если не учитывать
потерь на трение, то есть считать
процесс обратимым, то работа равна
изменению свободной энергии (dA
— dF),
поэтому можно считать,
что изменение свободной энергии равно
![]() а сама свободная энергия
а сама свободная энергия
|
поверхностного слоя жид костиI
|
|
Абсолютное
значение поверхностной свободной
энергии невелико. Тем не менее в
ряде случаев эта энергия может играть
существенную роль в практике. Так,
поверхность пузырька, находящегося в
жидкости, обладает добавочной свободной
энергией. Согласно второму началу
термодинамики, такая система (жидкость
+ пузырек) стремится перейти в состояние
с меньшей свободной энергией, а это
значит, что пузырек стремится сократить
свою поверхность, то есть сжаться.
Поэтому в пузырьке возникает дополнительное
давление, величину которого можно найти
по формуле Лапласа:
![]() где r—
радиус пузырька. Если радиус велик, это
добавочное давление незначительно,
но в очень маленьких пузырьках оно
приобретает важное значение. Например,
если радиус пузырька равен радиусу
кровеносного капилляра человека
где r—
радиус пузырька. Если радиус велик, это
добавочное давление незначительно,
но в очень маленьких пузырьках оно
приобретает важное значение. Например,
если радиус пузырька равен радиусу
кровеносного капилляра человека
![]() (около
10 мкм), то
(около
10 мкм), то
что заметно превосходит давление крови в капиллярах (около 4 кПа). На первый взгляд кажется, что силы давления в пузырьке должны уравновешиваться (рис. 3, а), и поэтому пузырек не должен мешать движению крови. На самом деле, однако, пузырек в кровеносном сосуде имеет форму не
сферы,
а более сложного тела (рис. 3,6).
Под влиянием напора
крови поверхность пузырька, обращенная
навстречу току крови, уплощается (на
рис. 3,6 слева), а противоположная
поверхность — вытягивается (на рис. 3,6
справа). В результате сила давления
слева будет меньше (так как там больше
радиус), чем с противоположной стороны.
Возникает результирую-щая сила, всегда
направленная навстречу кровотоку.
Поэтому пузырек газа может закупорить
кровеносный сосуд не менее плотно, чем
твердая частица, вследствие чего может
возникнуть газовая (воздушная) эмболия.
По этой причине очень опасны ранения
вен: так как в венах давление близко к
атмосферному, воздух способен
проникнуть внутрь вены и, раздробившись
на множество мелких пузырьков, стать
причиной тяжелых расстройств
кровообращения, приводящих нередко
к гибели человека. и
.
и
.
Многие вещества влияют на поверхностное натяжение: одни — в сторону увеличения, другие — в сторону уменьшения его. При растворении веществ, повышающих поверхностное натяжение, свободная энергия должна увеличиваться, что термодинамически невыгодно. Поэтому молекулы таких веществ будут уходить из поверхностного слоя в глубь жидкости. Влияние подобных веществ (например, Сахаров) на поверхностное натяжение раствора, оказывается в целом незначительным. Совсем другой результат получится при растворении веществ, снижающих коэффициент поверхностного натяжения. В этом случае свободная энергия поверхностного слоя будет уменьшаться, что термодинамически выгодно. Поэтому молекулы растворенного вещества концентрируются именно в поверхностном слое.
Вещества, уменьшающие силы поверхностного натяжения, называются поверхностноактивными (ПАВ). Из сказанного выше ясно, что поверхностно-активные вещества даже в небольших количествах сильно влияют на поверхностное натяжение, так как их концентрация в поверхностном слое, где они действуют, оказывается намного больше средней концентрации, рассчитанной на весь объем жидкости. Поверхностноактивные вещества играют существенную роль в природе и технике. Остановимся на нескольких примерах. Известно, что одним из механизмов борьбы с инфекцией является фагоцитоз — захват и разрушение микроорганизмов лейкоцитами. Оказалось, что в этом явлении большое значение имеют поверхностные явления. Дело в том, что большинство микроорганизмов выделяет Поверхностноактивные вещества. Представим себе лейкоцит, около которого находится микроорганизм. В результате действия ПАВ, выделяемых микробом, силы поверхностного натяжения в той части оболочки лейкоцита, которая направлена к микробу, ослабевают, тогда как в других ее частях — остаются неизменными. Возникает результирующая сила, направленная в сторону микроба и обусловливающая движение лейкоцита к нему. После вступления лейкоцита в контакт с микробом развивается сложный комплекс процессов разрушения и переваривания микроорганизма.
Другим примером могут служить процессы пищеварения, в частности переваривание жиров. Оно эффективно только в том случае, если капли жира будут в кишечнике раздроблены на мельчайшие капельки Этому процессу мешают силы поверхностного натяжения: при превращении большой капли в маленькие общая поверхность возрастает, а следовательно, увеличивается и свободная энергия, что термодинамически невыгодно. Процесс размельчения значительно облегчается, если подействовать на каплю жира каким-либо ПАВ. При этом коэффициент поверхностного натяжения снижается, а значит, уменьшается и свободная энергия. Такие ПАВ выделяются в просвет кишки в составе желчи — это соли желчных кислот. При наруше-
нии желчеотделения процессы переваривания и всасывания жиров резко ослабевают.
Очень большое значение имеют поверхностные явления в легких. Поверхность легочных альвеол всегда покрыта тонкой пленкой жидкости. Возникающие в этой пленке силы поверхностного натяжения могут привести к слипанию альвеол (подобно тому как слипаются два мокрых листка бумаги), потому что при этом свободная поверхностная энергия уменьшается. Ясно, что если стенки альвеол слипнутся, дыхание станет невозможным. Этому препятствует так называемый сурфактант — своеобразный мембранный комплекс, выделяемый альвеолярным эпителием на поверхность. Сурфактант обладает высокой поверхностной активностью. Благодаря ему силы поверхностного натяжения значительно уменьшаются и слипания альвеол не происходит. Нарушение продукции сурф актанта приводит к тяжелым расстройствам дыхательной функции. В следующем разделе сурфактант будет охарактеризован подробнее.
К ПАВ относятся все моющие средства, как естественные (мыла), так и синтетические. Представим частицу грязи, лежащую на поверхности кожи. Чтобы смыть ее, вода должна проникнуть между частицей и кожей, но этому препятствует сила поверхностного натяжения. Так как щель между частицей и кожей очень узкая, т. е. величина г в формуле (15) мала, возникающее здесь добавочное давление велико и сильно мешает затеканию жидкости под частицу. Если добавить к жидкости ПАВ, добавочное давление уменьшается; в результате грязь смывается значительно легче. Кроме влияния на поверхностное натяжение мыло действует и химически, способствуя растворению жиров, однако именно сочетание химического действия с поверхностной активностью обеспечивает наилучший моющий эффект. Опыт показывает, что все моющие средства обладают высокой степенью поверхностной активности, то есть сильно снижают значение коэффициента поверхностного натяжения.
Поверхностно активные вещества необходимы для удаления продуктов радиоактивного распада, химических отравляющих веществ и различных видов биологического оружия с поверхности тела человека, с его одежды, объектов военной техники в очагах массового поражения. В этих условиях требуется применение наиболее эффективных моющих средств, для чего был произведен синтез большого ряда новых ПАВ. Многие из них нашли применение и в различных областях народного хозяйства.

