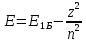- •16.Сферичні дзеркала. Побудова зображення в сферичних дзеркалах. Збільшення сферичного дзеркала.
- •17.Тонка лінза. Формула тонкої лінзи. Побудова зображень в лінзах. Лінійне збільшення лінзи.
- •18.Теплове випромінювання та його характеристики. Закон Кіркгоффа
- •19.Закон Стефана-Больцмана. Закон зміщення Віка. Квантова теорія теплового випромінювання. Формула Планка.
- •20.Зовнішній фотоефект та його закони. Формула Ейнштейна. Застосування фотоефекту.
- •23.Досліди Резерфорда. Модель атома Бора-Резерфорда. Теорія Бора.
- •24.Розрахунок швидкості, радіуса орбіти та енергії електрона в атомі водню та у воднеподібних іонах.
- •25.Закономірності в спектрі атомарного водню та воднеподібних іонів.
- •26.Хвилі де-Бойля. Досліди Девісона і Джермера.
- •27.Співвідношення невизначеностей Гейзенберга
- •28.Рентгенівське випромінювання. Одержання рентгенівського випромінювання. Гальмівне рентгенівське випромінювання.
- •29.Характеристичне рентгенівське випромінювання. Закон Моллі. Застосування рентгенівського випромінювання.
- •30.Склад атомного ядра. Дефект мас. Енергія зв’язку.
- •31.Види радіоактивності. Закон радіоактивного розпаду. Правила зміщення і радіоактивні ряди.
- •32.Ядерні реакції. Тепловий вихід ядерних реакцій. Реакція поділу важких ядер.
23.Досліди Резерфорда. Модель атома Бора-Резерфорда. Теорія Бора.
На поч. 20 ст. було накопичено ряд відомостей про будову атома:
Атоми – ел.-нейтр.
До складу атома входять від.-зар. Електрони
Розмір атома
Дослід Резерфорда: Резерфорд дослідив розсіяння альфа-частинок на тонкій металевій фользі.
Резерфорд 1906 року запропонував модель, згідно з якою будова атома дуже схожа на будову сонячної системи. Щоб перевірити правильність своєї теорії, він провів низку дослідів, які називають дослідами Резерфорда. Він зондував атоми золота швидкорухомими ядрами гелію ( частинками).
Навпроти отвору в свинцевому контейнері на екрані, покритому ZnSO4, можна було помітити світлову пляму. Резерфорд помістив на шляху рухомих ядер тонку золоту пластинку (фольгу), і помітив, що незначна частина ядер відхиляється на значні кути і дуже мало ядер відбивались назад. Узагальнивши результати дослідів, Резерфорд зробив висновки:
- в цілому атом порожній. Майже вся його маса сконцентрована в ядрі діаметром d ~ 10-15 м.
- ядро несе в собі заряд q+, величина якого за модулем дорівнює заряду електрона, помноженому на порядковий номер цього елемента в таблиці Менделєєва.
- оскільки атом електрично нейтральний, то позитивний заряд ядра компенсує заряд електронів, які мають рухатись навколо ядра, подібно до планет навколо Сонця. Кількість електронів дорівнює порядковому номеру елемента в таблиці Менделєєва. Таку модель атома Резерфорд назвав планетарною моделлю атома.
Теорія Резерфорда мала ряд недоліків:
Якщо електрон рух-ся по коловій орбіті, то він рух-ся з доцентровим прискоренням. Згідно клас. термодинаміки (теорія Максвелла), випромінює ел.-магн.хвилю і за короткий час повинен впасти на ядро.
Не можна пояснити закон-сті в спектрах атома водню.
Тому теорія Резерфорда була доповнена Бором (1913). Бор сформулював 2 постулати:
В атомі існують стаціонарні орбіти, по яких електрон може рух-ся без випр.-ня.
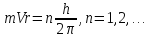
При переході з однієї орбіти на іншу атом може випр.-ти або поглинати квант світла.
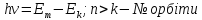
24.Розрахунок швидкості, радіуса орбіти та енергії електрона в атомі водню та у воднеподібних іонах.
Теорія Бора добре описує будову атома водню та воднеподібних іонів. Тобто іонів, у яких є тільки 1 електрон (He, Li).
Нехай навколо нерухомо зарядженого ядра з зарядом q=z|e|, обертається електрон.
На
електрон діє сила Кулона.
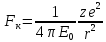
За
2 зак.Н.:
 ;
;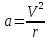 ;
;
 ;
;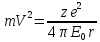 ;
;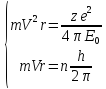 “ / ”
“ / ”
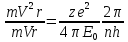

Ми одержали Vелектр. V квантується – приймає дискретний ряд значень. Для атома водню на 1 рівні n=1 (1-ий Барівський рівень)
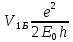 - стала величина
- стала величина
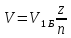
Визн.
радіус орбіт:
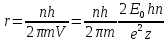
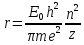
Радціус
теж
квантується:
z=1, n=1,
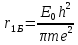 ;
;
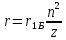
Енергія електор. в воднеподібн. іоні. Енергія склад. З 2 част.:
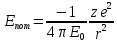
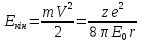
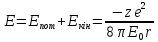
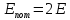 ;
;
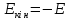
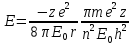
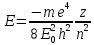

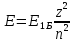
25.Закономірності в спектрі атомарного водню та воднеподібних іонів.
Байнер вперше побачив, що довжини хвиль видимих ліній в спектрі атомарного водню опис-ся однією ф-лою. Тобто утворюють спектральну серію. Пізніше були виявлені інші лінії серії Вальмера в ультра-фіол. діапазоні та інші спектр. серії.
Осн.спектр.серії:
Серія Лаймона (спост-ся тільки в ул.-ф. діапазоні):

Серія Бальмара (спост-ся 4 видимі л. і ул.-ф.):
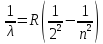
Серія Пажена:
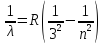
Серія Брессета:
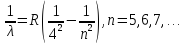
С.Пфулуса:
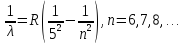
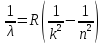 –узаг.ф-ла Бальмора
–узаг.ф-ла Бальмора
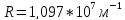 –стала Рідбера
–стала Рідбера
k
– визначає назву серії
n = k + 1, k + 2
Гол.лінія – перехід 3 n= k + 1 → k
Гранична лінія – n = ∞ → k
Виведемо узаг.ф-лу Баймера для атома водню та воднеподібних іонів
 (згідно 2 пост.
Бора)
(згідно 2 пост.
Бора)
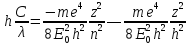
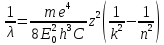
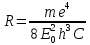
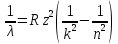
Покажемо вин-ня
спектр.серії на діаграмі: