
метода по химии 1 часть
.pdf
21
CH2-CH3 |
|
|
COOH |
|||||
|
|
|
KMnO4 |
|
|
|||
|
|
|
T0 |
|
|
|
|
+ CO2 + H2O |
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Какой бы длинной ни была боковая цепь, она окисляется до карбоксильной группы.
Глоссарий
Конфигурация – это пространственное расположение атомов в молекуле. Конформация – это различные геометрические формы молекулы, возникающие в результате вращения вокруг одинарных связей.
Полярность связи – неравномерное распределение электронной плотности между двумя различными по электроотрицательности связанными атомами. Электроотрицательность – способность атома в молекуле удерживать валентные электроны.
Поляризуемость – смещение электронов связи под влиянием внешнего электрического поля, в том числе, и другой реагирующей частицы.
Донорно-акцепторная (координационная) связь – это разновидность ковалентной связи, образующаяся за счет пары электронов одного из партнеров по связи. Водородная связь – это связь между водородом, являющимся положительным концом диполя одной молекулы, и сильно электроотрицательным элементом этой же или другой молекулы, являющимся отрицательным концом диполя. Природа связи – диполь-дипольное притяжение.
Делокализация – это распределение электронной плотности по сопряженной системе. Сопряженные системы – это соединения с чередующимися кратными и простыми связями, или кратными связями и атомами с р-орбиталями.
Индуктивный эффект [ I ] - это передача электронного влияния заместителя по углеродной цепи.
Мезомерный эффект [ M] – это передача электронного влияния заместителей по сопряженной системе.
Ароматическая система – это замкнутая сопряженная система, отвечающая критериям ароматичности.
Гидрофильные группы – это группы, имеющие сродство к Н2О. Они полярны, могут быть заряжены или нейтральны. Например, -+NH3, -COO-, -OH, -SH, и др. Гидрофобные группы – это группы, не имеющие сродства к воде, неполярные.
Например: -CH3, С6Н5- и др.
Нуклеофильные реагенты (нуклеофилы) – отрицательно заряженные частицы
(анионы H-, Cl-, HO- ) или нейтральные молекулы с избытком электронной плотности:
(NH3, H2O и др.). Обозначаются Nu- или :Nu.
Электрофильные реагенты ( электрофилы) – положительно заряженные частицы
(катионы Н+, СН3+, Сl+) или нейтральные молекулы с недостатком электронной плотности (SO3, AlCl3, FeCl3). Обозначаются символом Е+ или Е.
Тема 2. СПИРТЫ. ФЕНОЛЫ. НАФТОЛЫ. ТИОЛЫ
22
Цель занятия: сформировать знания о строении и химических свойствах спиртов, фенолов, нафтолов, тиолов; дать понятие кислотности и основности органических соединений, водородной связи, комплексных соединений (хелатов).
Конкретные задачи
1.Студент должен знать: классификацию, изомерию, номенклатуру спиртов, фенолов, тиолов; химические свойства одноатомных и многоатомных спиртов, фенолов, тиолов; понятие о кислотности и основности; понятие о реакциях нуклеофильного замещения.
2.Студент должен уметь: называть спирты, тиолы, фенолы по номенклатуре ИЮПАК; составлять формулы структурных изомеров, основываясь на электронном строении соединений, прогнозировать их химическую активность; проводить качественные реакции и с их помощью идентифицировать вещества.
Мотивация. Спирты, фенолы и тиолы – важные классы органических соединений. Гидроксильная спиртовая группа входит в состав многих важных для организма веществ – оксикислот, углеводов и т.д.; фенолы являются продуктами метаболизма некоторых аминокислот, тиоловая группа содержится во многих биологически важных соединениях
– аминокислотах (цистеин), ферментах, гормонах и благодаря своей высокой реакционной способности является мишенью различных повреждающих факторов – окислителей, тяжелых металлов и других так называемых «тиоловых ядов».
Вопросы для самоподготовки
1.Выведите формулы строения теоретически возможных изомеров бутилового спирта и назовите их по ИЮПАК. Укажите первичные, вторичные и третичные спирты.
2.Напишите формулы следующих соединений:
а) этандиол-1,2; б) 2,3–диметилбутандиол-2,3;
в) пропантриол-1,2,3.
3.Напишите уравнения реакций превращений: а) хлористого бутила в 2-бутанол;
б) 2-бром-3-метилпентана в 3-метил-3-пентанол.
4.Дайте определения понятий «кислотность» и «основность». Какое из соединений: этанол или этантиол, этанол или фенол – проявляет более кислый характер. Почему?
5.Напишите уравнение реакции взаимодействия изопропилового спирта с уксусной кислотой.
6.Какие вы знаете качественные реакции на фенолы?
7.Что такое хелаты? Получите хелат на основе глицерина и гидроксида меди.
Этапы занятия и контроль усвоения знаний
|
|
|
|
23 |
Продолжительность занятия – 4 часа. |
|
|
|
|
|
|
|
|
|
Этапы занятия |
Формы проведения этапа |
|
Время |
|
1. Контроль выполнения |
Проверка выполнения домашнего задания |
10 |
мин. |
|
домашнего задания. |
в рабочих тетрадях. |
|
|
|
2. Контроль самоподготовки. |
Тест-контроль. Его проверка и оценка |
20 |
мин. |
|
|
результатов (0, 5, 10 баллов). |
|
|
|
3. Разбор теоретического |
Опрос студентов у доски с коррекцией и |
90 |
мин. |
|
материала. |
объяснением |
преподавателем. |
|
|
|
Демонстрация плакатов. |
|
|
|
4. Приобретение практических |
Выполнение лабораторных работ по теме. |
30 |
мин. |
|
|
|
|
|
|
навыков. |
|
|
|
|
5. Оформление протоколов |
Оформление в протоколах графы |
15 |
мин. |
|
лабораторных работ. |
«Визуальные наблюдения». |
|
|
|
|
Самостоятельный анализ полученных |
|
|
|
|
данных и выводы из проделанной работы. |
|
|
|
6. Проверка и защита |
Опрос – беседа со студентами о |
15 |
мин |
|
протоколов. |
проделанной работе. |
|
|
|
Содержание этапов занятия
1-й этап. Преподаватель проверяет выполнение домашнего задания в рабочих тетрадях, отвечает на вопросы студентов. Оценка проделанной работы по пятибалльной системе. 2-й этап. Студент письменно отвечает на билет тест-контроля, сдает работу преподавателю; ответ проверяется на занятии и оценивается в баллах.
3-й этап. При ответе теоретического материала студенты у доски разбирают:
–особенности электронного строения гидроксильной и тиоловой групп и их химическое поведение;
–сравнение кислотности одноатомных спиртов с различными заместителями в радикале, одноатомных и многоатомных спиртов, одноатомных спиртов и фенолов, одноатомных спиртов и тиолов;
–образование «хелатов», как доказательство повышенных кислотных свойств у многоатомных спиртов и фенолов;
–реакция этерификации и гидролиз;
–реакции окисления спиртов, фенолов и тиолов;
–реакции замещения «ОН» группы на галоген (SN – реакции).
4-й этап. Студенты по 2 человека выполняют лабораторные работы по теме по практикуму, выдаваемому на занятии.
5-й этап. Студенты оформляют лабораторные работы в виде таблицы, данной в рабочей тетради.
6-й этап. Студент сдает оформленный протокол и объясняет полученные данные. Преподаватель оценивает приобретенные практические навыки.
Кислотность и основность органических соединений

24
Реакционная способность органических соединений тесно связана с понятиями “кислотность“ и “основность“. Для оценки кислотности и основности органических соединений наибольшее значение имеют две теории – теория Бренстеда (протолитическая ) и теория Льюиса.
Согласно определению Бренстеда, кислоты – это нейтральные молекулы или ионы, способные отдавать протон (доноры протонов); основания по Бренстеду – нейтральные молекулы или ионы, способные присоединять протон (акцепторы протонов). Кислота Льюиса – это акцептор электронной пары, основания Льюиса – донор электронной пары.
Впринципе большинство органических соединений можно рассматривать как кислоты, поскольку в них содержатся связи С-Н, N-H, O-H, S-H. Сила кислоты определяется стабильностью аниона, образующегося в результате диссоциации этой кислоты. Чем стабильнее анион, тем сильнее кислота. Стабильность аниона зависит от многих факторов:
а) способности атома, связанного с водородом, удерживать электронную пару после ухода протона (т.е. электроотрицательности);
б) размера этого атома; в) возможности делокализации (распределения отрицательного заряда по
другим атомам); г) способности растворителя сольватировать анион.
Вкачестве меры кислотности используют константу равновесия реакции ионизации
(Ка):
А Н |
Аˉ + |
Н+ |
Ka = |
Аˉ Н+ |
|
кислота |
анион |
про- |
АН |
||
|
|||||
|
кислоты |
тон |
|
|
Для удобства часто вместо Ка используют рКа= lg Ка
Кислотность различных классов органических соединений с одинаковыми радикалами увеличивается в следующей последовательности:
R – H2С – H R-NH-H |
R-O-H |
R-S-H |
R |
|
|
|
|
|
|
|
OH |
R – СOOH |
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
Карбоновые |
||||||||
Алканы |
Амины |
Спирты |
Тиолы |
|
Фенолы |
|
|||||||
|
|
кислоты |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
рКа 50 |
рКа 30 |
рКа 18 |
рКа 12 |
pКа 10 |
|
рКа 4,7 |
|||||||
СН кислоты |
NH кислоты |
ОН кислоты |
SH кислоты |
ОН кислоты |
|
ОН кислоты |
|||||||
Причиной самой слабой кислотности С-Н кислот является то, что углерод обладает низкой электроотрицательностью и проявляет слабую способность удерживать отрицательный заряд на анионе. Поэтому образование карбанионов является энергетически невыгодным процессом:
СН4 |
СН3 ˉ + Н+ |
карбанион (метил-анион)
Среди насыщенных соединений заметную кислотность проявляют спирты (О-Н- кислоты), что обусловлено достаточной электроотрицательностью атома кислорода, т.е. способностью удерживать электронную пару в анионе, тем самым, стабилизируя его:
R O H 
 ROˉ + H+
ROˉ + H+
спирт алкоксиданион
25
Стабильность аниона R – Oˉ значительно повышается с появлением возможности делокализации отрицательного заряда либо за счет электроотрицательного элемента в радикале, либо по системе сопряженных связей. Так, например, увеличение кислотности нарколана (Br3C–CH2-OH) объясняется влиянием –I эффекта трех атомов брома в радикале (стабилизирующий фактор).
Увеличение кислотности фенолов по сравнению с алифатическими спиртами объясняется стабильностью фенолят-аниона, отрицательный заряд которого делокализуется по ароматическому кольцу вследствие +М эффекта.

 OH
OH 

 O + H+
O + H+
Br3C–CH2-OH |
Br3C CH2O + H+ |
Тиолы проявляют более сильные кислотные свойства по сравнению со спиртами благодаря большему размеру атома серы, в котором отрицательный заряд лучше делокализуется, стабилизируя тиолят-анион.
Карбоновые кислоты в данном ряду – самые сильные кислоты.
Это объясняется образованием стабильного карбоксилат-аниона при диссоциации карбоновых кислот. Карбоксилат-анион стабилизирован за счет делокализации отрицательного заряда по системе сопряжения:
O
R - C |
( ) |
|
|
|
O |
Изменение основности будет противоположно изменению кислотности. Чем выше основность, тем ниже кислотность.
Спирты
Производные углеводородов, в которых один или несколько атомов водорода замещены на ОН-группы, называют спиртами. Общая формула R-O-H.
Классификация:
1) по атомности – по количеству ОН-групп на одно- и многоатомные спирты; 2)по характеру радикала – предельные и непредельные; алифатические и
ароматические; 3) по характеру атома углерода, с которым связана ОН-группа, – первичные,
вторичные, третичные спирты.
Одноатомные спирты Изомерия 1) изомерия углеродного скелета;
2) изомерия по положению гидроксильной группы.
Некоторые представители
Формула |
ИЮПАК |
Тривиальная |
|
номенклатура |
номенклатура |
||
|
|||
СH3-ОH |
метанол |
метиловый спирт |
|
C2H5-OH |
этанол |
этиловый спирт |
|
CH3-CH2-CH2OH |
1-пропанол |
первичный пропиловый спирт |
|
СH3-CH-CH3 |
2-пропанол |
вторичный пропиловый спирт |
|
|
|
изопропанол |
|
OH |
|
|

26
- +
Физические свойства. Вследствие полярности О Н – связи и наличия диполя для спиртов характерно образование так называемых водородных связей (Н-связей). Н- связь – это связь по типу диполь-дипольного притяжения между электроотрицательным элементом одной молекулы (таким, как O, N, F, Cl, S), являющимся отрицательным концом диполя, и атомом водорода другой молекулы, являющимся положительным концом диполя. Эта связь слабая – 4–5 ккал/моль. Ее обозначают тремя точками. За счет Н-связи молекулы, способные к ее образованию, находятся в ассоциированном состоянии. Это объясняет повышенную температуру кипения и хорошую растворимость низкомолекулярных спиртов. С увеличением гидрофобного радикала R растворимость падает.
Химические свойства. Одноатомные спирты. Их химические свойства обуславливаются, главным образом, присутствием в них реакционноспособной гидроксильной группы. Реакции идут с разрывом связи либо R-OH (реакция SN), либо О-Н (кислотность).
1. При взаимодействии спиртов со щелочными металлами атомы водорода гидрокси-группы замещаются металлом с образованием алкоголята спирта:
2 С2Н5 ОН + 2Na 2C2H5ONa |
+ |
H2 |
алкоголят (этилат натрия) |
|
|
Алкоголяты спиртов легко разлагаются водой: |
|
|
2 C2H5 ONa + НОН С2Н5ОН + |
NaOH |
|
Эти реакции доказывают слабые кислотные свойства.
2. Спирты взаимодействуют с минеральными и органическими кислотами с образованием соответствующих сложных эфиров и воды:
СН3-СН2-ОН + HOSO3H H2O + CH3-CH2-O-SO3H
этилсульфат, этилсерная кислота, серноэтиловый эфир
O |
+ |
O |
||
|
|
|
Н |
|
СН3-СН2-ОН + HO C |
|
CH3 |
Н2О + |
C-CH3 |
|
||||
|
|
|
|
HO |
этилацетат 3. При действии на спирты водоотнимающих веществ происходит
межмолекулярное или внутримолекулярное отщепление воды. Водоотнимающими веществами являются кислоты (конц. H2SO4, H3PO4, щавелевая и др.), оксиды (оксиды алюминия, тория и др.), некоторые соли (сульфат меди, хлористый цинк и др.).
При межмолекулярной дегидратации спиртов получаются простые эфиры (R-O-R):
|
|
H2SO4, t° |
|
СН3-СН2-О- |
Н + НО |
–СН3 |
СН3-СН2-О-СН3 |
|
|
- Н2О |
метил-этиловый |
|
|
|
эфир |
В случае внутримолекулярной дегидратации спиртов, проходящей на тех же катализаторах, но при более высокой температуре, образуются непредельные углеводороды. При этом водород отщепляется от наименее гидрогенизированного атома

27
углерода, находящегося по соседству с углеродом, несущим гидроксильную группу (правило Зайцева):
ОН |
|
|
|
|
t° |
|
|
СН3-СН2-СН-СН3 |
СН3 -СН=СН-СН3 |
+ Н2О |
|
вторичный бутиловый |
2- бутен |
|
|
спирт |
|
|
|
Скорость выделения воды возрастает при переходе от первичных к третичным |
|||
спиртам; последние дегидратируются даже при простой перегонке. |
|||
4. Спирты при действии галогенопроизводных фосфора или галогеноводородов |
|||
превращаются в галогеноалканы: |
|
|
|
CH3-CH2-OH + PCl5 CH3-CH2-Cl + POCl3 |
+ HCl |
||
|
хлористый |
хлорокись |
|
|
этил |
фосфора |
|
3 СН3 – СН2-ОН + PCl3 3CH3-CH2-Cl + H3PO3 |
|||
Реакция спиртов с галогеноводородами обратима: |
|
||
СН3 – СН2-ОН + HCl |
CH3-CH2-Cl + H2O |
||
Алкилхлориды можно получить и при действии тионилхлорида на спирты:
С2Н5ОН + SOCl2 C2H5Cl + SO2 + HCl
5. Спирты окисляются кислородом воздуха в присутствии медных и других катализаторов при 300°–500°С, такими окислителями, как хромовая смесь, перманганат калия и др., а также дегидрируются при 100–180°С над Cu, Ag, Ni и т.д.
Во всех этих случаях первичные спирты дают альдегиды (при дальнейшем окислении – кислоты с тем же числом углеродных атомов), вторичные спирты – кетоны, которые могут быть окислены дальше до двух кислот с разрывом углеродной цепи:
|
каталитическое |
|
+ CH -C O |
|
|
|||||
|
|
|
Н2 |
|
|
|||||
|
|
|
|
|
||||||
|
|
|
|
|
3 |
|
|
|
|
|
|
|
дегидрирование |
|
альдегидH |
|
|
||||
СН3-СН2-ОН |
|
|
|
|
|
|
|
|
|
|
первичный |
|
|
|
|
|
|
|
|
|
|
спирт |
|
О2 |
|
|
O |
О |
O |
|||
|
|
|
Н2О + CH -C |
|
|
CH -C-OH |
||||
|
|
|
|
|||||||
|
|
|
|
3 |
H |
|
|
3 |
||
|
|
катализатор |
|
|
|
|
кислота |
|||
|
|
каталитическое |
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Н2 + CH3-C-CH3 |
|
|
|||||
|
|
|
|
|
||||||
|
|
дегидрирование |
|
|
кетон |
|
|
|
||
СН3-СН-СН3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
ОН |
|
О2 |
|
|
|
|
|
|
|
|
вторичный |
|
|
Н2О + CH -C-CH |
3 |
|
|||||
|
|
|
||||||||
спирт |
|
катализатор |
|
|
3 |
|
|
|
||
|
|
|
|
|
|
|
|
|
||
6. Замена гидроксила на аминогруппу: в жестких условиях (300°С, окись алюминия) гидроксильная группа может быть заменена на аминогруппу:
Al2O3
СН3-ОН + NH3 |
CH3–NH2 |
-H2O метиламин

28
Многоатомные спирты
Многоатомные спирты (гликоли, глицерины) хорошо растворимы в воде, имеют высокие температуры кипения, имеют сладкий вкус. В химические реакции вступают как одна, так и все гидроксильные группы, давая полные и неполные продукты реакции (см. «Одноатомные спирты»).
Увеличение числа гидроксильных групп усиливает кислотный характер. Поэтому многоатомные спирты образуют соли под действием не только щелочных металлов, но и гидроксидов тяжелых металлов. При этом образующиеся соли имеют комплексный
характер и называются «хелатами» («клешня краба»): |
H |
||||||
|
|
|
|
|
|
:O-CH2 |
|
СН2-О- |
Н НО |
|
HO–CH2 |
СH2-O |
|||
|
\CuOH |
|
Cu . |
||||
СН2-ОН |
|
|
H |
O-CH2 |
-2H2O CH2-O: |
O-CH2 |
|
|
|
|
|
|
|
H |
|
этиленгликоль |
гликолят меди |
||||||
При нагревании глицерина с водоотнимающими веществами (например, бисульфат калия) образуется простейший непредельный альдегид акролеин, обладающий острым неприятным запахом и раздражающим действием на слизистые оболочки глаз, носа и дыхательных путей:
|
CH2OH |
|
CH2 изомеризация |
CH |
|||
|
|
|
2 |
||||
|
|
C |
|
|
|
||
|
CHOH - 2 Н2О |
CH |
|||||
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
CH - OH |
|
|
|
||
CH2OH |
|
CHO |
|||||
|
|
|
|||||
глицерин |
|
|
|
акролеин |
|||
При действии галогенидов фосфора замещаются галогеном все три гидроксила:
СН2ОН |
СH2-Br |
|
|
|
|
|
|
СН – ОН + PBr3 |
CH-Br |
+ |
H3PO3 |
|
|
|
фосфористая |
СН2-ОН |
CH2-Br |
|
кислота |
1,2,3-трибромпропан
Из производных глицерина наибольший интерес представляет тринитроглицерин – сложный эфир (взрывчатое вещество, применяемое для изготовления динамита). В малых количествах оно используется как средство для расширения кровеносных сосудов сердца:
СН2-О-NO2
CH –O-NO2
CH2-O-NO2
Сложный эфир с высшими органическими кислотами представляет собой жир:
O
CH2-O-C-R1 |
|
|
|
O |
|
|
|
CH-O-C-R2 |
R1, R2, R3 |
– радикалы высших жирных кислот |
|
O |
|||
|
|
CH2-O-C-R3
29
Спирты высшей атомности
Четырех-(тетриты), пяти-(пентиты) и шестиатомные (гекситы) спирты могут быть
получены из простых сахаров при восстановлении. |
|
||
СH2-OH |
CH2OH |
CH2OH |
СН2ОН |
|
|
|
|
CH-OH |
H-C-OH |
H-C-OH |
Н-С-ОН |
|
|
|
|
CH-OH |
HO-C-H |
HO-C-H |
НО-С-Н |
|
|
|
|
CH2OH |
H-C-OH |
H-C-OH |
НО-С-Н |
|
|
|
|
|
CH2OH |
H-C-OH |
Н-С-ОН |
эритрит |
ксилит |
|
|
|
|
СН2ОН |
СН2ОН |
|
|
сорбит |
дульцит |
Эти спирты являются заменителями сахара при заболевании сахарным диабетом.
В составе животных организмов (печень, почки, мозг, мышцы и т.д.), а также ряде растений (бобы, горох и т.д.) содержится циклический шестиатомный спирт инозит
(циклогексангексол):
OH
HO OH
HO 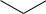 OH
OH
OH
Фенолы
Фенолы – гидроксилсодержащие ароматические соединения, в молекулах которых гидроксил связан непосредственно с углеродным атомом бензольного ядра. По числу гидроксильных групп различают одно-, двух- и многоатомные фенолы:
|
|
|
OH |
|
|
OH |
|
|
|
|
|
OH |
|
|
|
OH |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
HO |
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|
||
фенол |
о-крезол |
|
|
гидрохинон |
|
пирогаллол |
|||||||||||||||||||
(гидрокси- (2-гидрокси- |
|
|
(1,4-дигидрокси |
(1,2,3-тригидрокси- |
|||||||||||||||||||||
бензол) |
|
толуол) |
|
|
бензол) |
|
|
бензол) |
|||||||||||||||||
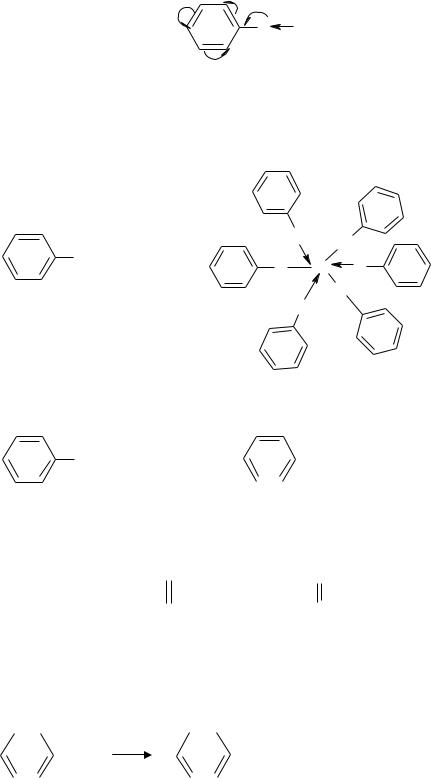
Изомерия 2-х атомных фенолов обусловлена взаимным расположением |
|||||||||||||||||||||||||
гидроксилов: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
OH |
|
|
|
|
HO |
|
|
|
|
|
|
OH |
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
HO |
|
|
|
|
|
||||
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
орто-изомер |
|
|
|
|
|
мета-изомер |
пара-изомер |
||||||||||||||||||
пирокатехин |
|
|
|
|
|
резорцин |
гидрохинон |
||||||||||||||||||
30
По своему строению фенолы аналогичны спиртам, однако гидроксильная группа и непосредственно связанное с ней бензольное ядро оказывают сильное влияние друг на друга.
С6Н5ОН Н2О С2Н5ОН
Более сильный кислотный характер фенолов по сравнению со спиртами объясняется влиянием бензольного ядра. Неподеленная пара электронов атома кислорода вступает в сопряжение с - электронами бензольного ядра. В результате электронная плотность кислородного атома смещается частично в сторону кольца, что сильнее поляризует связь О Н:
..
O H
Поэтому в отличие от спиртов фенолы вступают в реакцию с водными растворами щелочей, образуя феноляты. Они также взаимодействуют с гидроксидами тяжелых металлов, например с Fe(OH)3, с образованием «хелатов». Эту реакцию используют для качественного обнаружения фенолов:
|
|
|
OH |
O |
|
|
|
|
|
|
|
6 |
OH + FeCl3 |
O Fe |
O |
+ 3HCl |
|
|
|
|
|
||
|
|
|
|
O H |
|
|
|
|
HO |
|
|
Простые эфиры фенолов образуются аналогично простым эфирам спиртов:
ONa + CH3Cl |
|
|
|
O-CH3 |
+ NaCl |
|
|
|
|||
|
|
|
|
|
|
В отличие от спиртов фенолы не образуют сложных эфиров при непосредственном действии кислот. Обычно их получают при действии на фенолы хлорангидридами:
O |
O |
|
|
|
|
C6H5OH + Cl-C-CH |
3 |
|
|
C H -O-C-CH |
3 |
+ HCl |
|||||
|
|
|
|
|
|
|
|
|
|
|
6 |
5 |
|
||
|
|
|
|
|
|
хлорангидрид |
|
|
|
|
|||||
|
|
|
|
|
|
уксусной кислоты |
|
|
|
|
|||||
При перегонке фенолов с цинковой пылью гидроксильная группа |
|||||||||||||||
восстанавливается: |
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Zn |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
+ |
ZnO |
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
