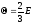- •Северо-казахстанский
- •Лабораторная работа № 1 изучение законов движения на машине атвуда
- •Теоретическая часть
- •Описание установки и метода измерений
- •Практическая часть
- •Бланк-отчёт.
- •Работа № 2. Изучение законов движения на машине Атвуда.
- •Теоретическая часть
- •Практическая часть
- •Расчётные формулы.
- •Расчётные формулы.
- •Расчётные формулы.
- •Вопросы к допуску
- •Контрольные вопросы
- •Лабораторная работа № 2 изучение закона динамики вращательного движения с помощью маятника обербека
- •Теоретическая часть
- •Описание установки
- •Описание метода измерений
- •Практическая часть
- •Вопросы к допуску
- •Контрольные вопросы
- •Лабораторная работа № 3 определение момента инерции металлических колец
- •Теоретиченская часть
- •Практическая часть
- •Бланк-отчёт.
- •Работа № 4. Определение момента инерции математических колец.
- •Теоретическая часть
- •Практическая часть
- •Результаты:
- •Вопросы к допуску
- •Контрольные вопросы
- •Лабораторная работа №4 определение молекулярной массы и плотности воздуха. Измерение вакуума, создаваемого насосом.
- •Теоретическая часть
- •Практическая часть
- •Задание 1
- •Определение молярной массы и плотности воздуха
- •Сущность метода и вывод расчётной формулы
- •Порядок выполнения работы
- •Задание 2 Измерение вакуума, создаваемого насосом
- •Контрольные вопросы
- •Вопросы к допуску
- •Литература:
- •Лабораторная работа № 5 определение постоянной больцмана.
- •Теоретическая часть
- •Экспериментальная часть Сущность метода и вывод расчётной формулы
- •Ход работы
- •Контрольные вопросы
- •Вопросы к допуску
- •Литература
Контрольные вопросы
Что показывает относительная молекулярная масса вещества?
Что называется молем вещества? Сколько частиц содержится в одном моле?
Что такое эффективная молекулярная масса?
Как можно рассчитать молярную массу смеси газов?
Сформулировать закон Дальтона.
Что показывает число Лошмидта?
Чему равна эффективная молярная масса смеси газов, состоящей из:
а) 75 г азота и 25 г кислорода?
б) 16 г водорода и 30 г гелия?
в) 18 г углекислого газа и 15 г азота?
г) 30 г азота и 40 г хлора?
д) 60 г кислорода и 30 г углекислого газа?
8.Вывести формулы: (16.13), (16.15), (16.16).
Вопросы к допуску
Вывести формулы расчёта погрешности измерений.
Как изменилось бы давление в сосуде с газом, если бы внезапно исчезли силы притяжения между его молекулами?
Сформулируйте основные положения молекулярно кинетической теории.
Можно ли при помощи насоса Комовского добиться полного вакуума в колбе?
Являются ли процессы, происходящие с газом в данной работе, действительно изотермическими? Почему?
Каков состав атмосферного воздуха?
Можно ли считать воздух при нормальных условиях идеальным газом? Ответ обосновать.
Все ли молекулы воздуха в комнате движутся с одинаковыми скоростями?
Почему в данном опыте используется тонкостенная колба? Зачем применяется защитный мешок?
Как определить цену деления и показания измерительного цилиндра?
Как устроен металлический манометр (вакуумметр)?
Задачи
1. Определить количество вещества, содержащегося в 1 л ртути.
2. Определить количество вещества, содержащегося в 5,6 дм3 кислорода при нормальных условиях.
3. Определить молярную массу воздуха, если при нормальных условиях плотности кислорода и воздуха соответственно равны 1,43 и 1,29 кг/м3.
4. Найти массу молекулы ацетилена С2Н2 и его плотность при нормальных условиях.
5. Найти массу молекулы и плотность метана СН4 при нормальных условиях.
6. Сколько молекул содержится в 6 г углекислого газа?
7. Определить массу молекулы пропана С3Н8 и его плотность при нормальных условиях.
8. Определить массу молекулы бутана С4Н10, если его плотность при нормальных условиях 2,67 кг/м3.
9. Плотности водорода и метана при нормальных условиях соответственно равны 0,09 и 0,72 кг/м3 . Определить молярную массу метана, если для водорода она равна 2х10-3 кг/ моль.
10. Определить количество вещества, содержащегося в 1 л воды.
Литература:
Сивухин Д. В. Общий курс физики. т.2 М.: Высшая школа, 1998,. п.106-109
Савельев И.В. Курс физики. т.1. М.: Наука, 1989, п.91-92
Трофимова Т.И. Курс физики. М.: Высшая школа, 2003. п.66-69
Лабораторная работа № 5 определение постоянной больцмана.
Цель: определение постоянной Больцмана опытным путем.
Оборудование сосуд большого объема, закрытый пробкой, шприц, легко испаряющееся вещество (эфир)
Теоретическая часть
Согласно основному уравнению молекулярно-кинетической теории,
|
|
(20.1) |
где р - давление газа на стенки сосуда,
v2 - среднее значение квадрата скорости молекул
n - концентрация молекул (число молекул в единице объема ).
Давление р может быть измерено манометром. Уравнение (20.1) связывает, таким образом, макроскопическую величину р с микроскопическими величинами, характеризующими молекулы.
Обозначим Е среднюю кинетическую энергию поступательного движения молекулы:
|
|
|
Тогда уравнение (20.1) можно записать в форме:
|
|
(20.2) |
При
тепловом равновесии, когда давление
газа данной массы и его объем постоянны,
средняя кинетическая энергия молекул
газа должна иметь строго определенное
значение, как и температура. Так как
концентрация молекул газа
 ,
,
то из уравнения (20.2) вытекает:
|
|
(20.3) |
В состоянии теплового равновесия средние кинетические энергии всех молекул газа одинаковы. Таким образом, средняя кинетическая энергия Е поступательного движения молекулы газа обладает основным свойством температуры: в состоянии теплового равновесия она одинакова для всех молекул газов, находящихся в тепловом контакте, а также для различных молекул газовой смеси. Она не зависит от массы и внутренней структуры молекулы. Поэтому величину Е или любую монотонную ее функцию можно принять за меру температуры газа, а также тела, находящегося с ним в тепловом равновесии. Удобно за меру температуры принять величину
|
|
(20.4) |
Тогда из (20.3) и (20.4) следует, что
|
|
(20.5) |
Величина, определяемая формулой (20.5),называется энергетической (кинетической) температурой. Она измеряется в тех же единицах, что и энергия (в СИ-Джоуль, в СГС-эрг).
Вместо
температуры
введем температуру, измеряемую в
градусах. Можно показать, что есть универсальная постоянная,
зависящая только от выбора единиц q и
Т. Она называетсяпостоянной
Больцмана
и является одной из важнейших
фундаментальных
есть универсальная постоянная,
зависящая только от выбора единиц q и
Т. Она называетсяпостоянной
Больцмана
и является одной из важнейших
фундаментальных
постоянных физики. Эту величину принято обозначать k. Таким образом,
|
= k T |
(20.6) |
где Т - абсолютная температура.
Сопоставив (20.5) и (20.6), получим:
|
|
(20.7) |
Используя (20.3), имеем:
|
|
(20.8) |
Согласно (20.8), при одинаковой абсолютной температуре кинетические энергии, обусловленные перемещением молекул, будут одинаковыми даже у молекул, сильно различающихся своей массой. Процесс выравнивания температуры, который имеет место при соприкосновении или смешивании холодного газа с газом нагретым, представляет по существу процесс выравнивания средних кинетических энергий поступательного движения молекул. По современным данным,
k=(1,38062+0,00006)х10-23Дж/К.
Если в сосуде объемом V находится смесь отдельных газов, то общая кинетическая энергия молекул газовой смеси равна сумме кинетических энергий молекул отдельных компонентов смеси:
Е К = ЕК1 +ЕК2 + ...
Умножим
обе части этого равенства на ,
получим:
,
получим:
|
|
(20.9) |
Сравнив
(20.9)
и
(120.3), увидим,
что выражение
 -
общее давление газовой смеси р, a
-
общее давление газовой смеси р, a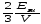 - соответствует тому давлению рi,
которое оказывал бы i-й газ, входящий
в состав газовой смеси, если бы он
занимал весь объем V. Это давление
называют парциальным
давлением
i-го компонента газовой смеси. Физический
смысл
выражения (20.9)
заключается, таким образом, в утверждении,
что общее давление, оказываемое на
стенки сосуда смесью нескольких газов,
равно сумме парциальных давлений
отдельных компонентов смеси. Этот
важный физический закон был открыт
эмпирически Д. Дальтоном и носит его
имя.
- соответствует тому давлению рi,
которое оказывал бы i-й газ, входящий
в состав газовой смеси, если бы он
занимал весь объем V. Это давление
называют парциальным
давлением
i-го компонента газовой смеси. Физический
смысл
выражения (20.9)
заключается, таким образом, в утверждении,
что общее давление, оказываемое на
стенки сосуда смесью нескольких газов,
равно сумме парциальных давлений
отдельных компонентов смеси. Этот
важный физический закон был открыт
эмпирически Д. Дальтоном и носит его
имя.




 ,
или
,
или