
- •Работа № 3 Изучение равновесия в гетерогенных системах
- •1. Правило фаз
- •2. Гетерогенное равновесие в бинарных системах, содержащих жидкую и твердую фазы. Диаграммы состояния.
- •3. Методы изучения гетерогенных систем
- •4. Диаграмма состояния неизоморфной бинарной системы с простой эвтектикой
- •Экспериментальная часть
- •Последовательность выполнения работы
- •Литература:
В гетерогенных
системах возможны как переходы веществ
из одной фазы в другую (агрегатные
превращения), так и протекание химических
реакций. Равновесию в таких системах
отвечает равенство химических потенциалов
каждого компонента во всех фазах, а
также минимальное значение
термодинамического потенциала при
соответствующих условиях, например,
при постоянстве температуры и давления
во всех точках системы изобарного
потенциала G=0иG=Gmin.
Такое равновесие
математически выражается уравнением
Гиббса, которое называют “правилом
фаз”. Прежде чем записать это уравнение,
дадим определение некоторых понятий.
Составляющими
веществаминазывают вещества, из
которых состоит система и которое можно
выделить в свободном виде.
Если в системе не
протекает химическая реакция, то состав
фаз при равновесии определяется
концентрациями всех составляющих
веществ. Если же в системе идут химические
реакции, то количество составляющих
при равновесии зависит друг от друга
и они связаны между собой стехиометрическими
уравнениями химических реакций.
В последнем случае
для определения состава фаз, находящихся
в равновесии, необходимо знать
концентрации только части составляющих
веществ, являющихся независимыми
составляющими. Независимые составляющие
системы называют компонентами.
Из этого следует
вывод о том, что число компонентов (k)равно числу составляющих системы минус
число связей (например, химических
реакций) между ними.
Фазой
называют, обычно, однородную
(гомогенную) часть гетерогенной системы
одинаковую во всех точках по составу,
химическим и термодинамическим свойствам
и имеющую видимые поверхности раздела.
Частицы, составляющие фазу, должны
иметь достаточно большой объем, для
того, чтобы определять термодинамические
свойства фазы.
Независимыми
переменными, определяющими равновесие
в гетерогенной системе, являются, обычно
температура, давление, концентрации
компонентов.
Таким образом,
число параметров состояния, которые
можно произвольно менять без нарушения
фазового равновесия в системе, называется
числом степеней свободы (f).
Число степеней
свободы иногда называют вариантностью
системы.
Различают системы:
нонвариантные (инвариантные), где f=0,
одновариантные -f=1, двухвариантные
-f=2 и т.д.
Уравнение правила
фаз Гиббса имеет вид:
f + Ф = k
+2 или f = k + 2 - Ф,
где f–
число степеней свободы,k– число
компонентов,Ф – число фаз в системе,2 – относится к двум независимым
переменным, например, к температуре и
давлению.
Следовательно,
в равновесной гетерогенной термодинамической
системе, на которую из внешних факторов
влияют только температура и давление,
число степеней свободы равно числу
компонентов плюс два, минус число фаз.
Но иногда равновесие
в гетерогенной системе определяется
не только температурой и давлением, но
и, например, электрическим потенциалом.
Тогда число независимых переменных
будет равно трем и уравнение Гиббса
запишется:
f = k + 3 -
Ф
Наоборот, в ряде
систем независимой переменной может
оказаться только температура
(концентрированные системы) и тогда
уравнение Гиббса примет вид:
f = k + 1 -
Ф
и такая вариантность
системы называется условной.
Если два твердых
вещества смешать друг с другом в
определенных пропорциях и смесь нагреть
до высокой температуры, то, как правило,
образуется однородная жидкость,
представляющая собой раствор одного
компонента в другом. Если такой раствор
или расплав охладить, то при некоторой
температуре он начинает кристаллизоваться,
поскольку растворимость веществ с
понижением температуры уменьшается.
При кристаллизации
жидких систем могут выделяться как
чистые компоненты и образуемые ими
химические соединения, так и твердые
растворы на основе чистых компонентов
и их соединений.
В зависимости от
того какая фаза выделяется из раствора,
двухкомпонентные системы с неограниченной
взаимной растворимостью компонентов
в жидком состоянии могут быть разделены
на следующие типы:
1) без химических
соединений и твердых растворов;
2) с образованием
устойчивого химического соединения
(плавящихся конгруэнтно, т.е. без
разложения);
3) с образованием
неустойчивого химического соединения
(плавящихся инконгруэнтно;
4) с неограниченной
растворимостью компонентов в твердом
состоянии;
5) с ограниченной
растворимостью компонентов в твердом
состоянии.
Каждая фаза
двухкомпонентной системы может быть
охарактеризована тремя переменными:
температурой Т, давлением Р и концентрацией
ходного из компонентов, выраженных
в молярных долях. Для графического
изображения функцииf(T,P,x)
необходима система координат в
пространстве трех измерений. Откладывая
по трем взаимно перпендикулярным осям
экспериментальные значения температур,
давлений и концентраций, можно построить
полную диаграмму состояния данной
системы. Однако построение полных
диаграмм состояния сопряжено с большими
экспериментальными трудностями и пока
осуществимо лишь для немногих систем.
Если система конденсирована, то небольшие
изменения давления мало отражаются на
равновесии. Поэтому при исследовании
конденсированных систем при атмосферном
давлении можно без ощутимой погрешности
принять давление постоянным. Если
рассматривать свойства системы при
Р=const и выбрать это давление большим,
чем давление насыщенных паров смесей
любого состава, то в системе не будет
газообразной фазы. Число переменных
уменьшается до двух. Графически
зависимость между ними может быть
выполнена в координатах Т –х.
Построенную диаграмму называютдиаграммой состояния(диаграммой
плавкости).
Диаграммой
состояния изображают равновесия между
всеми жидкими и твердыми фазами,
образуемыми компонентами системы при
различных концентрациях и температурах
и постоянном давлении. При построении
этих диаграмм системы изучаются во
всем интервале концентраций, т.е. от
чистого вещества Адо чистого
веществаВ. Интервал температур, в
котором проводится исследование,
выбирается так, чтобы на диаграмме
отражалось как равновесие жидких фаз
с другими жидкими и твердыми фазами,
так и превращения, протекающие в системе
ниже температуры ее полного затвердевания.
К методам,
применяемым для построения диаграмм
состояния, относятся методы растворимости,
термического анализа, определения
микроструктуры, рентгено-, электронно-
и нейтронографии.
Метод растворимости
основан на достижении состояния
равновесия и аналитическом определении
состава жидкой фазы, находящейся при
постоянной температуре в равновесии
с твердой фазой, и состава твердой фазы,
выделенной из жидкости. По полученным
данным строят диаграммы растворимости
в координатах температура - состав
насыщенных растворов.
Метод термического
анализа является способом установления
температур при равновесии между жидкими
и твердыми фазами, который не требует
ни механического разделения, ни
химического анализа. Методы термического
анализа в основном различаются способами
регистрации температурных изменений,
соответствующих фазовым переходам.
Основные способы:
1) визуальный, при
котором отмечается температура появления
(или исчезновения) кристаллов в прозрачном
растворе;
2) построение
кривых охлаждения (или нагревания).
В способе построения
кривых через небольшие промежутки
времени измеряют с помощью термометра
или термопары температуру охлаждающейся
системы. Результаты измерений наносят
на график, откладывая по оси абсцисс
время, а по оси ординат – температуру.
Запись изменения температуры со временем
может быть осуществлена автоматически.
Если при непрерывном изменении
температуры система не претерпевает
никаких фазовых превращений,
сопровождающихся выделением или
поглощением теплоты, то ее температура
является непрерывной функцией времени.
Поэтому зависимость температуры системы
от времени изображается непрерывной
кривой (рис.1, кривая 1). Если же при
охлаждении в системе происходят
какие-либо превращения, например
выпадение твердой фазы из жидкости,
переход одной полиморфной модификации
в другую, то теплота, выделяющаяся при
превращении, изменяет скорость падения
температуры системы, что выражается
изменением углового коэффициента
кривой температура – время. Поэтому в
промежутки времени, отвечающие
температурам фазовых превращений, на
кривых температура – время появляются
изломы или горизонтальные участки,
которые позволяют определять температуры
превращений, не видя и не выделяя фаз,
образующихся или исчезающих при
охлаждении системы.
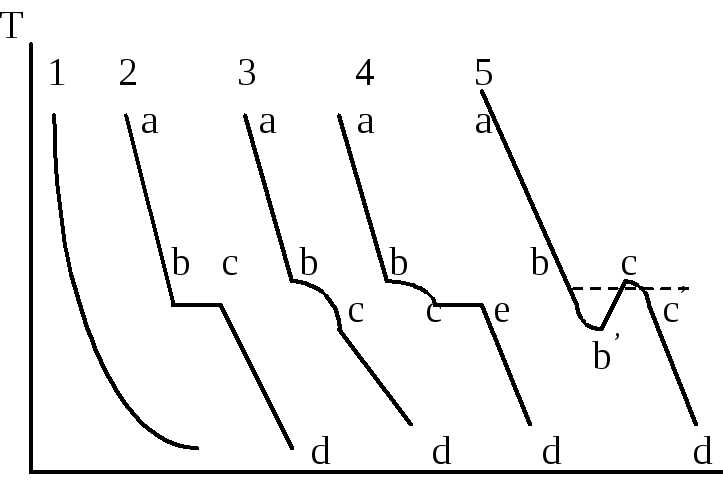
Если какое-либо
чистое вещество (металл, соль, органическое
соединение) нагреть до температуры в
точке а, лежащей выше точки его
плавления, а затем записывать кривую
охлаждения, то в начале падения
температуры от времени будет выражаться
плавной кривойаб(кривая 2). В
некоторый момент времениt1в точкебпонижение температуры
прекратится. На кривой появляется
горизонтальный участокбс.
Это указывает на
то, что в системе происходит процесс,
сопровождающийся выделением теплоты.
На горизонтальном участке бсскорость охлаждения становится равной
нулю и сохраняет это значение до времениt2, начиная с которого
кривая вновь плавно идет вниз до
температуры в точкеd, при
которой запись кривой охлаждения
прекращается. Появление горизонтального
участкабсобъясняется тем, что
происходит переход вещества из жидкого
состояния в твердое.
Время
Рис. 1. Кривые
охлаждения: 1-при
отсутствии фазовых превращений; 2-кристаллизация
при постоянной температуре; 3,4-кристаллизация
в температурном интервале; 5-кристаллизация
с переохлаждением
Выделяющаяся при
этом теплота кристаллизации возмещает
потерю теплоты в окружающую среду,
вследствие чего до окончания затвердевания
температура держится на одном уровне.
Из правила фаз следует, что при постоянном
давлении чистое вещество, распределенное
между двумя фазами (твердой и жидкой),
не имеет ни одной степени свободы, т.е.
кристаллизация протекает при постоянной
температуре. (Ф=2, k-1,f
=k+1-Ф = 0).
Рассмотрим
двухкомпонентные системы, когда на
кривой охлаждения имеется одна
горизонтальная остановка. Из привила
фаз следует, что если при постоянном
давлении в системе из двух компонентов
в равновесии находятся три фазы, то
система не имеет ни одной степени
свободы (Ф=3, k -2, f = k +1-Ф = 0). Таким
образом, горизонтальный участок на
кривой охлаждения двухкомпонентной
системы указывает на то, что при
температурной остановке в равновесии
находятся три фазы (две твердые и одна
жидкая). Если кристаллизующаяся твердая
фаза (твердый раствор, чистый компонент
или определенное соединение) отличается
по составу от существующей с не жидкости,
то при охлаждении жидкой фазы от
начальной температуры в точкеадо температуры начала кристаллизации
в точкеб(кривая 3) кривая
охлаждения плавно идет вниз. В момент
появления твердой фазы, вследствие
выделения теплоты кристаллизации,
скорость охлаждения уменьшается.
Поэтому на кривой охлаждения в точкебпоявляется излом, отвечающий
температуре начала кристаллизации.
При этом число степеней свободы
уменьшается на единицу, система из
дивариантной становится моновариантной.
Если на протяжении всего процесса
кристаллизации в равновесии с жидкой
находится только одна твердая фаза, то
затвердевание заканчивается при
температуре в точкес. Наблюдаемый
при этой температуре второй излом на
кривой охлаждения отвечает полному
исчезновению жидкой фазы и, следовательно,
приобретению одной степени свободы,
система из моновариантной становится
дивариантной. Однако если в конце
кристаллизации появляется еще одна
твердая фаза, кроме той, которая
выделилась первично, то система теряет
еще одну степень свободы и затвердевание
заканчивается инвариантным равновесием,
которому отвечает горизонтальный
участоксе(кривая 4). По окончании
затвердевания система, состоящая из
двух твердых фаз, имеет одну степень
свободы, охлаждение ее идет по плавной
кривой и заканчивается при температуре
в точкеd.
Система, отдавая
теплоту окружающей среде, проходит ряд
последовательных состояний равновесия
и ее температура во всех точках одинакова.
Однако на практике эти условия никогда
не могут полностью соблюдены, и
экспериментально получаемые кривые
охлаждения всегда в той или иной мере
откланяются от идеального хода. Одной
из наиболее частых причин таких
отклонений является переохлаждение.
При переохлаждении температура в точке
аплавно падает ниже точки
равновесной кристаллизацииб´.
В точкеб´наблюдается неустойчивое переохлаждение
системы и поэтому вследствие
самопроизвольного возникновения центра
кристаллизации начинается выпадение
твердой фазы. Выделяющаяся теплота
быстро повышает температуру, которая
при благоприятных условиях (больших
теплоте кристаллизации и скорости
роста кристаллов) поднимается до
температуры равновесной кристаллизации,
отвечающей остановкебсна
кривой 5. При малой скорости кристаллизации
температура может и не достигнуть
уровня горизонтального участкабс(кривая 5).
Кроме переохлаждения
одной из причин отклонения кривых
охлаждения от идеального хода является
неравномерность распределения
температуры по объему застывающей
среды. Вследствие температурного
градиента линии бсотклоняются
от горизонтального направления вниз.
Поэтому на кривых охлаждения систем,
затвердевающих в некотором температурном
интервале, излом, отвечающий температуре
конца затвердевания, нередко бывает
выражен нечетко. Более достоверные
данные получают с помощью кривых
нагревания, так как твердое кристаллическое
вещество нельзя перегревать выше
температуры начала его плавления. На
основании кривых охлаждения строятся
диаграммы зависимости температуры
того или иного фазового перехода от
состава системы. На основании этих
диаграмм делается заключение о характере
химического взаимодействия между
компонентами системы.
Наряду с методами
термического анализа для построения
диаграмм состояния используется метод
микроструктуры, который заключается
в том, что соответствующим образом
подготовленный образец рассматривается
под микроскопом. Микроскопическое
исследование позволяет установить
число и взаимное расположение фаз и
последовательность кристаллизации в
системе. Сопоставляя эти данные с
полученными методами термического
анализа, можно проверить и дополнить
заключения о характере взаимодействия
компонентов системы и границах фазовых
областей.
Если вещества А
и В неограниченно растворимы в жидком
состоянии, не образуют химических
соединений, не претерпевают полиморфных
превращений и кристаллизуются из
жидкости в виде чистых компонентов, то
их кривые охлаждения и диаграммы
состояния (плавкости) имеют вид,
представленный на рис.2.
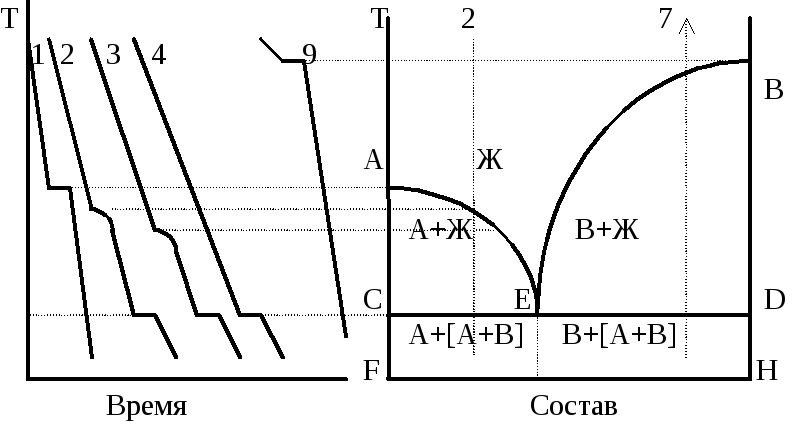
Системы, лежащие
выше линий АЕ и ВЕ, дивариантны, так как
здесь два компонента и одна жидкая
фаза. Кривые АЕ и ВЕ называются кривыми
ликвидуса. На этих кривых системы
моновариантны. Прямая СD называется
линией солидуса. В точке пересечения
кривых ликвидуса Е оба твердых компонента
находятся в равновесии с жидким расплавом
состава, отвечающего точке Е. Рис.
2. Диаграмма плавкости неизоморфной бинарной
смеси
Ниже температуры
точки Е (ниже линии СD) могут существовать
только смеси твердых компонентов. Среди
всех сочетаний компонентов А и В расплав
состава, отвечающего точке Е, имеет
наиболее низкую температуру кристаллизации.
Точка Е называется эвтектической,
а отвечающая ей смесь кристаллов А и В
-эвтектической смесьюилиэвтектикой.
Эвтектика –
состав из двух (или нескольких)
компонентов, имеющий определенную
характерную структуру, образующий при
плавлении расплав, насыщенный относительно
всех входящих в него компонентов.
Составные части
эвтектики хорошо видны под микроскопом
и могут быть отделены друг от друга
механическим путем или с помощью
растворителей.
В эвтектической
точке Е и по всей линии СD (кроме крайних
точек) система инвариантна, здесь три
фазы: две твердые (А и В) и одна жидкая
(эвтектического состава). Область,
лежащая ниже эвтектической температуры,
отвечает твердым смесям кристаллов А
и В, причем область АСЕG - смесям кристаллов
А + эвтектика, область EDHG - смесям
кристаллов В + эвтектика. Системы
удовлетворяют условиям равновесия
между фазой из чистого компонента и
фазой раствора (рис.2).
Рассмотрим процессы
охлаждения некоторых смесей и чистых
компонентов.
Точка 1.Система
выше точки А одновариантна, происходит
непрерывное понижение температуры по
закону Ньютона:
dT/dt = K (Тсис
- Токр. ср.).
Появление в точке
А твердой фазы делает систему инвариантной.
Это отвечает температурной остановке,
затем идет опять охлаждение по закону
Ньютона; так же ведет себя система,
определяемая точкой 9.
Точка 2.Система
выше точки Г двухвариантна, т.е. для
характеристики подобной системы
необходимо фиксировать температуру и
состав. В точке Г начинается кристаллизация
вещества А. Выделение теплоты
кристаллизации замедляет охлаждение
системы. По мере увеличения количества
твердого вещества А расплав обогащается
веществом В, вследствие чего температура
кристаллизации непрерывно понижается.
Соотношение между количествами твердой
и жидкой фаз определяется по правилу
рычага. Поскольку с момента образования
твердой фазы система стала одновариантной,
то между температурой и составом
насыщенных растворов будет существовать
зависимость, которая и выражается
кривой АЕ. Следовательно, отмечая
температуру начала кристаллизации,
тем самым устанавливают состав; наоборот,
каждому составу отвечает единственная
температура равновесия твердое вещество
А - расплав. По достижении температуры
эвтектики расплав будет насыщен обоими
веществами; появляется новая фаза -
твердое вещество В, и система становится
инвариантной. При температуре эвтектики
оба вещества выпадают в соотношении,
отвечающем составу оставшейся жидкости,
поэтому жидкость кристаллизуется без
изменения состава. Кристаллизация
эвтектического расплава изменяет
состав твердой массы, так как последняя
пополняется не только веществом А, но
и веществом В. При исчезновении последней
капли жидкости состав твердой массы
совпадает с составом исходного расплава.
После этого температура начинает
падать, так как с исчезновением жидкости
система становится одновариантной.
Для точки 2 показаны процесс охлаждения,
по линии ликвидуса - изменение состава
жидкой фазы, по линии солидуса - изменение
состава твердой массы. Твердая масса
состоит из двух фаз: компонента А и
компонента В. Для смеси 7 показан процесс
нагревания.
Точка 4.Оба
вещества будут кристаллизоваться
одновременно, и длительность эвтектической
остановки и тем самым величины
горизонтального участка на кривой
охлаждения будут максимальными.
Процессы охлаждения
смесей, указанных точками 3, 5, 6, 7, 8,
аналогичны процессу охлаждения смеси
точки 2. В смеси состава точки 3
первоначально кристаллизуется компонент
А; в смесях 5 - 8 - компонент В.
В данной работе
следует ознакомиться с методам
термического анлиза и микроструктуры,
а также построением диаграммы плавкости
системы, компоненты которой практически
нерастворимы друг в друге в твердом
состоянии.
Измерение
температуры при работе с солевыми или
металлическими сплавами (имеющие
высокие температуры плавления)
производится при помощи термопары,
которая состоит из двух тонких
металлических проволок, например медной
и константановой, спаянных на конце и
изолированных друг от друга фарфоровой
трубкой. Термопару помещают в фарфоровый
тигель с расплавом так, чтобы спай не
касался дна тигля и присоединяют к
электронному потенциометру ЭПП-09
(самописцу), позволяющему автоматически
регистрировать кривые охлаждения.
Внимание!
Перед началом работы включить самописец
и печь!
1. Ознакомиться с
инструкцией электронного автоматического
самописца ЭПП-09.
2. В фарфоровые
тигли, помещенные на специальной
подставке, поместить навески по 10 г
следующего состава:
1)
100%
(10 г) Pb
5)
40% (
4 г) Pb - 60%
(6 г) Sn 2)
90% (
9 г) Pb - 10%
(1 г) Sn 6)
20% (
2 г) Pb - 80%
(8 г) Sn 3)
80% (
8 г) Pb - 20%
(2 г) Sn 7)
10% (
1 г) Pb - 90%
(9 г) Sn 4)
70% (
7 г) Pb - 30%
(3 г) Sn 8)
100%
(10 г) Sn
3. Тигли с исследуемыми
металлами и смесями поставить в нагретые
печи, прикрыть асбестовым полотном и
расплавить до полного исчезновения
кристаллов. Перемешать расплав стеклянной
палочкой.
4. После расплавления
смесей и металлов быстро и осторожно
пинцетом перенести первый тигель на
асбестовый лист штатива с укрепленной
термопарой и аккуратно опустить спай
термопары в расплав, следя за тем, чтобы
термопара не касалась дна и стенок
тигля. При этом перо самописца должно
быть опущено на лист диаграммы и
отклониться до цифры 90 на его шкале.
Одновременно включить тумблер
“диаграмма” на самописце и записать
кривую охлаждения. Для чистых веществ
(Pb и Sn) запись кривых охлаждения прекратить
после температурной остановки, отвечающей
кристаллизации металлов, а для смесей
вслед за отвердеванием эвтектики.
Затем, выключить
диаграмму, тигель с термопарой снова
перенести в печь, и, после расплавления
металла, термопару аккуратно извлечь
из тигля, а тигель пинцетом перенести
на специальную подставку в отверстие
с соответствующей меткой.
5. Аналогично
проводят опыты со всеми остальными
навесками. Если изломы на кривых
охлаждения получаются нечеткие, то
охлаждение следует замедлить. Для этого
тигель оставляют в печи, но не в гнезде,
а сверху.
6. На основании
полученных кривых охлаждения определяют
показания по шкале самописца, отвечающие
кристаллизации металлов и эвтектики
(характерные точки), которые сводят в
таблицу.
№ тигля 1 2 3 4 5 6 7 8 Состав,
масс.% Pb 100 90 80 70 40 20 10 0 Состав,
масс.% Sn 0 10 20 30 60 40 90 100 Показания
по шкале самописца
Температура
кристаллизации, 0С
На кривых охлаждения,
как уже отмечалось, температура
кристаллизации соответствует площадке
для чистых компонентов и излому для
смеси. Появление второй площадки
соответствует затвердевания эвтектики.
7. Для построения
диаграммы состояния системы необходимо
найти температуры плавления,
соответствующие показателям самописца.
Для этого в горячую печь помещают тигель
со сплавом Вуда, закрывают асбестом и
нагревают примерно до 320 - 330° С. Осторожно
над печью нагревают термометр до 200° С
и поместить вместе с термопарой в сплаве
Вуда так, чтобы термометр и термопара
были погружены в одном месте и не
касались дна и стенок тигля. При этом
каретка самописца должна сместиться
вправо и находиться вблизи цифры 100.
Если каретка стоит левее, необходимо
больше нагреть сплав Вуда. После
установки каретки на нужное деление,
асбестовое полотно снимают, печь
отключают и градуируют термопару. При
этом один из студентов следит за
показаниями на шкале самописца, а другой
за температурой, отмечая значения
температур, соответствующих характерным
точкам на кривых охлаждения.
8. На основании
полученных данных построить диаграмму
состояния системы Pb – Sn в координатах
температура-состав. Определить фазовое
состояние системы в различных областях
диаграммы.
Курс физической
химии (под.ред. Я.И Герасимова) М., Химия
Кудряшов И.В.,
Каретников Г.С. Сборник примеров и
задач по физической химии М., Высш.шк.,
1991
Краткий курс
физической химии. Учеб.пособие для
вузов под ред. Кочергина С.М., Добренькова
Г.А. и др. М., Высш.школа., 1978 г., 312 с.
16Работа № 3 Изучение равновесия в гетерогенных системах
1. Правило фаз
2. Гетерогенное равновесие в бинарных системах, содержащих жидкую и твердую фазы. Диаграммы состояния.
3. Методы изучения гетерогенных систем
4. Диаграмма состояния неизоморфной бинарной системы с простой эвтектикой
Экспериментальная часть
Последовательность выполнения работы
Литература:
15
2
3
14
4
13
5
12
6
11
7
10
8
9
