
- •3. Класифікація хімічних реакцій та реагентів. Взаємний вплив атомів в органічних сполуках
- •1. Класифікація органічних реакцій за типом перетворень органічних сполук:
- •2. Класифікація органічних реакцій за типом розриву хімічних зв’язків.
- •3. Класифікація органічних реакцій за типом взаємодіючих реагентів.
- •4. Взаємний вплив атомів в молекулах.
- •Література до теми лекції.
- •1. Самостійна робота.
- •2. Основна література.
- •3. Додаткова література.
3. Класифікація органічних реакцій за типом взаємодіючих реагентів.
Всі реакції, що відбуваються за вільнорадикальним або іонним (нуклеофільним і електрофільним) механізмами можна навести наступними загальними схемами:
|
| |||||
|
|
субстрат |
реагент |
|
продукти реакції |
|
Взаємодіючі речовини поділяють на субстрати та реагенти. Такий розподіл є досить умовний, але субстратом, як правило, виступає молекула, яка постачає атом карбону для утворення нового зв’язку. В залежності від природи реагента (атакуючої частинки) всі реакції поділяються на нуклеофільні, електрофільні та радикальні.
Нуклеофільні (І) – це реакції, в яких реагентом виступає нулкеофіл (В–), що має негативний заряд та хоча б одну неподілену електронну пару. Ця пара електронів утворює ковалентний зв’язок з атомом, з яким вона вступає в реакцію. Умовно всі нуклеофіли можна розділити на три групи:
аніони:
 та інші;
та інші;сполуки з вільними парами електронів:
 та інші;
та інші;ненасичені сполуки з -електронами: алкени, алкіни, дієни, арени.
Нуклеофльні реакції позначаються символом N.
Електрофільні реакції (ІІ) – це реакції, в яких реагентом виступає електрофіл (Е+), що має позитивний заряд і вакантну (вільну) орбіталь або високу спорідненість до електрона. Ця вільна орбіталь бере участь в утворенні ковалентного хімічного зв’язку з атомом, з яким вона вступає в реакцію. Всі електрофільні реагенти умовно можна розділити на три групи:
катіони:
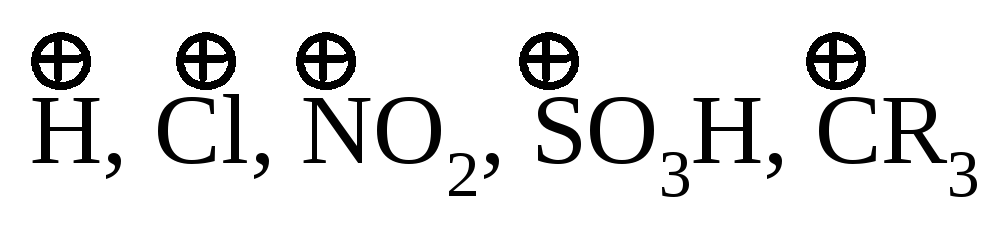 та інші;
та інші;сполуки з вільними вакантними орбіталями:
 –
кислоти Люїса,
–
кислоти Люїса,  та інші;
та інші;сполуки з полярними зв’язками, в яких на атомі карбону існують ефективні позитивні заряди: нітрили R–CN, карбонільні сполуки RCX=O та інші.
Електрофільні реакції позначаються символом Е.
Радикальні
реакції (ІІІ) – це
реакції, в яких реагентом виступає
радикал (R),
що не має заряду, але має неспарений
електрон на атомній орбіталі. Цей
неспарений електрон утворює ковалентний
зв’язок з атомом, з яким він вступає в
реакцію. Найбільш поширені радикали
можна навести наступним рядом: ![]() (радикали наведено в послідовності
зменшення їх стійкості).
(радикали наведено в послідовності
зменшення їх стійкості).
Радикальні реакції позначаються символом R.
4. Взаємний вплив атомів в молекулах.
Взаємний вплив атомів в органічних молекулах визначається розподілом електронної густини в молекулі та поляризовністю ковалентних зв’язків. У більш загальному вигляді це підпорядковується фундаментальній залежності органічної хімії – „структура – хімічна активність”, яка дозволяє в якісному співвідношенні оцінити реакційну здатність органічних молекул, виходячи з їх будови, та передбачити хід і результати хімічних перетворень. В молекулах органічних речовин під впливом наявних в них різних за своєю природою атомів або атомних груп відбувається перерозподіл електронної густини хімічних зв’язків двох ефектів: індукційнго (по -зв’язку) та мезомерного (по -зв’язку).
4.1. Індукційний ефект – це зміщення електроної густини -зв’язку в напрямку більш електронегативного атома (І-ефект).
|
|
В молекулі н-бутана зв’язок С–Н практично не полярний, а симетричний розподіл електронної густини показує на відсутність дипольного момента. |
|
1-хлорбутан, 0 –І-ефект |
У випадку заміщення атома гідрогена на більш електронегативний атом хлора електронна густина зв’язку СCl зміщується до хлора, тому хлор має частковий електронегативний заряд (-), а сусідній атом карбону (+). Це, в свою чергу, викликає перерозподіл електронної густини у ланцюгу |
С1С2С3С4; при цьому частковий позитивний заряд на атомах карбону зменшується у такій послідовності: +>++>+++>++++. Практично дія індуктивного ефекту „затухає” на третьому атомі карбону. Відносно н-бутил-радикала атом хлора, який притягує до себе електронну пару, проявляє –І-ефект. Такий же –І-ефект будуть мати наступні замісники (акцептори електронів):
всі атоми галогенів F > Cl> Br > I (галогени наведено в послідовності зменшення їх –І-ефекту;
всі ненасичені замісники, –І-ефект яких зменшується по мірі зменшення ступеню ненасиченності:

групи атомів з повним позитивним зарядом на атомі, сполученому з атомом карбону:

групи атомів з семиполярним зв’язком –C–NO2, а також з подвійними зв’язками CR=O > CR=NR;
|
бутиллітій, 0 +І-ефект |
У випадку заміщення атома гідрогена на більш електропозитивний атом літію електронна густина зв’язку СLi зміщується до атома карбону, тому літій має частковий позитивний заряд (+), а сусідній атом карбону (-). При цьому перерозподіл електронної густини у ланцюгу С1С2С3С4 |
(із її збільшенням) принципово не відрізняєтся від раніше розглянутого приклада із 1-хлорбутаном; частковий позитивний заряд на атомах карбону збільшується у такій послідовності: –>– –>– – –>– – – –. Таким чином, відносно н-бутил-радикала атом літія, який віддає електронну пару, проявляє +І-ефект. Такий же +І-ефект будуть мати наступні замісники (донори електронів):
елементи з меншою електронегативністю, ніж атом карбону: Li > BeR > BR2 або Na > MgR > AlR2 > SiR3;
алкільні групи в наступній послідовності зменшення їх +І-ефекту: С(СH3)3> СH(СH3)2>CH2CH3>CH3.
4.2. Мезомерний ефект (ефект супряження) – це зміщення електронної густини по -зв’язку в напрямку більш елекронегативного атома або групи атомів, (М-ефект).
В залежності від того, які електрони (електронні орбіталі) приймають участь в спряженні, розрізняють: --супряження (перекривання двох -орбіталей); р--супряження (перекривання р- і -орбіталі) та --супряження (перекривання -орбіталі зв’язку С–Н і -орбіталі); табл. 3.1.
Таблиця 3.1.
Типи спряжених систем.
|
Формула |
Орбітальна модель |
Особливості супряження |
|
1,3-бутадієн |
|
--супряження характерне для молекул, в яких одинарні та подвійні зв’язки чергуються (алкадієни, ароматичні сполуки тощо) |
|
хлористий вініл |
|
р--супряження характерне для молекул з подвійними зв’язками, в яких атом карбону є сусіднім з атомом (в даному випадку це атом хлору), що має на р-орбіталі неподілену пару електронів. |
|
алільний карбокатіон |
|
р--супряження утворюється за рахунок перекривання -зв’язку та вільної р-обріталі атома карбону, який безпосередньо поєднаний із подвійним зв’язком. |
|
пропілен |
|
--супряження утворюється за рахунок перекривання електронної орбіталі -зв’язку та електронної густини орбіталі -зв’язку С–Н метильної групи. |
У випадку -- та р--перекривання маємо ефект супряження (кон’югації), а у випадку --супряження – ефект надсупряження (гіперкон’югації).
При передачі впливу по мезомерному ефекту (на відміну від індуктивного) найбільш характерним є те, що перерозподіл електронної густини проходить практично по всьому ланцюгу супряження .
Мезомерний ефект називають позитивним (+М-ефект), якщо атоми або групи атомів віддають електронну густину -зв’язку (тобто являються донорами електронів). При цьому +М-ефект виявляють:
|
+М-ефект атома хлору відносно подвійного зв’язку |
|
атоми або атомні групи, які мають негативні заряди: –О–.
Зміщення електронної густини у випадку мезомерного ефекта позначається зігнутою (дугоподібною) стрілкою.
Мезомерний ефект називають негативним (–М-ефект), якщо атоми або групи атомів приймають електронну густину від -зв’язку (тобто являються акцепторами електронів). При цьому –М-ефект виявляють:
|
–М-ефект карбонільної групи відносно подвійного зв’язку |
| ||||
|
У багатьох випадках маємо сумісний вплив мезомерного та індукційного ефектів, які можуть співпадати або ні: | |||||
|
|
акролеїн –І, –М-ефекти карбонільної групи |
|
анілін –І, +М-ефекти аміногрупи |
| |













