
- •Основные термодинамические свойства идеальных газов
- •Политропный процесс
- •Второй закон термодинамики
- •Обратимые и необратимые процессы
- •Круговые термодинамические процессы
- •Термический и холодильный коэффициент циклов.
- •Цикл Карно
- •Обратный цикл Карно
- •Математическое выражение второго закона термодинамики.
- •Энтропия
- •Изменение энтропии в обратимых и необратимых процессах.
- •Изменение энтропии идеального газа.
- •Закон возрастания энтропии. Физический смысл энтропии.
- •Газовые процессы в ts− диаграмме.
- •Изотермический процесс.
- •Адиабатный процесс
- •Среднеинтегральная температура
- •Обобщенный цикл Карно
- •Термодинамическая шкала температур
Основные термодинамические свойства идеальных газов
При исследовании термодинамических процессов используется уравнение состояния


и математическое выражение первого закона термодинамики

или

При изучении термодинамических процессов идеальных газов, в общем случае требуется определить уравнение кривой процесса в PV, PT, VT диаграмме, установить связь между термодинамическими параметрами и определить следующие величины:
− изменение внутренней энергии рабочего тела


(формула справедлива не только для V=const, но и для любого процесса)
− определить внешнюю (термодинамическую) удельную работу

и располагаемую удельную работу

−количество теплоты, участвующей в термодинамическом процессе

Где
 –
теплоемкость процесса
–
теплоемкость процесса
–изменение энтальпии в термодинамическом процессе
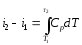
(формула справедлива не только при p=const, но и в любом процессе)
– доля теплоты, которая расходуется на изменение внутренней энергии в данном процессе:

–доля теплоты, превращается в полезную работу в данном процессе


В общем случае любые два термодинамических параметра из трех (P,V,T) могут изменяться произвольно. Для практики наибольший интерес представляют следующие процессы:
-
Процессы при постоянном объеме (V=const) – изохорный.
-
При постоянном давлении (P=const) – изобарный.
-
При постоянной температуре (T=const) – изотермический.
-
Процесс dq=0 (протекающий без теплообмена рабочего тела с окружающей средой) – адиабатный процесс.
-
Политропный процесс, который, при определенных условиях, можно рассматривать как обобщающий по отношению ко всем основным процессам.
В дальнейшем будем рассматривать 1-й закон термодинамики и величины, входящие в него, как отнесенные к 1кг массы.
Процесс при постоянном объеме
(изохорный процесс)
Такой процесс может совершается рабочим телом, например, находящимся в сосуде не меняющем свой объем, если к рабочему телу подводится теплота от источника теплоты или отводится теплота от рабочего тела к холодильнику.
При изохорном процессе V=const и dV=0. Уравнение изохорного процесса получается из уравнения состояния при V=const.

 –
закон
Шарля (*)
–
закон
Шарля (*)
То есть при V=const давление газа пропорционально абсолютной температуре. При подводе теплоты давление увеличивается, при отводе уменьшается.
Изобразим процесс при V=const в pV, pT и VT диаграммах.



В pV– диаграмме изохора 1-2– вертикальная прямая, параллельная оси p. В процессе 1-2 теплота подводится к газу, давление увеличивается, а следовательно из уравнения (*) увеличивается температура. В обратном процессе 2-1 теплота отводится от газа, в результате чего уменьшается внутренняя энергия газа и понижается его температура, т.е. процесс 1-2 – нагревание, 2-1 – охлаждение газа.
В
pT–диаграмме
изохоры – прямые линии, выходящие из
начала координат с угловым коэффициентом
 (коэффициент
пропорциональности)
(коэффициент
пропорциональности)
Причем чем выше уровень объема, тем ниже лежит изохора.
В VT – диаграмме изохоры – прямые параллельные оси T.
Внешняя работа газа в изохорном процессе:
 ,
,
поскольку
 ,
,
 .
.
Располагаемая удельная работа

Изменение
внутренней энергии газа в изохорном
процессе, если


Удельная
теплота, подводимая к рабочему телу,
при


Поскольку при V=const газ не совершает работы (dl=0), то уравнение первого закона термодинамики примет вид:


То есть в процессе при V=const вся теплота, подводимая к рабочему телу, расходуется на увеличение внутренней энергии, то есть на повышение температуры газа. При охлаждении газа его внутренняя энергия уменьшается на величину отводимой теплоты.
Доля теплоты, расходуемой на изменение внутренней энергии


Доля теплоты, расходуемой на совершение работы

Процесс при постоянном давлении
(изобарный процесс)
Изобарный процесс, например, может протекать в цилиндре под поршнем, который перемещается без трения так, что давление в цилиндре остается постоянным.
При изобарном процессе p=const, dp=0
Уравнение изобарного процесса получается при p=const из уравнения состояния:


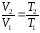 – закон
Гей-Люссака (*)
– закон
Гей-Люссака (*)
В процессе при p=const объем газа пропорционален температуре, то есть при расширении газа температура, а следовательно и внутренняя энергия, увеличивается, а при сжатии – уменьшается.
Изобразим процесс в pV, pT,VT – диаграммах.



В
pV–диаграмме
процессы при
p=const
изображаются прямыми, параллельными
оси V.
Площадь
прямоугольника
 12
12 дает в соответствующем масштабе работу
газа l.
В процессе 1-2 к газу подводится теплота,
поскольку удельный объем увеличивается,
а следовательно по уравнению (*)
увеличивается температура. В обратном
процессе 2-1 теплота отводится от газа,
в результате уменьшается внутренняя
энергия и температура газа, т.е. процесс
1-2– нагревание, а 2-1– охлаждение газа.
дает в соответствующем масштабе работу
газа l.
В процессе 1-2 к газу подводится теплота,
поскольку удельный объем увеличивается,
а следовательно по уравнению (*)
увеличивается температура. В обратном
процессе 2-1 теплота отводится от газа,
в результате уменьшается внутренняя
энергия и температура газа, т.е. процесс
1-2– нагревание, а 2-1– охлаждение газа.
В
VT–
диаграмме изобары представляют собой
прямые линии, выходящие из начала
координат, с угловым коэффициентом
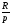 .
.
В pT– диаграмме изобары представляют собой прямые, параллельные оси T.
Работа газа в изобарном процессе (p=const)

Поскольку,

 то
то

То есть если температура газа увеличивается, то работа положительна.
Располагаемая работа

 ,
,
поскольку
 ,
, .
.
Изменение
внутренней энергии газа, если

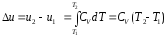
Количество
теплоты, сообщенное газу при нагревании
(или отдаваемое им при охлаждении), если


То
есть теплота, подведенная к рабочему
телу в изобарном процессе, идет на
увеличение его энтальпии, т.е. в изобарном
процессе
 является
полным дифференциалом.
является
полным дифференциалом.
Уравнение первого закона термодинамики имеет вид

или

Доля теплоты, расходуемая на изменение внутренней энергии в изобарном процессе,
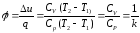
где k – показатель адиабаты.
Доля теплоты, расходуемая на выполнение работы при p=const,

В
МКТ
 ,
n
–число
степеней свободы.
,
n
–число
степеней свободы.
Тогда


Для одноатомного газа n=3 и тогда φ=0.6, ψ=0.4, то есть на выполнение внешней работы идет 40% сообщаемой газу теплоты, а 60% − на изменение внутренней энергии тела.
Для двухатомного газа n=5 и тогда φ=0.715, ψ=0.285, то есть на выполнение внешней работы идет ≈28,5% сообщаемой газу теплоты и 71,5% на изменение внутренней энергии.
Для трехатомного газа n=6 и тогда φ=0.75, ψ=0.25, то есть на выполнение внешней работы идет 25% теплоты (паровой двигатель).
Процесс при постоянной температуре
(изотермический процесс)
Такой термодинамический процесс может протекать в цилиндре поршневой машины, если по мере подвода теплоты к рабочему телу поршень машины перемещается, увеличивая объем настолько, что температура рабочего тела остается постоянной.
При изотермическом процессе T=const, dT=0.
Из уравнения состояния

или
 −
закон
Бойля-Мариотта.
−
закон
Бойля-Мариотта.
Следовательно, в процессе при постоянной температуре давление газа обратно пропорционально объему, т.е. при изотермическом расширении давление падает, а при сжатии увеличивается.
Изобразим изотермический процесс в pV, pT,VT−диаграммах.
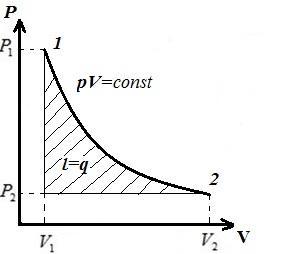


В pV− диаграмме − изотермический процесс изображается равносторонней гиперболой, причем, чем выше температура, тем выше располагается изотерма.
В pT− диаграмме – изотермы – прямые, параллельные оси p.
В VT− диаграмме – прямые, параллельные оси V.
Поскольку в изотермическом процессе dT=0, то


То есть U=const, i=const – внутренняя энергия и энтальпия не изменны.
Уравнение первого закона термодинамики принимает вид (T=const)

То есть вся сообщаемая газу теплота в изотермическом процессе расходуется на работу расширения. В обратном процессе – в процессе сжатия от газа отводится теплота, равная внешней работе сжатия.
Удельная работа в изотермическом процессе


Удельная располагаемая работа
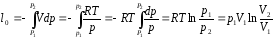
Из последних двух уравнений следует, что в изотермическом процессе для идеального газа располагаемая работа равна работе процесса.
Теплота, сообщаемая газу в процессе 1-2,
1-й закон термодинамики

Отсюда следует, что при T=const l=l0=q, т.е. работа, располагаемая работа и количество теплоты, получаемая системой, равны.
Поскольку в изотермическом процессе dT=0, q=l= какой-то конечной величине, то из


получаем, что в изотермическом процессе C=∞. Поэтому, определить количество теплоты, сообщаемое газу в изотермическом процессе, при помощи удельной теплоемкости невозможно.
Доля теплоты, расходуемая на изменение внутренней энергии при T=const
 ,
,
а доля теплоты, расходуемая на выполнение работы,
 .
.
Процесс без теплообмена с внешней средой
(адиабатный процесс)
При адиабатном процессе энергообмен рабочего тела с окружающей средой происходит только в форме работы. Рабочее тело предполагается теплоизолированным от окружающей среды, т.е. передача тепла между ним и окружающей средой отсутствует, т.е.
q=0, а следовательно dq=0
Тогда, уравнение первого закона термодинамики примет вид
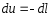
Таким образом изменение внутренней энергии и работа в адиабатном процессе эквивалентны по величине и противоположны по знаку.
Следовательно, работа адиабатного процесса расширения совершается вследствие уменьшения внутренней энергии газа и, следовательно, температура газа уменьшатся. Работа адиабатного сжатия полностью идет на увеличение внутренней энергии, т.е. на повышение его температуры.
Получим уравнение адиабаты для идеального газа. Из первого закона термодинамики

при dq=0 получим (du=CV dT)

Теплоемкость
 ,
откуда
,
откуда
 (*)
(1)
(*)
(1)
Дифференцируя уравнение состояния pV=RT получим
 (**)
(2)
(**)
(2)
Подставляя RdT из (**) в (*)

или
 (3)
(3)
или, разделив на pV,

Интегрируя при k=const, получим

откуда
|
|
Последнее
уравнение называется уравнением Пуассона
и является уравнением адиабаты при
 .
.
Из уравнения Пуассона следует, что
 ,
,
то есть при адиабатном расширении давление падает, а при сжатии возрастает.
Изобразим изохорный процесс в pV, pT и VT – диаграммах



Площадь V1 12V2 под адиабатой 1-2 на pV – диаграмме дает работу l равную изменению внутренней энергии газа

Сравнивая
уравнение адиабаты с законом Бойля-Мариотта
 (T=const)
можем сделать вывод, что, поскольку k>1,
то
при расширении по адиабате давление
падает сильнее, чем по изотерме, т.е. в
pV
– диаграмме
адиабата больше изотермы, т.е. адиабата
– неравносторонняя гипербола, не
пересекающее координатных осей.
(T=const)
можем сделать вывод, что, поскольку k>1,
то
при расширении по адиабате давление
падает сильнее, чем по изотерме, т.е. в
pV
– диаграмме
адиабата больше изотермы, т.е. адиабата
– неравносторонняя гипербола, не
пересекающее координатных осей.
Получим уравнение адиабаты в pT и VT−диаграммах. В адиабатном процессе изменяются все три параметра (p,V,T).
Получим зависимость между T и V. Уравнения состояния для точек 1 и 2

|
|
откуда, разделив второе уравнение на первое
 (*)
(3)
(*)
(3)
Подставляя отношение давление из уравнения адиабаты Пуассона

или TVk-1=const – уравнение адиабаты в VT- диаграмме.
Подставляя в (*) (3) отношение объемов из уравнения адиабаты (Пуассона)



|
|
или
 −
уравнение адиабаты в pT-
диаграмме. Эти уравнения получены в
предположении, что k=const.
−
уравнение адиабаты в pT-
диаграмме. Эти уравнения получены в
предположении, что k=const.
Работа в адиабатном процессе при CV=const

Учитывая соотношение между температурой T и V

Учитывая соотношение между T и p

Изменение
внутренней энергии
 u=-l.
u=-l.
Располагаемая работа, с учетом того, что
 ,
,
Т.е. располагаемая работа в k раз больше работы адиабатного процесса l.
φ и ψ не находим.



