
Пособие-репетитор по химии
ЗАНЯТИЕ 18 10-й класс (первый год обучения)
Соли
П л а н
1.
Определение понятия «соли», строение
солей (графические формулы).
2. Kлассификации: по растворимости в воде, по силе электролитической диссоциации, по составу, по свойствам.
3. Физические свойства.
4. Химические свойства.
5. Методы получения.
6. Области применения.
7. Формулы и тривиальные названия некоторых солей.
Соли (средние) – сложные вещества, состоящие из катионов металлов (или ионов аммония) и анионов (кислотных остатков):
Na2SO4, CuCl2, (NH4)3PO4.
При составлении графических формул средних солей сначала составляют графическую формулу кислоты, от которой образована соль, затем атомы водорода замещают на соответствующий металл или ионы аммония.
Например:
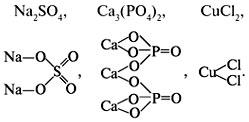
Составляя графические формулы кислых солей, за основу берут графическую формулу соответствующей кислоты. При записи графических формул основных солей исходят из соответствующего основания. Например:
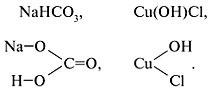
K л а с с и ф и к а ц и и с о л е й
По растворимости в воде все соли делятся на хорошо растворимые в воде (NaCl), малорастворимые (CaSO4) и практически нерастворимые (AgCl).
По силе электролитической диссоциации соли подразделяют на сильные (хорошо растворимые в воде) и слабые (мало- или практически нерастворимые в воде) электролиты.
По составу различают соли, образованные:
а) сильным основанием и сильной кислотой (NaCl);
б) сильным основанием и слабой кислотой (Na2CO3);
в) слабым основанием и сильной кислотой (NH4Cl);
г) слабым основанием и слабой кислотой (CuF2).
По свойствам выделяют следующие виды солей.
• Средние соли – продукт полного замещения атомов водорода в кислоте на металл или ионы аммония.
Например:
H2SO4 + 2NaOH = Na2SO4 + 2H2O.
• Kислые соли – продукт неполного замещения атомов водорода в кислоте на металл или ионы аммония. Kислые соли образуют только многоосновные кислоты.
Например:
H2SO4 + NaOH = NaНSO4 + H2O.
• Основные соли – продукт неполного замещения гидроксигрупп основания на кислотные остатки. Основные соли образуются только многокислотными основаниями.
Например:
Cu(OH)2 + HCl = Cu(OH)Cl + H2O.
• Двойные соли – соли, содержащие два металла, например KBaPO4.
• Смешанные cоли – соли, содержащие два кислотных остатка, например Al(SO4)Cl.
• Kомплексные соли, например K3[Fe(CN)6].
• Kристаллогидраты, например CuSO4•5H2O.
Ф и з и ч е с к и е с в о й с т в а
Большинство солей – твердые кристаллические вещества белого цвета. Некоторые соли имеют окраску: соли хрома окрашены в желтый или оранжевый цвет, соли меди(II) – в голубой, соли железа(III) – в бурый, соли кобальта – в розовый, твердые сульфиды – в черный, перманганат калия – в фиолетовый.
Х и м и ч е с к и е с в о й с т в а с р е д н и х с о л е й
Диссоциация:
Na2SO4 ![]() 2Na+ +
SO42–.
2Na+ +
SO42–.
Сульфиды металлов при обжиге на воздухе превращаются в оксиды:
2СuS
+ 3O2 ![]() 2CuO
+ 2SO2.
2CuO
+ 2SO2.
Активные металлы, не реагирующие при 25 °С с водой, вытесняют менее активные металлы из растворов их солей:
CuCl2 + Zn = ZnCl2 + Cu.
Любой активный металл вытесняет менее активный металл из расплава его соли:
![]()
Активные галогены вытесняют менее активные галогены из растворов солей галогеноводородных кислот:
CuBr2 + Cl2 = CuCl2 + Br2.
Нелетучие кислотные оксиды при сплавлении реагируют с солями летучих кислот:
![]()
Соли, которым соответствуют нерастворимые основания, реагируют со щелочами:
FeCl2 +
2NaOH = Fe(OH)2![]() +
2NaCl.
+
2NaCl.
Сильные кислоты реагируют с солями относительно слабых кислот:
Na2CO3 +
2HCl = 2NaCl + H2O
+ CO2![]() .
.
Две растворимые соли взаимодействуют между собой, если при этом образуется нерастворимая соль:
BaCl2 +
Na2SO4 =
BaSO4![]() +
2NaCl.
+
2NaCl.
Термическое разложение солей:
СaCO3 ![]() CaO
+ CO2
CaO
+ CO2![]() ,
,
2NaNO3 ![]() 2NaNO2 +
O2
2NaNO2 +
O2![]() .
.
