Абсолютная шкала температур
Вспомним один из вариантов записи основного уравнения МКТ P=2nE/3.
Преобразуем его p=2NE/3V
pV/N=2E/3 (*)
Если вспомнить, что N=mNA/M, то видим, что в правой части уравнения (*) содержаться легко измеряемые макропараметры. Вычислив это соотношение для разных газов можно убедиться, что оно не зависит ни от массы, ни от объема, ни от давления, а зависит только от температуры газа. Следовательно, pV=Θ,
[Θ]=1 Дж
Θ=kT
Т.е. p=NkT/V
P=nkT - еще одна форма записи основного уравнения МКТ.
k=1,38*10-23 Дж/К - постоянная Больцмана.
Объединим это уравнение с P=2nE/3 и получим
Температура – мера средней кинетической энергии.
Е=3kT/2
Т – абсолютная температура (не зависит от вещества, используемого для измерения температуры).
При Т=0 кинетическая энергия поступательного движения молекул равна нулю.
Абсолютный нуль недостижим!
Так как р>0, V>0, N>0, то Т>0.
[T]=1 K (кельвин)
1К=1оС
Т=t+273
t=T-273
Скорость молекул газа.
v=√3kT/m0 - средняя квадратичная скорость молекул газа.
v=√3kNAT/M.
Опытное определение скоростей движения молекул паров серебра впервые был проведен в 1920 г Штерном.
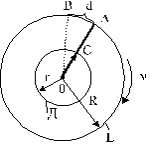
Из стеклянного цилиндра Е выкачивался воздух (рис. 5). Внутри этого цилиндра помещался второй цилиндр Д, имеющий с ним общую ось О. Вдоль образующей цилиндра Д имелся прорез в виде узкой щели С. По оси протягивалась посеребренная платиновая проволока, по которой можно было пропускать ток. При этом проволока раскалялась и серебро с ее поверхности обращалось в пар. Молекулы паров серебра разлетались в различные стороны, часть их проходила через щель С цилиндра Д и на внутренней поверхности цилиндра Е получался налет серебра в виде узкой полоски. На рис. 5 положение полоски серебра отмечено буквой А.
Когда вся система приводилась в очень быстрое движение таким образом, что проволока являлась осью вращения, то полоска А на цилиндре Е получилась смещенной в сторону, т.е. например, не в точке А, а в точке В. Это происходило потому, что пока молекулы серебра пролетали путь СА, точка А цилиндра Е успевала повернуться на расстояние АВ и молекулы серебра попадали не в точку А, а в точку В.
Налет серебра на стенке цилиндра Д получался размытым, что подтверждало наличие различных скоростей движения молекул.
Уравнение состояния идеального газа.
Уравнение, связывающее p, V, T, характеризующее состояние данной системы газа, называется уравнением идеального газа.
pV=mRT/M - уравнение Менделеева – Клайперона (для произвольной массы газа).
R=NAk=8,31Дж/К*моль - универсальная газовая постоянная.
При так называемых нормальных условиях:
р0=105 Па
Т0=273 К
V0=22,4.10-3 м3/моль.
p1V1/T1=p2V2/T2=const- уравнение Клайперона (для m=const).
Изопроцессы.
|
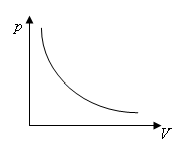
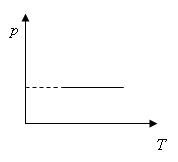
Изотермический (закон Бойля – Мариотта) 1662 г., 1667 г. |
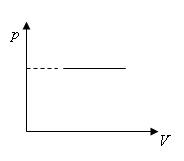
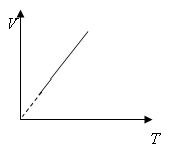
Изобарный (закон Гей-Люссака) 1802 г. |
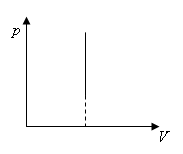
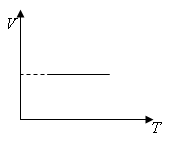
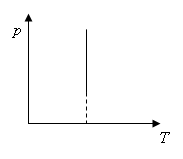
Изохорный (закон Шарля) 1787 г. |
|
T, m, M = const |
p, m, M = const |
V, m, M = const |
|
pV=const |
V/T=const |
p/T=const |
|
p1V1 = p2V2 |
V1/T1=V2/T2 |
p1/T1=p2/T2 |
|
Произведение давления данной массы газа на его объем постоянно, если температура газа не меняется. |
Объем данной массы газа при постоянном давлении пропорционален температуре. |
Давление данной массы газа при постоянном объеме пропорционально температуре. |
|
Изотермы |
Изобары |
Изохоры |