
Praktikum_Solodovnik
.pdfобладнання, високої чутливості (10-5 %) і можливості його застосування для визначення практично всіх елементів періодичної системи а також багатьох органічних сполук.
Електромагнітне випромінювання (далі е. в.) – це сукупність змінних електричного та магнітного полів, що із визначеною швидкістю поширюється в просторі у вигляді поперечних хвиль незалежно від джерела випромінювання. Е.в. обумовлено тими процесами у речовинних системах, для яких має місце зміна електричного стану заряджених мікрочастинок. Тому е. в. обов’язково несе певну енергію, яка знову може бути передана речовинній системі з якою вона взаємодіє. Саме цей процес взаємодії і є джерелом інформації про склад та властивості досліджуваної системи. Е. в. має подвійну природу – хвильову і корпускулярну, а описують е. в. за допомогою хвильових та квантових характеристик.
Хвильові характеристики:
а) частота коливань υ –це кількість коливань в 1с. Вимірюється в герцах (Гц). Наприклад частота коливань для червоного світла складає 4·1014 Гц, а для зеленого світла – 6·1014 Гц.
б) довжина хвилі (λ) – характеризує найменшу відстань між точками, які коливаються в однакових фазах. В системі СІ використовуються одиниці вимірювання: м; см; мм; нм (1нм=10 −9 м).
Взаємодія випромінювання з хімічною системою в кожній ділянці спектра відбувається за визначеним механізмом і дає різну інформацію. Довжина хвилі і частота коливань пов’язані між собою співвідношенням:
|
|
|
υ = C , |
|
де, С – швидкість світла, 3·1010 см/с. |
λ |
|||
|
||||
Тоді, |
|
|
|
|
|
υ = 3 ×1010 , Гц. |
|||
Наприклад: |
|
|
λ |
|
|
|
|
||
λ (зелене світло) = 500 нм = 5·10 −5 см; |
||||
Тоді, |
|
|
|
|
υ = |
3×1010 |
= 6 ×1014 , Гц. |
||
|
5 ×10−5 |
|
||
в) хвильове число (υ’) – величина зворотна довжині хвилі, см−1 . |
||||
Для зеленого світла: |
1 |
|
|
|
υ, = |
|
= 2 ×1014 , см−1 . |
||
5 ×10−5 |
||||
|
|
|||
Квантова характеристика – енергія електромагнітного випромінювання, яка розраховується за співвідношенням:
E = h × υ ,
де h – постійна Планка, 6,62·10 −34 , Дж·с.
121
Для одержання енергії 1 моля необхідно енергію електромагнітного випромінювання помножити на число Авагадро (NА):
Е=6,62·10 −34 ·6,02·10 23 ·υ=3,99·10 −10 υ, Дж/ моль
Врамках концепції корпускулярно – хвильового дуалізму випромінювання можна розглядати також як потік мікрочастинок – фотонів. Фотони з точки зору квантової механіки є частинками з цілим спіном (бозони), тому будь – яка їх кількість може одночасно перебувати в одному і тому ж енергетичному стані в одній і той же точці простору. При цьому енергія, яка переноситься фотонами через одиницю площі поверхні пропорційна їх кількості за одиницю часу.
Взалежності від довжини хвилі в електромагнітному спектрі виділені такі ділянки:
Інтервал довжини хвилі |
Ділянка спектру |
Атомні та молекулярні |
|
|
переходи |
300 – 400 нм |
Ультрафіолетове |
середні електрони |
400 – 760 нм |
Видиме світло |
валентні електрони |
|
|
|
760 – 1000 нм |
ІЧ-випромінювання |
молекулярні коливання |
Видиме випромінювання займає у цій шкалі дуже вузький діапазон від 400 до 760 нм. Оптичне випромінювання охоплює ультрафіолет, видиму та інфрачервону ділянки шкали довжин хвиль. Для дослідження цих видів е.в. застосовують оптичні методи, для яких характерним є формування направлених потоків електромагнітних хвиль за допомогою оптичних пристроїв (лінзи, дзеркала, призми, дифракційної решітки, тощо).
Якщо випромінювання є потоком фотонів з однаковою енергією (або частотою) – його називають монохроматичним, а коли ж у ньому присутні фотони різних енергій – поліхроматичним.
5.1. ЛАБОРАТОРНА РОБОТА № 23
Фотоколориметричний метод аналізу
Теоретична частина
Фотоколориметрія – метод аналізу, заснований на вимірюванні поглинання світла речовиною, що визначається або продуктом її взаємодії зі спеціально доданим реактивом.
Бугер і Ламберт встановили, що відносне послаблення поглинутого середовищем випромінювання не залежить від його інтенсивності. Кожний шар рівної довжини поглинає рівну частку падаючого на нього випромінювання.
Математично це виглядає так:
І = І0 × e−αl або І=І0exp(-αl). (5.1.1)
де, І0 – початковий світловий потік; І – потік, що пройшов крізь шар середовища товщиною l см; α– коефіцієнт поглинання середовища.
122

При 2,303α=k, отримуємо:
І = І0 ×10−kl . |
(5.1.2) |
Бер встановив, що коефіцієнт поглинання випромінювання прямо пропорційний концентрації речовини, що поглинається в середовищі, крізь яку проходить випромінювання, тобто 2,303α=k=εс.
Враховуючи це можна записати:
або в логарифмічній формі: |
І |
= І0 ×10− εcl |
(5.1.3) |
|
I0 |
|
|
||
lg |
= D = εcl |
(5.1.4) |
||
I |
||||
|
|
|
||
де D – оптична густина середовища, безрозмірна величина; с – молярна концентрація |
||||
речовини, що поглинається, моль/дм3; l – товщина шару, що поглинає, |
м; ε – |
|||
молярний коефіцієнт поглинання, або коефіцієнт екстинкції, м2/моль. |
|
|||
Коефіцієнт екстинкції залежить від довжини хвилі випромінювання l. |
||||
Залежність типу: ε = f (λ) ; D = f (λ) |
називається спектром поглинання даної |
|||
речовини, а залежність типу: T = I = f (λ) − спектром пропускання. Величина Т
I0
(пропускання), зазвичай виражається у відсотках, тоді: T = I ×100% .
I0
Якщо в розчині присутні кілька компонентів, що поглинають випромінювання даної довжини хвилі, то справедливий закон аддитивності поглинання: кожен поглинаючий компонент поглинає випромінювання незалежно від іншого, так що сумарна оптична густина системи є сумою оптичних густин поглинаючих компонентів:
Dλi = åDi ,k |
= låei,k × ck |
(5.1.5) |
k |
k |
|
де Dλ,i – сумарна оптична густина системи; Di,k – оптична густина k-того компонента при i-тій довжині хвилі.
Вимірювання оптичної густини і пропускання різних середовищ проводять за допомогою спектрофотометрів, фотометрів, фотоколориметрів та інших приладів. Усі ці прилади мають джерело випромінювання (1), прилад для виділення певної спектральної ділянки випромінювання (2), кюветне відділення, де містяться досліджувані зразки (3), приймач випромінювання (4) і розрахунково-вимірювальний пристрій (5) (рис. 5.1.1). Необхідна спектральна ділянка у фотоколориметрах виділяється за допомогою світлофільтрів. Максимум пропускання фільтра повинний збігатися з мінімумом пропускання досліджуваного зразка.
Спектрофотометри на відміну від колориметрів дозволяють виділити випромінювання в дуже вузькому інтервалі довжин хвиль, так зване монохроматичне випромінювання, що дає можливість роздільно визначати кілька речовин у спільній їхній присутності.
Щоб поглинання інших присутніх у розчині речовин не впливало на результат визначення, оптичну густину досліджуваного розчину вимірюють відносно розчину порівняння, що має такий само склад, що і досліджуваний, але
123

не містить обумовленої речовини. По цьому розчину встановлюють “нуль” шкали оптичної густини приладу.
Концентрацію обумовленої речовини у фотоколометрії, як і в інших інструментальних методах аналізу, встановлюють одним з чотирьох методів:
Рис. 5.1.1. Оптична схема фотоколориметричних пристроїв:
1 – джерело випромінювання; 2 – прилад для виділення певної спектральної ділянки випромінювання; 3 – кюветне відділення; 4 – приймач випромінювання; 5 – розрахункововимірювальний пристрій
Метод калібрувального графіка
Готують серію розчинів, концентрація обумовленої речовини в яких точно відома, і вимірявши їх оптичну густину, будують графік у координатах с-D. Оптична густина досліджуваного розчину виміряється в тих само умовах, що і для стандартних, а досліджувану концентрацію знаходять за графіком.
Метод порівняння зі стандартом
Готують тільки один стандартний розчин, максимально близький за концентрацією до досліджуваного. Вимірявши оптичні густини двох розчинів в однакових умовах досліджувану концентрацію знаходять зі співвідношення:
cx |
= |
Dх |
→ cх |
= |
cст × Dх |
(5.1.6) |
|
Dст |
Dст |
||||
cст |
|
|
|
|||
Цей метод менш трудоємкий у порівнянні з методом калібрувального графіка, але поступається йому по точності, у тих випадках, коли значення сХ заздалегідь невідоме. Обидва методи застосовують, коли є впевненість, що сполука аналізованого розчину мало відрізняється від сполуки стандартних розчинів.
Метод добавок
Застосовують при аналізі об'єктів, склад яких варіює в широких межах. У цьому методі до точно відомого об′єму аналізованого розчину додають точно виміряний невеликий об′єм стандартного розчину, такий щоб оптична густина
124
збільшилася приблизно в два рази. Досліджувану концентрацію знаходять за формулою:
cх = |
cт ×Vс т |
× |
Dх |
(5.1.7) |
|
Dз аг - Dх |
|||
|
Vх +Vс т |
|
||
де Dзаг- оптична густина розчину з добавкою; Dх- оптична густина досліджуваного розчину.
Метод прямого розрахунку
Метод заснований на застосуванні рівняння:
cх |
= |
Dx |
(5.1.8) |
|
εl |
||||
|
|
|
В аналітичній практиці застосовується рідко через відсутність надійних значень оптичної густини для інтервалу хвиль, які використовуються.
Практична частина Завдання 1. Визначити вміст заліза (ІІІ) в питній воді методом
калібрувального графіку
Обладнання та реактиви:
1.Фотоелектроколориметр ФЕК-М;
2.Колба мірна місткістю 50,0 см3;
3.Колба мірна місткістю 25,0 см3 (4 шт);
4. |
Піпетка Мора |
5,0 см3; |
|
5. |
Піпетка градуйована |
1,0 |
см3; |
6. |
Піпетка градуйована |
2,0 |
см3 (2 шт); |
7.Стандартний розчин солі заліза (с(Fe3+) = 1,0 мг/см3);
8.Розчин сульфосаліцилової кислоти – 10%;
9.Розчин амоніаку – 10%.
Залізо (III) у лужному середовищі утворює з аніоном сульфосаліцилової кислоти комплекс складу 1:3, розчини якого забарвлені в жовтий колір. Для цього
комплексу lмакс.=416 нм і e416=5,8×105 м2/моль. Залізо (II) в умовах визначення дуже швидко окисляється до тривалентного.
Виконання роботи
Побудова калібрувального графіка
1.Ввімкнути фотоелектроколориметр КФК-2 на 15 хвилин для прогрівання, при цьому кюветне відділення повинно бути відкритим (рис.5.1.2).
2.Вихідний стандартний розчин розбавити в 10 разів водою, використовуючи колбу на 50 cм3 (5 cм3 стандартного розчину в колбу на 50 cм3).
3.У чотири мірні колби на 25 cм3 узяти по 0,1; 0,3; 0,5; 0,7 cм3 розведеного стандартного розчину заліза і додавши по 2,0 cм3 розчинів сульфосаліцилової кислоти й амоніаку, довести водою до мітки і перемішати. Оптичну густину отриманих розчинів вимірити через 10 хв.
125

Рис. 5.1.2. Зовнішній вигляд фотоелектроколориметра КФК-2:
1 – шкала реєструю чого пристрою; 2, – кнопка вмикання прибору; 3 – ручка перемикання світлофільтрів; 4 – ручка зміни кювет; 5 – ручка чутливості; 6 – ручка встановлювання 100%-го світло пропускання; 7 – кришка кюветного відділення
4.Після прогріву прибору кюветне відділення закрити і встановити найменшу чутливість (при роботі з світлофільтром, що має довжину хвилі – це 490 нм). Для цього ручку чутливості встановити в положення «1» на панелі з чорним кольором позначень чутливості. Ручку «Установка 100-грубо» встановити в крайнє ліве положення, а ручку перестановки кювет - в положення «1».
5.Встановити стрілку фотоелектроколориметру на нуль (по нижній шкалі, позначеній D ) за допомогою ручок «Установка 100-грубо» і «Точно».
6.В кюветоутримувач помістити кювети з досліджуваним розчином і
розчинником (Н2О) так, щоб кювета з розчинником знаходилася навпроти віконця, через яке проходить світловий промінь і закрити кришку приладу. Потім ручками «Чутливість», «Установка 100-грубо» і «Точно» знову встановити «0» по шкалі відліку оптичної густини (нижня шкала – D). Ручка чутливості може стояти в положенні 3, 2, 1.
7.Поворотом ручки, кювету із розчинником замінити кюветою з досліджуваним розчином. Для цього ручку зміни кювет перевести з положення «1»
вположення «2». Оптичну густину зняти по нижній шкалі приладу.
8.Після кожного вимірювання ручку зміни кювет потрібно переводити в положення «1» і проводити контроль установки нуля при закритому кюветному відділенні.
9.Після закінчення роботи ручку чутливості встановити в положення 1, позначене чорним кольором на панелі, а ручку «Установка 100-грубо» в крайнє ліве положення, після цього колориметр відключити від електричної мережі.
10.Оптичну густину інших розчинів вимірити повтором дій по пунктах 6-9. Розрахувати концентрацію заліза в еталонних розчинах (у мг/дм3) і по отриманим даним побудувати графік у координатах c-D.
Аналіз питної води на вміст заліза
1. Від 5 до 20 см3 (у залежності від вмісту заліза ) досліджуваної води взяти в мірну колбу місткістю 25 см3. Додати по 2 cм3 розчинів сульфосаліцилової кислоти
126
іамоніаку, довести дистильованою водою до мітки і перемішати.
2.Оптичну густину отриманого розчину виміряти так само як і еталонних. Концентрацію в ньому визначити за калібрувальним графіком.
3.Вміст заліза в досліджуваній воді знайти як добуток цієї концентрації на коефіцієнт, що являє собою відношення місткості колби (25 см3) до об’єму узятої для аналізу води.
Завдання 2. Визначити вміст Фосфору у ґрунті методом калібрувального графіка
Обладнання та реактиви
1.Фотоелектроколориметр КФК-2;
2.Колба мірна місткістю 100,0 см3;
3. Колба мірна місткістю 50,0 см3 (6шт);
4.Піпетка Мора 5,0;
5.Піпетка градуйована 2,0 см3;
6.Піпетка градуйована 1,0 см3;
7.Стандартний розчин с(Р)=0,1 мг/см3;
8.2,5% розчин сульфату гідразинію в H2SO4;
9.0,15% pозчин молібдату амонію;
10.Розчин HCl – 0,1 моль/дм3;
При визначенні фосфору у грунті використовують сульфат гідразинію, як відновник, для одержання синьої форми гетерополікислоти.
Виконання роботи
Побудова калібрувального графіка
1.Вихідний стандартний розчин розбавити у 5 разів водою, використовуючи колбу на 50,0 см3 (10 см3 стандартного розчину в колбу на 50 см3).
2.У чотири мірні колби на 50,0 см3 ввести по 25 см3 води та розведений стандартний розчин по 1,0; 2,0; 4,0; 6,0 см3 відповідно. У кожну колбу додати 5 см3 розчину молібдату амонію і 2 см3 розчину сульфату гідразинію, довести водою до мітки, перемішати.
3.Всі чотири колби занурити у киплячу водяну баню на 10 хвилин, вийняти та швидко охолодити. Знову перемішати. Після цього можна приступати до вимірювання оптичної густини.
4.Ввімкнути фотоелектроколориметр КФК-2 на 15 хвилин для прогрівання, при цьому кюветне відділення повинно бути відкритим (рис.5.1.2).
5.Після прогріву прибору кюветне відділення закрити і встановити найменшу чутливість (при роботі з світлофільтром, що має довжину хвилі 490 нм). Для цього ручку чутливості встановити в положення «1» на панелі з чорним кольором позначень чутливості. Ручку «Установка 100-грубо» встановити в крайнє ліве положення, а ручку перестановки кювет - в положення «1».
6.Встановити стрілку фотоелектроколориметру на нуль (по нижній шкалі, позначеній D ) за допомогою ручок «Установка 100-грубо» і «Точно».
7.В кюветоутримувач помістити кювети з досліджуваним розчином і розчинником (Н2О) так, щоб кювета з розчинником знаходилася навпроти віконця,
127
через яке проходить світловий промінь і закрити кришку приладу. Потім ручками «Чутливість», «Установка 100-грубо» і «Точно» знову встановити «0» по шкалі відліку оптичної густини (нижня шкала - D). Ручка чутливості може стояти в положенні 3, 2, 1.
8.Поворотом ручки, кювету із розчинником замінити кюветою з досліджуваним розчином. Для цього ручку зміни кювет перевести з положення «1»
вположення «2». Оптичну густину зняти по нижній шкалі приладу.
9.Після кожного вимірювання ручку зміни кювет потрібно переводити в положення «1» і проводити контроль установки нуля при закритому кюветному відділенні.
10.Після закінчення роботи ручку чутливості встановити в положення 1, позначене чорним кольором на панелі, а ручку «Установка 100-грубо» в крайнє ліве положення, після цього колориметр відключити від електричної мережі.
11.Розрахувати концентрацію фосфору у кожному розчині (в мг/дм3) та по
цих даних побудувати графік у координатах D − с.
Визначення фосфору у ґрунті
1.Взяти наважку 1 г просушеного ґрунту, розтерти його у фарфоровій ступці та залити 20 см3 0,1М HCl. Розмішати та профільтрувати. Фільтрат використовують для аналізу.
2.В колбу на 50 см3 внести 5 см3 розчину молібдату амонію, 2 см3 розчину сульфату гідразинію, 2 см3 фільтрату та довести до мітки водою, перемішати. (Отже фільтрат розведений у 25 разів).
3.Колбу занурити у киплячу водяну баню на 10 хвилин, вийняти та швидко охолодити, перемішати.
4.Оптичну густину виміряти як і для еталонних розчинів.
5.Концентрацію фосфору в аліквоті (сал) визначити за градуювальним графіком та розрахувати концентрацію фосфору в 20 см3 фільтрату (с(Р)=25·сал).
6.Використовуючи формулу m(Р)=с(Р)·V розрахувати масу фосфору у 20 см3
витяжки.
де m(Р) – маса фосфору, мг; с(Р) – концентрація фосфору у фільтраті, мг/дм3; V – об’єм витяжки, дм3.
7.Знайти масову частку фосфору за формулою:
ω(P) = |
m(P) |
×100% |
(5.1.9) |
|
|||
|
mн |
|
|
де, ω(Р) – масова частка, %; mн – маса наважки, мг.
8.В агрохімії вміст фосфору в ґрунтах прийнято виражати в перерахунку на
P2 O5, тому одержаний результат необхідно помножити на перерахунковий коефіцієнт 2,3.
9.За таблицею 5.1.1 визначити потребу даного ґрунту у фосфорному підживленні, та зробити висновки.
Таблиця 5.1.1.
Потреба ґрунту у внесенні фосфорних добрив
Масова |
1,2 |
2,2 |
3,7 |
5,0 |
|
6,2 |
7,5 |
8,7 |
|
10 |
12,5 |
15 |
20 |
25 |
>25 |
частка |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Не |
ω×103 |
|
|
В е л и к а |
|
|
|
С е р е д н я |
|
Слабка |
потре |
|||||
(%) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
бує |
128
Контрольні запитання
1.Що таке електромагнітне випромінювання?
2.Закони поглинання випромінювання, основні фотометричні величини та зв’язок між ними.
3.Будова фотоколориметра.
4.Як перевірити чи підпорядковується досліджуваний розчин закону Бугера- Ламберта-Бера? Які причини відхилення від основного закону поглинання?
5.Способи визначення концентрації обумовленої речовини у фотоколометрії.
6.Чи можна використовувати нелінійні калібрувальні графіки для визначення концентрації речовин в аналізованому розчині?
5.2.ЛАБОРАТОРНА РОБОТА № 24
Рефрактометричний метод аналізу
Теоретична частина
Метод аналізу розчинів, який ґрунтується на вимірюванні показника заломлення, як функції концентрації визначуваної речовини називається рефрактометрією. Показник заломлення (n) можна представити, як співвідношення синусів кута падіння (α) світла на поверхню розділу двох середовищ і кута заломлення (β) (рис. 5.2.1).
Рефрактометрія як дуже швидкий і простий метод широко використовується для визначення концентрації речовин у розчинах в цукровій, харчовій, фармацевтичній та інших галузях промисловості. Часто даний метод використовують в комбінації з іншими, а також для створення детекторів для рідкісної хроматографії.
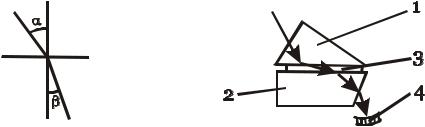
Для вимірювання показника заломлення рідин використовують прилади – рефрактометри, які основані на вимірюванні кута повного внутрішнього відображення. Відомі два типа рефрактометрів - Пульфриху і Аббе (рис. 5.2.2.).
Рис. 5.2.1. Графічне зображення |
Рис. 5.2.2. Хід променів в |
показника заломлення: |
рефрактометрі Аббе: |
α – кут падіння променів; β – кут |
1 – освітлювальна призма; 2 – вимірю- |
заломлення променів. |
вальна призма; 3 – досліджувана рідина; |
|
4 – шкала. |
На нижню вимірювальну призму за допомогою оплавленої скляної палички або піпетки наносять 1-2 краплі не торкаючись поверхні призми і, закривши блок призми, встановлюють джерело світла так, щоб досягти достатньо добре
129

освітленого поля зору. Показник заломлення залежить також від температури і довжини хвилі світла, що використовується. Тому в рефрактометрах передбачена підтримка сталої температури блока призми. Можна також вносити температурні поправки або враховувати температурну залежність при побудові калібрувальних графіків. Під час використання поліхроматичного (білого) випромінювання прилади мають також компенсатор (призма Амічі), який усуває забарвлення межі поділу світла та тіні у полі зору окуляра.
На рисунку 5.2.3 показаний зовнішній вигляд рефрактометра ІРФ–454. Для проведення вимірювань на даному приладі слід відкрити блок призми (1), на поверхню вимірювальної призми нанести 1-2 краплі досліджуваного розчину і закрити блок. Відкрити шторку (4) на передній частині блоку. Встановити прилад на відстані 40-50 см від джерела світла і обертаючи оправу окуляра досягти різкого відображення перехрещення ниток і шкали відліку.
Потім, обертаючи маховичок (3) вивести в поле зору межу світлотіні. Якщо межа має розмитий і забарвлений вигляд, обертаючи маховичок (2) досягти її різкого відображення, після чого за допомогою маховичка (3) точно з’єднати межу світлотіні з перехрещенням ниток. Відлік проводять за шкалою, яку спостерігають в окуляр (5). Ціна поділки шкали 0,001. Десятитисячні долі оцінюються приблизно.
Рисунок 5.2.3 – Зовнішній вигляд рефрактометра ІРФ–454:
1 – призмений блок; 2, 3 – маховички; 4 –шторка; 5 -окуляр
Практична частина
Завдання 1. Визначити вміст етилового спирту у водному розчині методом калібрувального графіка
Обладнання та реактиви:
1.Рефрактометр ІРФ–454;
2.Піпетка градуйована місткістю 10 см3;
3.Мірні колби місткістю 25,0 см3(8 шт);
4.Етиловий спирт – 96%;
5.Дистильована вода.
130
