
- •Российский Химико-Технологический Университет имени д.И. Менделеева
- •Курсовая работа
- •1. Состав реакционной смеси перед реактором.
- •2. Расчет равновесной степени превращения диоксида серы.
- •3. Расчет скорости реакции в зависимости от температуры и степени превращения.
- •4. Построили зависимость w (t) для выбранных значений степени превращения и определили температуры т (опт), соответствующие максимумам скорости (w мах) для каждого выбранного значения х.
- •5 На диаграмму х-т вместе с равновесной линией Хравн(т) нанесли найденные значения Топт и построили линию оптимальных температур лот. (см. Приложение)
- •8. Используем программу лабораторного практикума кафедры охт для определения время пребывания в каждом слое катализатора и суммарное время пребывания.
- •9 Расчет объема катализатора в каждом слое и суммарный объем.
- •1 Кмоль so2 - 1 кмоль н2so4 ;
- •Тогда для каждого слоя катализатора:
- •10 Сравнение протекания реакции в реакторах с различными режимами. Выводы.
- •Список используемой литературы
3. Расчет скорости реакции в зависимости от температуры и степени превращения.
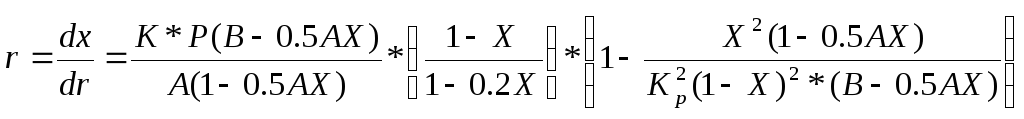
где А-начальная концентрация SO2 (A=0.085)
B-начальная концентрация O2 (B=0.1288)
P-общее давление (Р=1атм)
r-скорость
K-константа скорости
Kp-константа равновесия
Пользуюсь программой лабораторного практикума по ОХТ,
для пяти значении степени превращения – 0,6 ; 0,7 ; 0,8 ; 0,9 ; 0,95, интервал варьирования температуры 20 оК. Результаты свели в таблицу:
|
|
Скорость W(X,T) |
||||
|
T, oK |
X=0,6 |
X=0,7 |
X=0,8 |
X=0,9 |
X=0,95 |
|
693 |
0.203 |
0.151 |
0.099 |
0.049 |
0.023 |
|
713 |
0.480 |
0.356 |
0.234 |
0.113 |
0.051 |
|
733 |
0.629 |
0.466 |
0.305 |
0.143 |
0.054 |
|
753 |
0.810 |
0.598 |
0.387 |
0.168 |
0.053 |
|
773 |
1.027 |
0.754 |
0.476 |
0.171 |
-0.055 |
|
793 |
1.281 |
0.927 |
0.557 |
0.106 |
|
|
813 |
1.407 |
0.990 |
0.531 |
-0.118 |
|
|
833 |
1.360 |
0.904 |
0.359 |
|
|
|
853 |
1.276 |
0.748 |
0.045 |
|
|
|
873 |
1.126 |
0.470 |
-0.512 |
|
|
4. Построили зависимость w (t) для выбранных значений степени превращения и определили температуры т (опт), соответствующие максимумам скорости (w мах) для каждого выбранного значения х.
|
Х |
W мах |
Т опт (К) |
|
0,6 |
1.421 |
803 |
|
0,7 |
1.017 |
803 |
|
0,8 |
0.584 |
803 |
|
0,9 |
0.177 |
765 |
|
0,95 |
0.06 |
728 |
5 На диаграмму х-т вместе с равновесной линией Хравн(т) нанесли найденные значения Топт и построили линию оптимальных температур лот. (см. Приложение)
6 Ограничиваем область протекания процесса окисления в реакторе величиной скорости реакции W = 0.8*W мах для каждого выбранного Х. Наносим их на диаграмму W – Т, определяем температуру, соответствующую W = 0.8*W мах.
Находим значения температур:
|
Wmax |
0.8 Wmax |
Т1 |
Т2 |
|
1.421 |
1.137 |
782 |
868 |
|
1.017 |
0.814 |
776 |
849 |
|
0.584 |
0.467 |
766 |
824 |
|
0.177 |
0.142 |
735 |
784 |
|
0.06 |
0.048 |
693 |
761 |
7. На диаграмме Х-Т изображаю температурный режим окисления в каталитическом реакторе (см. приложение). Для этого определим адиабатическое изменение темппературы, используя формулу:
![]() Тад
=
Тад
=
![]()
где:
Qр
– тепловой эффект реакции, Qр
= -![]() Н
Н
СSO2 – концентрация SO2 = 0,08
Cр – средняя теплоемкость реакционной смеси
![]() Н
= - 101420 + (9,26*Т) = -101420 + (9,26*713) = -94817,62 Дж/моль
Н
= - 101420 + (9,26*Т) = -101420 + (9,26*713) = -94817,62 Дж/моль
Ср
= СSO2
* СрSO![]() +СO
+СO![]() * CpO
* CpO![]() + СN
+ СN![]() * CpN
* CpN![]()
Cp берем из справочника при Т = 713 С в Дж/(моль*К) [2]
Ср = (0,08 * 46,32) + (0,134 * 31,39) + (0,786 * 30,04) = 31,52Дж/(моль*К)
![]() Тад =
Тад =![]() = 240.65 К
= 240.65 К
Изображаем на графике Х-Т температурный режим для определения количества слоев катализатора
по
уравнению Тк = Тн +
![]() Тад ( Хк-Хн) строим промежуточные точки:
Тад ( Хк-Хн) строим промежуточные точки:
|
Слои |
Тн |
Хн |
Тк |
Хк |
|
1 |
713 |
0 |
857 |
0,61 |
|
2 |
783 |
0,61 |
826 |
0,8 |
|
3 |
774 |
0,8 |
796 |
0,88 |
|
4 |
741 |
0,88 |
756 |
0,94 |
|
|
713 |
|
|
|
Получили 4 слоя катализатора
