
1.3. Загальні способи одержання спіросполук
Спіросполуки представляють собою особливу групу органічних сполук, що містять так званий спіроатом, найчастіше спіроатом карбону. Ці сполуки уявляють з собе конденсовані системи мінімум з двома циклами, сполученими спільним атомом карбону, що перебуває в стані sp3-гібридизації. Причому список спіросполук значно розширюється, за умови одержання гетероциклів [21-24].
Розробка методик синтезу спіросполук – досить кропітка робота і на сьогодні більшість відомих спіросполук одержана випадково використовуючи ті чи інші відомі механізми реакцій але з “некласичними” для цих синтезів сполуками.
Так можна систематизувати деякий накопичений матеріал і більш-менш конкретно вказати методики одержання спіросполук на конкретних прикладах [25, 26].
Різноманітні реакції конденсацій:
а) Конденсація 4-Бром-2,2-диметил-4-формілтетрагідротіопірану з етилендіаміном приводить до 8,8-Диметил-9-тіа-1,4-диаза-спіро-5,5-ундек-4-ену, подальше хімічне відновлення цього продукту дає 2,2-диметилтетрагідротіопіран-4-спіро-2’-піперазин (C10H23N2S) за схемою:

б) Конденсація ацетону з сечовиною за схемою:

в) Конденсація диненасичених кетонів з сечовинами за схемою:
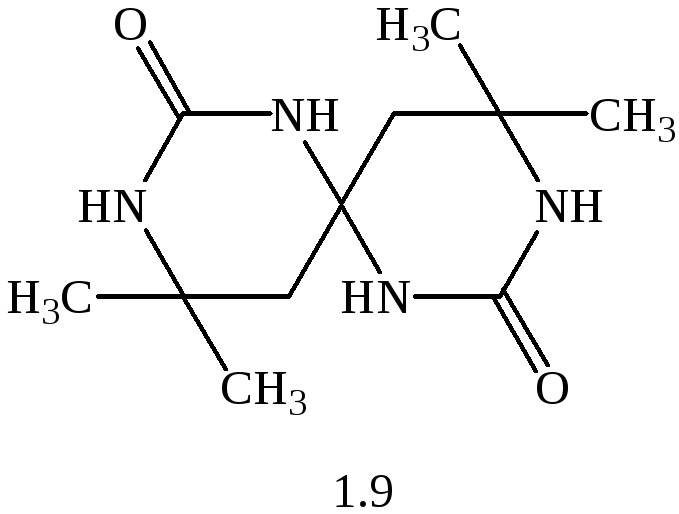
Конденсація форона (1.8) з сечовиною (1.1) приводить до 6,6,6',6'-тетраметил-2,2'-діоксо-4,4'-спiробі(гексагідропіримідину) (1.9):

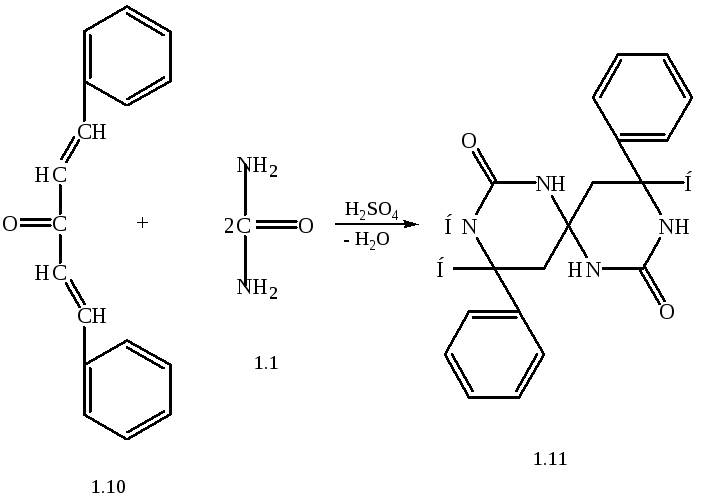
Конденсація дибензиліденацетону (1.10) з сечовиною (1.1) приводить до відповідного похідного:
6,6',-дифеніл-2,2'-діоксо-4,4'-спiробі(гексагідропіримідину) (1.11):
Сучасні досліди показують, що конденсація сечовини чи тіосечовини з діалкілкетонами дає гетероцикли типу (1.12, 1.13):
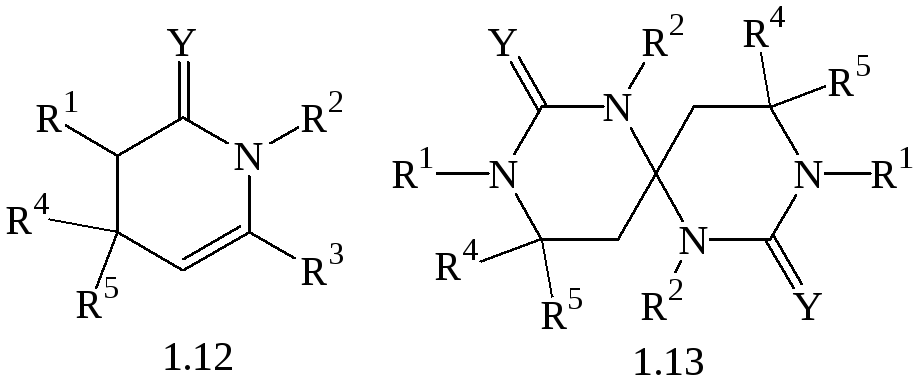
Гетероцикли типу (1.12) можуть бути одержані з великим виходом реакцією сечовини чи тіосечовини з α,β-ненасиченими кетонами відповідно до принципу вінілуреідоалкілування.
В присутності лугу 4,6,6-триметил-1,2,3,6-тетрагідропіриміди-нони-2 (1.14) конденсуються з бензальдегідом, утворюючи 6,6-диметил-4-стирил-1,2,3,6-тетрагідропіриміди-нони-2 (1.15) [27]:

Сечовина приєднується до сполуки (1.14) у кислому середовищі утворюючи 6,6-диметил -2 - оксогексагідропіримідин-(4-спіро-4)-6 фенилгексагідропіримідинон-2 [27]

4-метил-тетрагидропіримідинони(тиони)-2
(1.14) можуть конденсувyтися
з ацетоном у присутності кислоти,
утворюючи 4-ізобутиліден-тетрагидропиримидинони(тиони)-2
(1.17), які в реакції з сечовинами або
тіосечовинами, утворюють
тетрагидропиримидинони(тиони)-2-(4-спиро-4)
тетрагидропиримидинони(тиони)-2(1.18).
Додавання сечовини або тиосечовини до
(1.15) приводе до утворення
4-метил-уріидо(тиоуріидо)
гексагидропиримидинони(тиони)-2(1.17),
який також утворює (1.18)у кислому середовищі
з ацетоном
[28].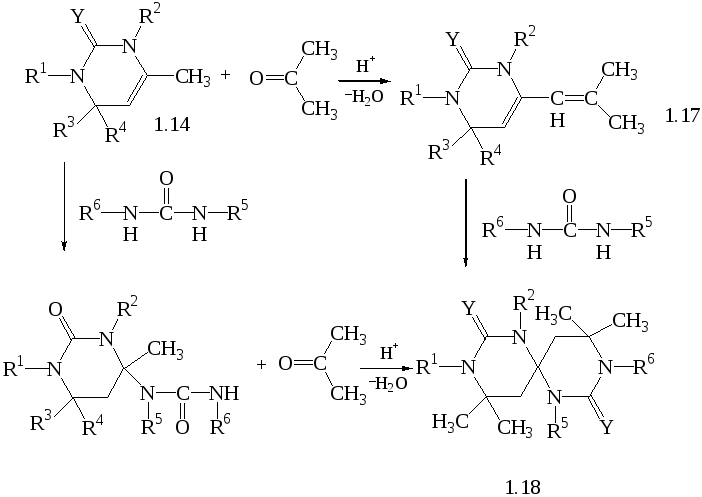
Спіросполука (1.18) (R1=R2=R5=R6=H, R3=R4=CH3,У=О) також можна отримати прямою конденсацією сечовини з ацетоном у присутності хлороводню [29].
Розділ 2 синтез спірокарбону та його аналогів
2.1. Одержання спірокарбону та його аналогів
Спірокарбон являє собою спіросполуку, що складається з двох гетероциклів кожен з яких містить два атоми нітрогену та чотири атоми карбону, один з яких є спiльним. Кожне кільце містить карбонільну групу. Цикли перебувають в транс- конфiгурацiї вiдносно спiльного атома карбону у зв’язку iз стеричними перешкодами та взаємним вiдштовхуванням неподiлених пар електронiв атомiв нiтрогену при спiльному атомi карбону:
Синтез спірокарбону був здійснений двома шляхами. Кожен з них ґрунтувався на взаємодії сечовини з кетонами або їх похідними у присутності сильної концентрованої кислоти. В основі метода А лежить взаємодія сечовини з ацетоном у спiввiдношеннi 2:3 в присутності концентрованої сульфатної кислоти(1.2):
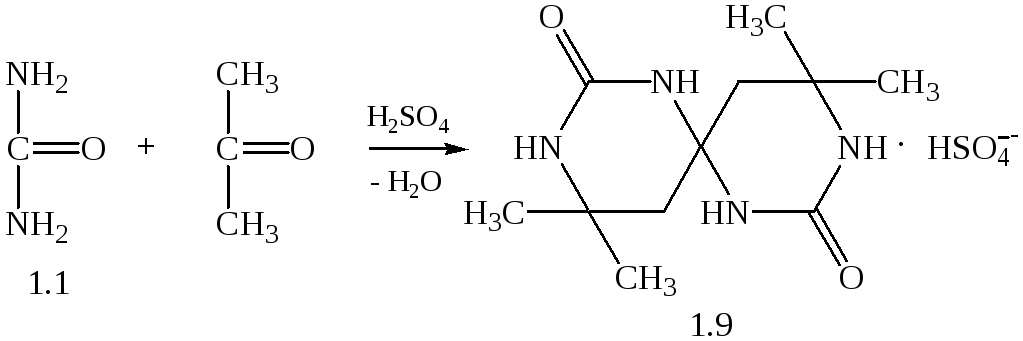
В результаті реакції одержується сульфатнокисла сіль спірокарбону.
Cпірокарбон можна одержати й методом Б. Він ґрунтується на взаємодії сечовини з фороном (1.8) у присутності концентрованої сульфатної кислоти:

Форон, можна одержати альдольно-кротоновою конденсацією ацетону в кислому або лужному середовищі:

Механiзм реакцiї конденсацiї сечовини з ацетоном полягає в тому, що спочатку вiдбувається протонiзацiя молекули ацетону з утворенням карбкатiону. Далi вiдбувається атака карбкатiону атомом нiтрогену молекули сечовини, що має неподiлену електронну пару. Утворенi промiжнi частинки конденсуються мiж собою та ще однією молекулою ацетону за участi концентрованої сульфатної кислоти з утворенням молекули сульфатнокислого продукту:
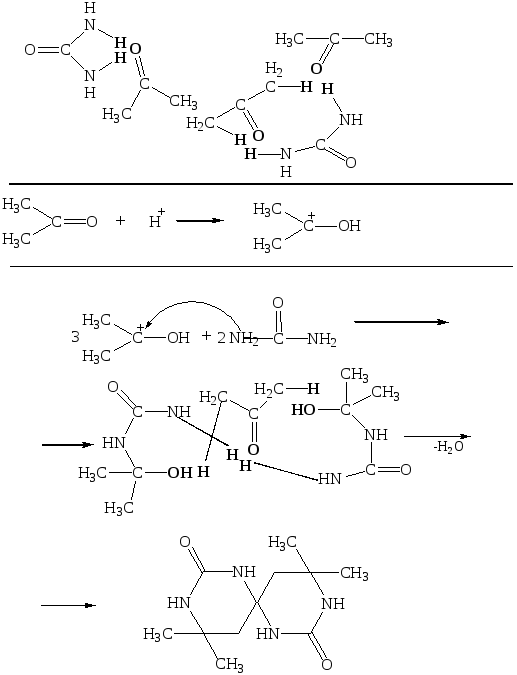
Спірокарбон одержують нейтралізацією його сульфатнокислої солі концентрованим розчином лугу із подальшою перекристалізацією з води(2.1):

Чистий продукт представляє собою безбарвнi голчастi кристали мало розчинні у воді. Вихід продукту за методом А складає 79%, за методом Б – 84%.
Отже на перший погляд може здатися, що одержувати спiрокарбон безпосередньо з форону ефективнiше, нiж з ацетону. Але насправдi метод А є бiльш рентабельним, оскiльки вихiд продукту при одержаннi форону є не таким високим, i якщо пiдрахувати вихiд продукту при одержаннi спiрокарбону з форону, враховуючи ефективнiсть одержання самого форону то загальний вихiд бажаного продукту складе менше 79%. Тобто найбiльш рацiонально синтезувати спiрокарбон безпосередньо з ацетону та сечовини.
Були спроби здійснити синтез спірокарбону за методом Б , тобто через стадію одержання форону(1.8), але його вихід дуже малий, тому одержав спірокарбон в малій кількості.
Були спроби одержати аналоги спірокарбону методом А, але синтез не вдався, тому на сучасному етапі намагаюся здійснити синтез аналогів спірокарбону методом Б.
Були спроби здійснити синтез аналогу спірокарбону на основі тіосечовини за наведеною схемою реакції:

Але прямим шляхом за наведеною схемою одержати дану сполуку не вдалося внаслідок сильного осмолення, з якої виділити дану речовину не вдалося.
Була спроба синтезувати аналог спірокарбону на основі метилпохідної сечовини:
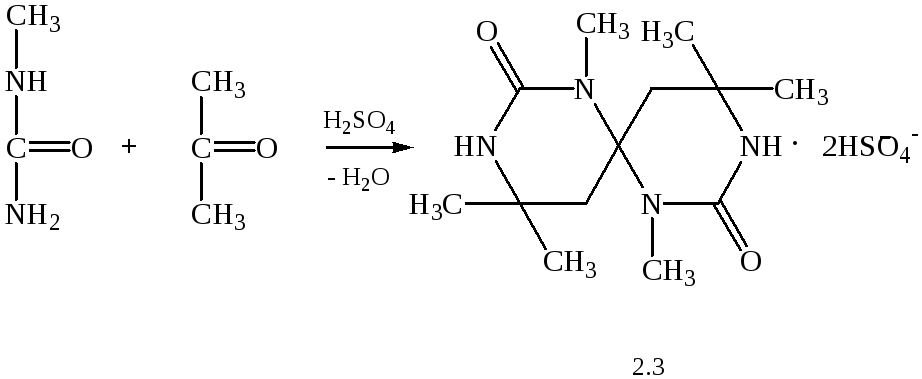
Але прямим шляхом за наведеною схемою одержати дану сполуку не вдалося внаслідок сильного осмолення, з якої виділити дану речовину не вдалося.
Були спроби здійснити синтез аналогу спірокарбону через стадію одержання 1,4-пентадієн-3-ону:


Вдалося одержати сполуку, але результати елементарного аналізу та ЯМР-спектроскопії не підтвердили справжність даної речовини.
ПМР-спектр: 1,91м (2H, CH2); 3,52 – 3,54д (2H, CH2); 7,10м (1H, NH); 7,25м(1Н, NH).
Таблиця 2.1.
