- •Розділ 1
- •1.2. Фізико-хімічна механіка як наукова дисципліна, її задачі
- •1.3. Дисперсні системи. Класифікація дисперсних систем з позицій фізико-хімічної механіки композиційних матеріалів
- •1.3.6. Періодичні колоїдні системи.
- •1.4. Особливості властивостей колоїдних систем
- •1.5. Короткий історичний огляд
- •Розділ 2
- •2.2. Змочування і набухання
- •2.3. Спонтанні процеси на межі розділу фаз
- •Розділ 3
- •3.2. Теорія мономолекулярної адсорбції Ленгмюра
- •3.3. Полімолекулярна адсорбція
- •3.4. Рівняння Гіббса. Двомірний тиск
- •3.5. Правило Дюкло-Траубе
- •3.6. Адсорбція на межі тверде тіло – розчин
- •Розділ 4
- •4.2. Класифікація пар за хімічною будовою
- •4.3. Аніоноактивні пар
- •4.4. Катіоноактивні пар
- •4.5. Класифікація пар за механізмом дії
- •4.6. Термодинамічні, поверхневі й об'ємні властивості розчинів пар у зв'язку зі стійкістю дисперсних систем
- •4.7. Використання пар в техніці
- •Розділ 5
- •5.1.1. Будова подвійного електричного шару (пдеш)
- •5.2. Стійкість і коагуляція дисперсних систем
- •5.3. Седиментаційна (кінетична) стійкість
- •5.4. Процеси стабілізації дисперсних систем і їхня роль у техніці
- •Розділ 6
- •6.2. Загальні відомості про структуроутворення в дисперсних системах
- •Розділ 7
- •7.2. Методи реологічного моделювання
- •7.3. Криві течії і в'язкості
- •7.4. Методика побудови реологічних кривих
- •7.5. Моделі і рівняння течії структурованих дисперсних систем
- •7.6. Про реологічні криві течії і в'язкості структурованих рідин на прикладі цементобетонних сумішей
- •Іі частина
- •8.2. Розчинення в'яжучих речовин
- •8.3. Основні закономірності кінетики кристалізації нової фази з пересичених розчинів і фазовий склад цементного каменю
- •8.4. Формування структури цементного каменю
- •Розділ 9
- •9.2. Основні параметри вібраційного ущільнення бетонної суміші
- •9.3. Вібродиспергування та виброперемішування суміші
- •9.4. Основи технології виробництва дорожніх бетонів на основі органічних в'яжучих
- •9.4.2. Принцип та метод визначення температури перемішування сумішей
- •9.4.3. Температурні параметри приготування сумішей
- •9.4.4. Змочування кам'яних матеріалів в'яжучим як фактор якості перемішування
- •9.4.5. Зміст процесу ущільнення асфальтобетону.
- •9.4.6. Шляхи інтенсифікації ущільнення сумішей
- •Розділ 10
- •10.1. Склад, структура і властивості кам'яновугільних дорожніх дьогтів
- •10.2 Склад, структура і властивості нафтових дорожніх бітумів
- •10.3. Бітумні емульсії
- •10.3.2. Бітумні емульсії – мікрогеторогенні дисперсні системи
- •10.3.3. Технологія виробництва
- •Технічна характеристика диспергатора дб – 1
- •Технічна характеристика триступеневого диспергатора
- •10.3.4. Фізико-механічні властивості та технологічні вимоги.
- •10.3.5. Галузі застосування.
- •Бітумополімерні в’яжучі і асфальтобетони на їх основі
- •Розділ 11
- •11.2. Дьогтебетон
- •11.3. Асфальтобетон
- •11.3.1. Утомленісна довговічність асфальтобетонів і роль агресивних середовищ
- •11.4. Дьогтебетони і асфальтобетони з комплексно-модифікованою мікроструктурою
- •Рекомендована література до вивчення теоретичного матеріалу
3.6. Адсорбція на межі тверде тіло – розчин
Кількість речовини , молекулярно адсорбованої з розчину, обчислюють за рівнянням (3.16.):
 (3.16)
(3.16)
де: С0 і С1 – початкова і рівноважна концентрація адсорбтиву, мольл-1; V – об’єм розчину, л, з якого відбувається адсорбція, m – кількість адсорбенту, г; 1000 – перевідний множник, що застосовується для того, щоб отримані в результаті підрахунку величини виражалися в ммольг-1.
Якщо відома питома поверхня адсорбенту, величину адсорбції відносять до одиниці поверхні (до см2, м2).
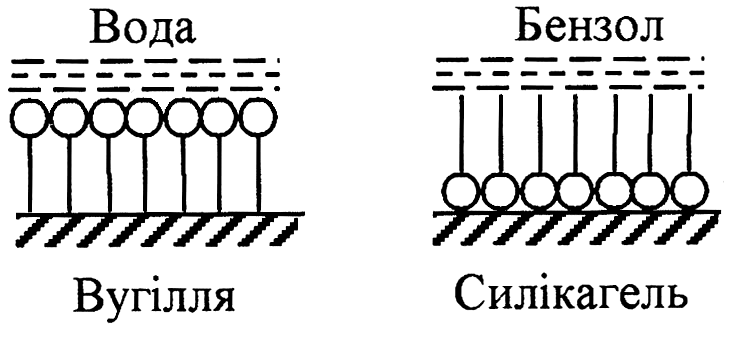
При адсорбції з розчину розчинник і розчинена речовина є конкурентними. Таким чином, чим гірше адсорбується дисперсійне середовище на адсорбенті, тим краще буде відбуватися адсорбція розчиненої речовини на поверхні твердого тіла. В першому наближенні, виходячи з термодинамічних міркувань можна вважати, що чим вище поверхневий натяг чистого середовища, тим менше його молекули спроможні до адсорбції на твердому тілі і тим краще на ньому буде адсорбуватися розчинена речовина. Саме тому адсорбція на твердому тілі звичайно добре йде з водних розчинів і значно гірше із розчинів в вуглеводнях, спиртах і інших рідинах, які характеризуються порівняно малим поверхневим натягом. В першому наближенні можна також прийняти, що чим краще середовище розчиняє адсорбтив, тим гірше йде в цьому середовищі адсорбція. Так, коли адсорбція жирної кислоти відбувається на гідрофільному адсорбенті (наприклад, силікагелі) з вуглеводного середовища (наприклад, бензолу), адсорбція з зростанням молекулярної маси жирної кислоти не зростає, як це повинно бути за правилом Дюкло-Траубе, а падає, тому що вищі жирні кислоти краще розчинні в неполярному середовищі.
На адсорбцію з розчинів впливає природа і пористість адсорбенту. Неполярні адсорбенти, як правило, краще адсорбують неполярні адсорбтиви, а полярні адсорбенти – полярні адсорбтиви.
Відносно впливу хімічної природи адсорбтива на його спроможність адсорбуватися важко зробити які не будь узагальнення, бо адсорбованість в цьому випадку сильно залежить від природи адсорбенту і середовища, які можуть бути полярними і неполярними речовинами. Все ж найбільш важливим правилом є відоме правило зрівнювання полярності П.О. Ребіндера.
Правило зрівнювання полярності П.О. Ребіндера.
Відповідно до цього правила речовина С може бути сорбованою на поверхні розподілу фаз А і В, якщо вона в результаті своєї присутності в поверхневому шарі буде вирівнювати різницю полярності цих фаз.
Інакше кажучи, адсорбція буде йти, якщо полярність речовини С, яку характеризує, наприклад, діелектрична проникність ε, буде лежати між полярністю речовин А і В, тобто при дотриманні умови
εА εс εу або εА < εс < εу
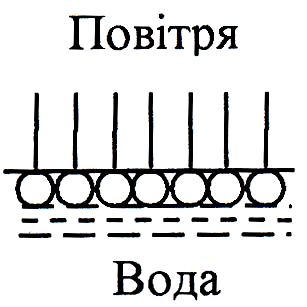
У системі “вода (ε = 81) – толуол (ε = 2,4) – анілін (ε = 7,8)” останній є ПАР. З правила зрівнювання полярностей також випливає, що чим більше різниця полярностей між розчиненою речовиною і розчином, тобто, чим менше розчинність розчиненої речовини, тим краще вона буде адсорбуватися. Теж правило П.О. Ребіндера визначає, що дифільні молекули поверхнево-активної речовини повинні орієнтуватися на межі розділу адсорбент – середовище, таким чином, що своєю полярною частиною молекули будуть звернуті до полярної фази, а неполярною частиною молекули – до неполярної (повітря вважають неполярною фазою). Орієнтацію молекул дифільних речовин (наприклад, молекул жирної кислоти) на межі розділу фаз між фазами різної природи пояснює схема, що представлена на рис. 3.9.
|
|
|
Рис. 3.9. Схема орієнтації дифільних молекул на границі розподілу фаз різної природи