
- •Министерство образования и науки российской федерации
- •Гоу впо череповецкий государственный университет
- •Методические указания к практическим занятиям по курсу «физическая химия»
- •Учебно-методическое пособие
- •Введение
- •1. Первый закон термодинамики
- •1.1. Термодинамические процессы
- •1.2. Теплоемкость. Зависимость теплоемкости от температуры.
- •1.3. Закон Гесса
- •1.4. Зависимость теплового эффекта химической реакции от температуры:
- •2. Второй закон термодинамики
- •2.1 Вычисление изменения энтропии в различных процессах
- •2.2. Вычисление изменения изобарного и изохорного потенциалов в различных процессах
- •3. Химическое равновесие
- •3.1. Расчет равновесий по экспериментальным данным
- •3.2. Расчеты по уравнениям изотермы, изобары и изохоры химической реакции
- •Основной
- •162600, Г. Череповец, пр. Луначарского, 5
2.2. Вычисление изменения изобарного и изохорного потенциалов в различных процессах
В изобарно-изотермическом процессе (Р, Т = const) критерием направления процесса и равновесия является изобарно-изотермический потенциал или свободная энергия Гиббса: ∆G ≤ 0. При равновесии G минимальна. В изохорно-изотермическом процессе (V, T = const) критерием направления процесса и равновесия служит изохорно-изотермический потенциал или свободная энергия Гельмгольца: ∆F ≤ 0. При равновесии F минимальна.
Изменения ∆G и ∆F при постоянной температуре рассчитываются по формулам: ∆G = ∆H – T ∆S и ∆F = ∆U – T ∆S.
Из этих уравнений видно, что свободная энергия G или F являются частью полного запаса энергии системы Н или U за вычетом связанной энергии T S. Свободная энергия может быть извлечена из системы и превращена в работу: -∆G = Aр макс и -∆F = = AV макс , где Aр макс – максимальная полная работа; AV макс – максимальная полезная работа.
При расширении или сжатии идеального газа при постоянной температуре
![]()
Зависимость ∆G и ∆F от температуры выражается уравнением Гиббса – Гельмгольца. Для ∆G в интегральной форме оно записывается так:
![]()
или в пределах от 298 до Т:
![]() ,
,
здесь ∆Н = f(T).
Для химической реакции
∆G = ∆F + ∆nRT,
где ∆n – изменение числа моль газообразных участников реакции.
Пример 9
Вычислить изменение свободной энергии Гиббса при изотермическом сжатии 10 м3 кислорода от 1,013 · 105 до 10,13 · 105 Н/м2 при 298 К. Газ считать идеальным.
Решение
![]() ,
,
![]()
![]()
Пример 10
Определить
стандартное изменение свободной энергии
Гиббса
![]() и свободной энергии Гельмгольца
и свободной энергии Гельмгольца![]() для реакции
для реакции
![]() ,
,
пользуясь данными следующей таблицы:
|
Вещество |
|
|
|
|
226,75 |
200,30 |
|
|
-285,84 |
69,96 |
|
|
-484,90 |
159,80 |
|
|
0 |
130,60 |
Решение
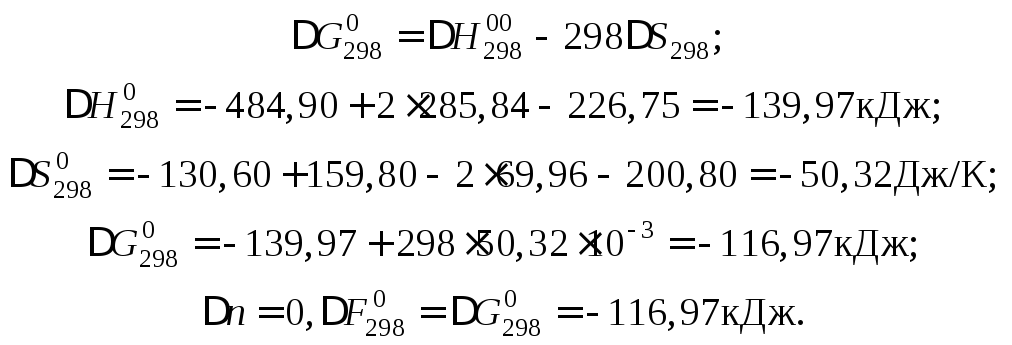
3. Химическое равновесие
3.1. Расчет равновесий по экспериментальным данным
Для гомогенной химической реакции в газовой фазе
A A + b B = d D + g G (4)
условием равновесия является равенство нулю суммы химических потенциалов всех компонентов:
![]() .
(5)
.
(5)
Химический потенциал компонента есть функция его парциального давления:
![]() .
(6)
.
(6)
Здесь
![]() - химический потенциалi-го
компонента в стандартном состоянии
(при Рi
= 1 атм),
является функцией только температуры.
- химический потенциалi-го
компонента в стандартном состоянии
(при Рi
= 1 атм),
является функцией только температуры.
Из уравнения (5) следует, что
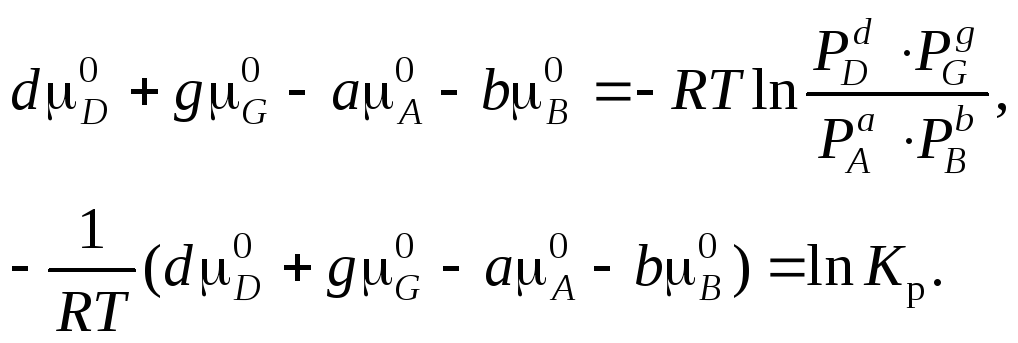
Отсюда
![]() (7)
(7)
Выражение (7) представляет собой закон действующих масс. Kр – константа равновесия, она зависит только от температуры и не зависит от парциальных и общего давлений.
Постоянство Kр при постоянной температуре означает, что постоянно соотношение между парциальными давлениями компонентов, а состав газовой фазы в общем случае может меняться. Изменение парциального давления хотя бы одного из веществ влечет за собой изменение парциальных давлений всех остальных, но таким образом, чтобы Kр оставалась постоянной.
Константу равновесия Kр можно выразить также через равновесные концентрации компонентов, числа моль и мольные доли, выразив эти величины через парциальные давления:
![]()
Если обозначить через
![]() ;
;
![]() ;
;![]() ,
,
получим:
![]() ;
;
![]() ;
;
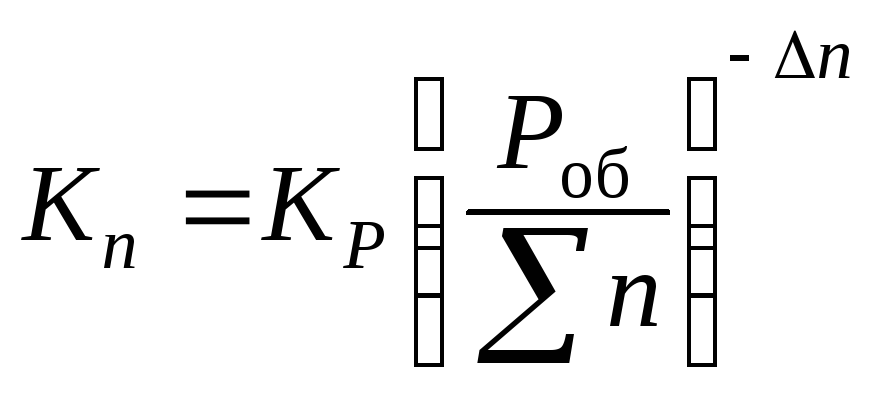 при
∆n
≠ 0.
при
∆n
≠ 0.
Здесь ∆n – изменение числа моль газообразных участников реакции, ∆n = d + g – a – b.
Для гетерогенных реакций с участием газообразных веществ константа равновесия Kр выражается только соотношением парциальных давлений газообразных реагентов, так как давления насыщенных паров твердых и жидких веществ, участвующих в реакции, не зависят от их количества, а зависят только от температуры и при постоянной температуре остаются постоянными. Их можно внести в константу равновесия. Например, для реакции
aAтв
+ bBг
= dDтв
+ gGг,
![]() .
.
При расчетах равновесий по экспериментальным данным возникает необходимость находить степень превращения веществ. Степенью превращения вещества в химической реакции называется отношение числа моль вещества, вступившего в реакцию, к исходному числу моль этого вещества. Так, если в реакции (4) было взято nA моль вещества A, nB моль вещества В и образовалось Х моль вещества D и Х моль вещества G, то степени превращения исходных веществ А и В выразятся уравнениями:
![]()
![]() .
.
Расчет равновесий по экспериментальным данным обычно сводится к определению состава равновесий смеси газов по константе равновесия или, наоборот, к нахождению константы равновесия по начальной нестехиометрической смеси газов и степени превращения.
Пример 11
При 1000 К и 1,013 · 105 Н/м2 из исходной смеси, содержащей 1 моль SO2 и 0,6 моль О2, при достижении равновесия образовалось 0,22 моль SO3 . Определить KР для реакции
2SO2 + O2 = 2SO3
Решение
На образование 0,22 моль SO3, согласно уравнению реакции, израсходовано 0,22 моль SO2 и 0,11 моль O2 .
Записываем число моль реакции:
2SO2 + O2 = 2SO3
в исходной смеси: 1 0,6 0
в равновесной смеси: 0,78 0,49 0,22
Отсюда
![]()
![]()
![]()
![]()
Константа равновесия равна
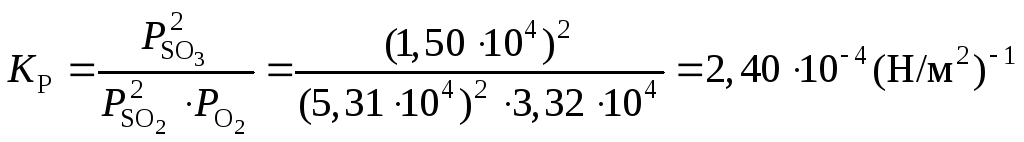 .
.
Пример 12
Для
реакции
![]() при 503 КKР
= 1,28
106
(Н/м2)
-1 . Определить
состав равновесной смеси в объемных
процентах, полученной при давлении
1,013 · 106
Н/м2
из 2 моль С2Н4
и 1 моль HCl.
при 503 КKР
= 1,28
106
(Н/м2)
-1 . Определить
состав равновесной смеси в объемных
процентах, полученной при давлении
1,013 · 106
Н/м2
из 2 моль С2Н4
и 1 моль HCl.
Решение
Обозначим через Х число моль образовавшегося С2Н5Сl. Так как на образование его должно быть израсходовано, согласно химическому уравнению реакции, по Х моль С2Н4 и HCl, то в равновесной смеси останется 2 – Х моль С2Н4 и 1 – Х моль HCl.
Запишем число моль:
С2Н4 + HCl = С2Н5Сl
в исходной смеси: 2 1 0
в равновесной смеси: 2 – Х 1 – Х Х
Отсюда ∑n = 2 – Х + 1 – Х + Х = 3 – Х .
Для парциальных давлений компонентов получаем выражения:
![]() ;
;
![]() ;
;![]() .
.
Тогда
![]()
После преобразований получаем
2,32 Х2 – 6,96 Х + 2,04 = 0.
Решая квадратное уравнение, находим Х1 = 0,44 и Х2 = 2,55 .
Так как Х < 1 из условия, второй корень не имеет физического смысла. Значит, Х = 0,44. Таким образом, в равновесной смеси содержится (2 – 0,44) = 1,56 моль С2Н4, (1 – 0,44) = 0,56 моль HCl и 0,44 моль С2Н5Сl. Состав смеси в объемных процентах определяется из соотношений:
![]() ;
;
![]() ;
;
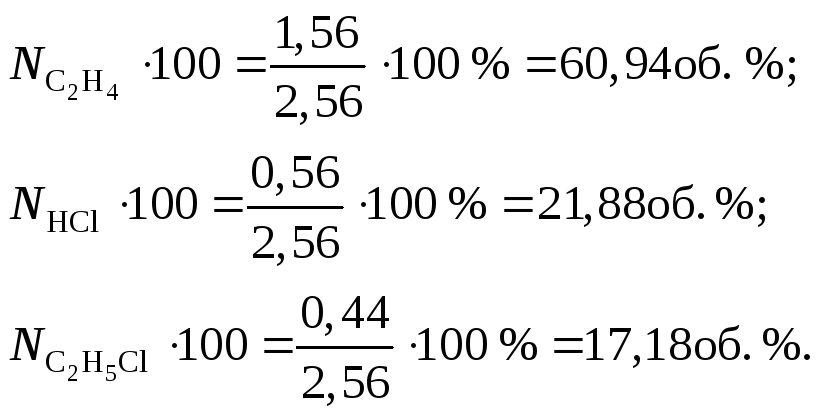
Пример 13
При 573 К для реакции Сграфит + 2Н2 = СН4 константа равновесия равна KР = 1,53·10-3 (Н/м2)-1. Вычислить содержание метана в объемных процентах в равновесной смеси при указанной температуре и давлении 1,013 106 Н/м2.
Решение
Для рассматриваемой гетерогенной реакции
![]() ,
,
учитывая,
что![]() ,
получим
,
получим
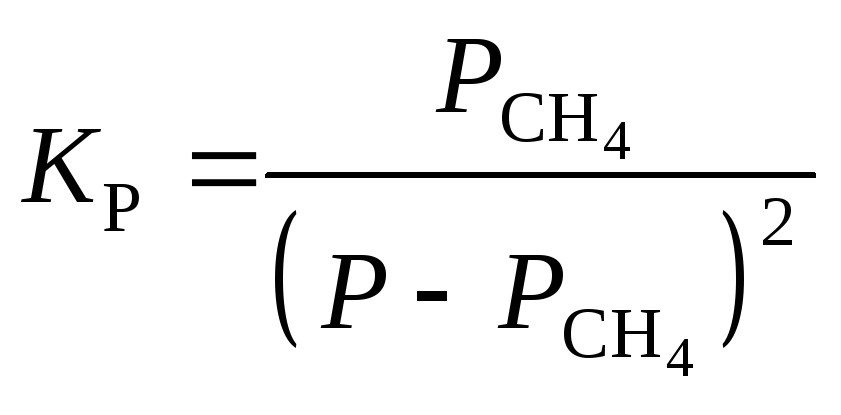 .
.
Решая полученное квадратное уравнение, получим
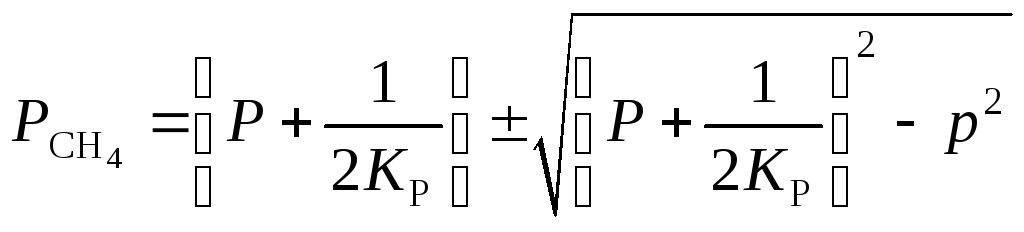 ,
,
подставляем значения Р и KР в данное уравнение и получаем

![]()
![]()
Пример 14
Константа
равновесия реакции 2CuCl
+ H2
= 2Cu
+ 2HCl
равна KР
= 2,13 105
Н/м2
. Сколько граммов меди образуется, если
газовая фаза до начала реакции состояла
из 0,1 моль Н2
![]() и 0,02 мольHCl
(nHCl)?
Общее давление в состоянии равновесия
равно Р
= 1,013 · 105
Н/м2.
и 0,02 мольHCl
(nHCl)?
Общее давление в состоянии равновесия
равно Р
= 1,013 · 105
Н/м2.
Решение
Константа равновесия данной гетерогенной реакции выражается уравнением
![]() ,
,
где
![]() и
и![]() -
парциальные давленияHCl
и H2.
-
парциальные давленияHCl
и H2.
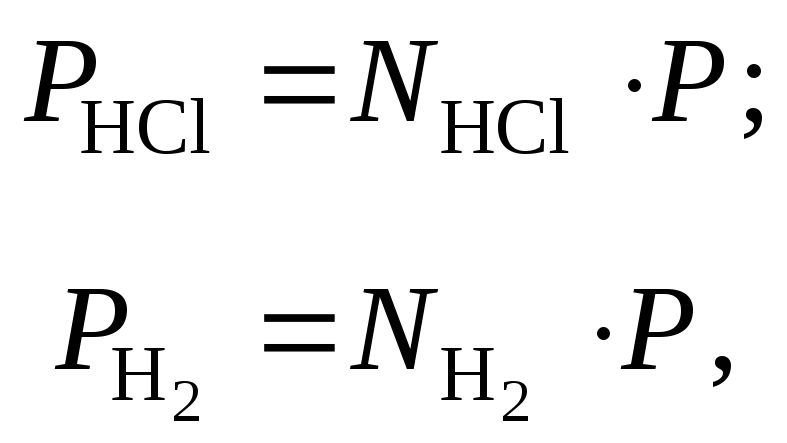
где
![]() и
и![]() -
мольные долиHCl
и H2.
-
мольные долиHCl
и H2.
![]() ,
,
где
![]() .
.
Тогда:
![]()
![]()
![]()
После преобразований получаем уравнение
Х2 + 0,02Х – 0,00406 = 0.
Положительное значение корня: Х = 0,0545. Значит, nравнCu = = 2X = 0,109 моль, gCu = 0,109 63,546 = 6,923 г.
