
1414
.pdf
водяной бане способствует растворению ацетамида). К полученному раствору прибавляют по каплям при перемешивании раствор 1,41 г гидроксида натрия в 5,5 мл воды. Далее желтую реакционную смесь выливают в колбочку емкостью 25 мл и нагревают на кипящей водяной бане до начала реакции, после чего нагревание продолжают еще 2-3 мин. Обычно из раствора, окрашенного в желтый или даже красный цвет, немедленно начинают выпадать кристаллы. Смесь охлаждают на ледяной бане в течение 1 ч, осадок отфильтровывают, промывают ледяной водой, высушивают. Получают 1,73 г (85%) бесцветного продукта, который перекристаллизовывают из спиртов. Температура плавления 169-170оС.
Вопросы к работе
1.Почему для ускорения растворения ацетамида в броме нагревание следует проводить осторожно?
2.Почему добавление водного раствора гидроксида натрия следует проводить по каплям и при перемешивании?
3.Зачем реакционную массу переливают в колбу емкостью 25 мл? Что может произойти при последующем нагревании, если этого не сделать?
4.С какой целью проводится нагревание на заключительной стадии синтеза?
N-(4-метилфенил)-β-D-глюкопиранозиламин
HO |
NH2 |
HO HN |
CH3 |
O |
|
O |
|
OH ~OH + |
|
OH |
|
OH OH |
CH3 |
OH OH |
|
В пробирку помещают 0,89 г п-толуидина, 1,50 г D-глюкозы и 0,3 мл воды. Полученную смесь нагревают на кипящей водяной бане до образования прозрачного раствора (около 15 мин). Далее добавляют 28 мл диэтилового эфира, растирают шпателем, выпавший осадок отфильтровывают. Получают 1,67 г (75%) продукта, который перекристаллизовывают из смеси диэтилового эфира и этилового спирта. Температура плавления 117-118°С.
Вопросы к работе
1.Почему не стоит использовать большее количество воды в этом синтезе?
2.Что является признаком окончания реакции?
41

3.Какой смысл заключается в добавлении большого количества диэтилового эфира? Что при этом происходит? Если осадок не выпадает, то что следует предпринять?
4.Почему для перекристаллизации продукта используют смесь растворителей, а не только диэтиловый эфир или этиловый спирт?
Фумаровая кислота
Катализатор: тиомочевина (Метод А) или HCl (Метод Б)
Метод А. В круглодонную колбу емкостью 15 мл помещают 2,50 г малеиновой кислоты*, 0,05 г тиомочевины, 2 мл воды и полученную смесь нагревают при кипении в течение 2 ч. Затем реакционную массу охлаждают, выпавший осадок отфильтровывают, промывают водой, высушивают. Получают 2,00 г (80%) продукта, который можно перекристаллизовать из кипящей воды (на 1,00 г фумаровой кислоты необходимо около 10 мл воды). Температура плавления 286-287оС.
Метод Б. Смесь 2,50 г малеиновой кислоты*, 3 мл воды и 5 мл конц. соляной кислоты нагревают при кипении в течение 30 мин, полученный раствор охлаждают, выпавший осадок отфильтровывают, промывают водой, высушивают. Получают 1,8 г (72%) фумаровой кислоты, которую перекристаллизовывают из кипящей воды.
*Вместо малеиновой кислоты в обоих методах можно использовать соответствующее количество малеинового ангидрида. Малеиновая кислота образуется из ангидрида уже при растворении в теплой воде.
Вопросы к работе
1.Можно ли, используя эти методы, провести реакцию в обратном направлении и из фумаровой кислоты получить малеиновую кислоту?
2.Какую роль играет добавка тиомочевины в методе А или соляной кислоты в методе Б? Может ли синтез протекать без этих добавок? Ответ поясните.
3.С какой целью в обоих методах реакции проводят при кипячении? Будут ли реакции протекать при комнатной температуре?
42

Приложения
Правила оформления лабораторного журнала
Для записи хода выполнения синтеза каждый студент должен иметь лабораторный журнал. От того, насколько подробно и точно будет сделана запись хода выполнения синтеза, зависит воспроизводимость методики и полученных автором результатов.
Всвязи с этим каждый студент во время лабораторного практикума должен научиться делать правильную запись в журнале. Она ни в коем случае не должна сводиться к переписыванию методики из пособия, которым пользуется студент.
Запись делается во время проведения опыта (нельзя откладывать оформление журнала на конец работы, самые точные записи всегда делаются сразу после наблюдения!).
Влабораторном журнале фиксируются:
-количества взятых веществ, -объем колб и точное описание прибора, в котором выполняется
синтез, -личные наблюдения (изменения окраски, выделения газов,
изменение температуры, отклонение от примененной методики и т.д.),
-все характеристики взятых и полученных веществ, -выходы конечных соединений.
Отчет о выполнении синтеза должен быть оформлен по следующей форме.
1.Название синтеза. Даты начала и завершения работы.
2.Уравнения основной реакции и побочных реакций, механизм.
3.Таблица констант и загрузок. Она должна содержать основные физико-химические константы всех соединений (молярная масса, показатель преломления, плотность, температуры плавления и кипения и т.д.), а также количества взятых в реакцию веществ, выраженные в граммах, ммолях, миллилитрах.
4.Расчет выхода по стехиометрии и другие необходимые расчеты.
5.Рисунки приборов, в которых будут выполняться отдельные этапы синтеза.
6.План работы, содержащий краткий перечень и последовательность операций. План не должен сводиться к переписыванию методики.
43

7.Ход работы, личные наблюдения.
8.Полученные результаты (выход продукта в граммах и процентах, его константы).
Ниже представлен образец оформления журнала на примере лабораторной работы ”Cинтез п-бромацетанилида бромированием ацетанилида” по следующей методике:
В колбу емкостью 50 мл вносят 3,5 г ацетанилида и 9 мл уксусной кислоты. Осторожно подогревают до 30°C, при этом осадок полностью растворяется. В полученный раствор по каплям и при перемешивании добавляют 1,2 мл брома. Перемешивают еще 60 минут, выливают в 80 мл воды. Осадок отделяют фильтрованием. Получают 4,00 г (72%) продукта, который перекристаллизовывают из изопропилового спирта. Температура плавления 167-168оС.
п-Бромацетанилид
Работа выполнена 19-05-2014 г.
Уравнение основной реакции
O |
O |
||||
|
|
|
|
|
|
HN CH3 |
HN CH3 |
||||
Br2
-HBr
Br
Уравнения побочных реакций
|
O |
|
O |
|
|
HN |
CH |
|
HN |
CH3 |
|
|
3 |
|
|
Br |
|
|
+ |
|
|
|
|
|
Br2 |
|
+ |
HBr |
|
O |
|
|
|
O |
|
HN |
CH |
|
HN |
CH3 |
|
|
3 |
|
|
Br |
|
|
+ |
|
|
|
|
|
2 Br2 |
|
+ |
2 HBr |
Br
44
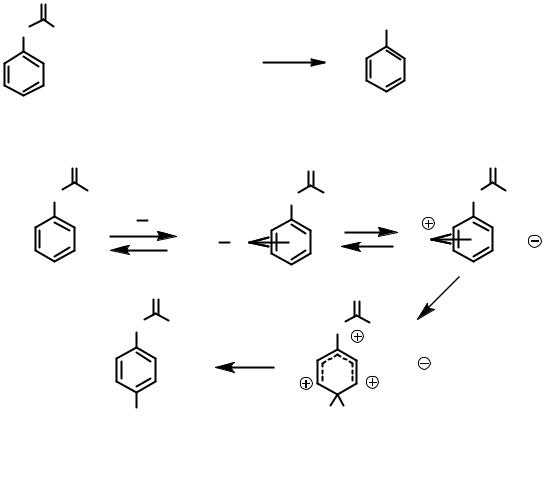
O
HN CH3 |
NH+ |
||
3 |
|
|
|
|
|
|
|
+ H2O + HBr |
Br |
|
+ CH3COOH |
Механизм реакции
Таблица констант и загрузок
|
|
|
|
|
|
|
|
|
Загрузки |
|
||
Название |
М |
Т.кип. |
Т.пл. |
nD20 |
|
d |
содержание% |
|
|
|
|
|
г,Масса |
мл,Объем |
ммоль,во-Кол |
ммоль,Избыток |
|||||||||
вещества |
г/моль |
°С |
°С |
|
|
г/мл |
||||||
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
Ацетанилид |
135,2 |
- |
114 |
- |
|
- |
99 |
3,50 |
- |
25,6 |
2,4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Бром |
159,8 |
58,7 |
|
- |
|
3,119 |
99 |
3,71 |
1,2 |
23,2 |
- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Уксусная |
60,1 |
118,1 |
17 |
1,3715 |
|
1,049 |
99 |
- |
9,0 |
- |
- |
|
кислота |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
п-бром- |
214,1 |
- |
167- |
- |
|
- |
|
|
|
|
|
|
ацетанилид |
|
|
168 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
45 |
|
|
|
|
|
||
Расчеты
Количество взятого ацетанилида (с учетом % содержания): (3,50 × 0,99 × 1000)/135,2 = 25,6 ммоль
Количество взятого брома (с учетом % содержания):
1,2 мл × 3,119 г/мл × 0,99 = 3,71 г или (3,71 ×1000)/159,8 = 23,2 ммоль Теоретический выход продукта: (23,2 ммоль × 214,1 г/моль)/1000 = 4,97 г
Рисунки используемых приборов
План работы
1.Взвешивание 3,5 г ацетанилида, отмеривание необходимых объемов уксусной кислоты (9,0 мл) и брома (1,2 мл).
2.Растворение ацетанилида в уксусной кислоте, охлаждение раствора.
3.Добавление брома по каплям из капельной воронки.
4.Выдержать реакционную смесь при комнатной температуре (1
час).
5.Вылить реакционную смесь в воду (80 мл).
6.Отфильтровать выпавшие кристаллы п-бромацетанилида.
7.Перекристаллизовать полученный продукт из изопропилового
спирта.
46
Ход работы и наблюдения
В коническую колбу емкостью 50 мл поместили холодный раствор ацетанилида в уксусной кислоте. Затем из капельной воронки в колбу по каплям прибавляли 1,2 мл брома. Вначале наблюдается обесцвечивание смеси, к концу реакции раствор приобретает слабо-желтую окраску (избыток непрореагировавшего брома). Уже в процессе реакции началась кристаллизация образовавшегося продукта.
После прибавления брома реакционную смесь выдержали 10 мин при комнатной температуре, затем вылили в стакан на 200 мл, содержащий 80 мл воды, и тщательно перемешали стеклянной палочкой. Сильного желтого окрашивания заметно не было.
Кристаллы отфильтровали на воронке Бюхнера под вакуумом, промыли холодной водой и высушили на воздухе. Получили 3,5 г продукта, 1,8 г из которых перекристаллизовали из изопропилового спирта. Для этого указанную массу вещества поместили в коническую колбу, снабженную дефлегматором, добавили 3 мл изопропилового спирта и нагрели на плитке до кипения. Вещество растворилось не полностью, через дефлегматор добавили дополнительно 2 мл изопропилового спирта и снова довели до кипения; операцию повторяли до полного растворения осадка при кипении (общий объем растворителя, пошедший на перекристаллизацию, составил 10 мл). Горячий раствор профильтровали через складчатый фильтр в предварительно нагретую коническую колбу, медленно охладили до комнатной температуры, затем во льду. Выпали красивые белые кристаллы. Кристаллы отфильтровали на фильтре Шота, промыли небольшим количеством холодного изопропилового спирта. Температуру плавления вещества определяли стандартным способом.
Таблица результатов
Вещество |
|
|
Выход* |
|
Т.пл., оС** |
г |
мл |
Выход от |
Выход от |
||
|
|
|
теории, % |
практики,% |
|
п-бром- |
3,5 |
- |
70,4 |
87,5 |
166-169 |
ацетанилид |
|
|
|
|
|
*Выход от теории: выход от максимально возможного по уравнению реакции (в нашем примере 4,97 г). Выход от практики: выход от приведенного в методике (в нашем примере 4,00 г).
**В случае, если конечное вещество представляет собой при комнатной температуре жидкость, то вместо температуры плавления указывают температуру кипения и nD20.
47
После окончания работы студент предъявляет оформленный лабораторный журнал преподавателю. Если преподаватель считает, что работа выполнена верно, и лабораторный журнал оформлен правильно, то работа подписывается преподавателем. В конце семестра происходит защита всех выполненных студентом лабораторных работ.
Правила техники безопасности
Основные положения, о которых студент должен помнить всегда при выполнении практикума по органической химии:
1.Все работы в лаборатории должны проводиться в хлопчатобумажных халатах, застегивающихся спереди.
2.При работе в лаборатории органической химии всегда нужно помнить, что органические соединения в той или иной мере ядовиты
ивзрывоопасны. Поэтому необходимо соблюдать чистоту, аккуратность, быть внимательным, не допускать соприкосновения веществ с кожей, не трогать руками лицо и глаза, не принимать пищи во время работы.
3.От действия агрессивных веществ необходимо защищать руки резиновыми анатомическими или кислото-щелочестойкими перчатками.
4.Категорически запрещается оставлять действующие приборы без наблюдения и одному работать в лаборатории.
На всех банках, склянках и на любой другой посуде, в которой хранятся реактивы, должно быть указано их название.
Пользоваться реактивами неизвестного происхождения категорически запрещается!!!
5.Нельзя проводить какие бы то ни было опыты в загрязненной посуде. Посуду следует мыть сразу после окончания опыта.
6.Нельзя наклоняться над сосудом, в котором что-либо кипит или в который наливается какая-нибудь жидкость (особенно едкая). При нагревании жидкости в пробирке отверстие ее не должно быть направленно ни на кого из работающих в лаборатории.
7.Категорически запрещается пробовать химические вещества на вкус. Нюхать вещества можно только, если есть полная уверенность, что они не ядовиты. При этом, не делая глубокого вдоха, не наклоняясь над сосудом, следует направлять к себе пары или газы движением руки.
48
8.При работе со стеклом и химической посудой необходимо соблюдать правила предосторожности во избежание ранения осколками. Тонкостенную химическую посуду нагревают не прямо на поверхности плитки, а на подложенный под дно сосуда асбест. Большие химические ёмкости с жидкостями следует поднимать только двумя руками, поддерживая стакан одной рукой за дно.
9.Перед тем как начать загрузку реагентов, нужно тщательно осмотреть прибор и убедиться в том, что он правильно собран. Внутреннее пространство любого прибора, не предназначенного для работы под давлением или под вакуумом, во избежание взрыва всегда должно иметь сообщение с атмосферой.
10.Во время работы дверцы вытяжного шкафа нельзя открывать больше чем на треть рабочего сечения шкафа. Категорически запрещается производить работу в вытяжном шкафу с полностью поднятыми дверцами, просовывать голову внутрь вытяжного шкафа. При вспышках в вытяжном шкафу немедленно выключить вентиляцию и закрыть дроссель-клапан, так как в противном случае пожар может распространиться по вентиляционному каналу.
11.Переливать кислоты и растворы щелочей можно только в вытяжном шкафу, закрыв дверцу так, чтобы лицо было защищено от возможных брызг.
12.Не нейтрализованные едкие отработанные жидкости категорически запрещается выливать в раковину. Их надо предварительно нейтрализовать или сливать в специальные бутыли.
13.О любых опасных случаях (возгораниях, неисправности электроприборов, опасности утечки токсичных соединений и т.п.) необходимо незамедлительно сообщать преподавателю.
14.Первая помощь при несчастных случаях: при попадании щелочи или кислоты на кожу обожженное место нужно промыть струей воды в течение 20-30 мин. При попадании щелочи или кислоты в глаз нужно промывать его длительное время большим количеством воды, направляя струю прямо в глаз. Вода должна иметь комнатную температуру. Во всех случаях после оказания первой помощи пострадавший должен быть отправлен в медпункт.
Работа с легковоспламеняющимися жидкостями.
1. Все работы с легковоспламеняющимися жидкостями должны проводиться только в вытяжном шкафу. При этом по соседству не должно быть открытого огня и включенных плиток. Нагревать такие жидкости можно только на банях, наполненных соответствующими теплоносителями.
49

2. Категорически запрещается выливать в канализацию отходы горючих органических растворителей. Их нужно сливать в специальные бутыли.
Действия в случае пожара.
1.В случае возникновения пожара надо прежде всего выключить плитки и прочие электрические приборы, унести находящиеся поблизости горючие вещества, а затем тушить пламя углекислотным огнетушителем, песком или используя противопожарное одеяло. Песок применяют при загорании небольших количеств веществ.
2.Воду нельзя применять для тушения горящих жидкостей, не смешивающихся с водой. Будучи легче воды они образуют на ее поверхности тонкую пленку, что приводит к распространению пожара. Водой нельзя тушить электропроводку и электроустановки, находящиеся под напряжением.
3.Если загорелась одежда, то на пострадавшего следует набросить противопожарное одеяло. Пострадавший должен броситься на пол, и, перекатываясь по полу, гасить горящую одежду. Пострадавшему нельзя давать бежать.
Примеры установок для проведения экспериментов
5 |
6 |
|
5 |
6 |
4 |
7 |
|
4 |
7 |
3 |
8 |
3 |
|
8 |
2 |
9 |
2 |
|
9 |
1 |
101 |
|
1 |
10 |
Рис. 1. Прибор с насадкой Рис. 2. Прибор для фракционной перегонки Дина-Старка
50
