
- •Глава 9 Водородный показатель среды. Гидролиз солей.
- •9.1. Водородный показатель среды.
- •Определение рН-среды колориметрическим методом
- •Бесцветная форма малиновая окраска
- •Изменение окраски наиболее распространенных индикаторов в зависимости от реакции среды
- •9.2. Гидролиз
- •Гидролиз солей.
- •9.3. Вопросы для самоконтроля.
- •9.4. Комплексные тесты для самоконтроля по темам «Водородный показатель среды, гидролиз» Вариант № 1
- •Вариант № 2
- •Вариант № 3
- •9.5. Вопросы и упражнения для самостоятельной работы по изучению темы.
- •9.6. Ответы на задания тестов для самоконтроля
Глава 9 Водородный показатель среды. Гидролиз солей.
9.1. Водородный показатель среды.
Вода является слабым электролитом. Обратимый процесс диссоциации этого электролита можно представить следующим уравнением:
Н2ОН+ + ОН–.
Значение константы диссоциации позволяет судить о том, что равновесие процесса диссоциации воды смещено в сторону исходных веществ.

Концентрацию воды [Н2О] в знаменателе предыдущей дроби можно считать величиной постоянной и равной:
[Н2О] =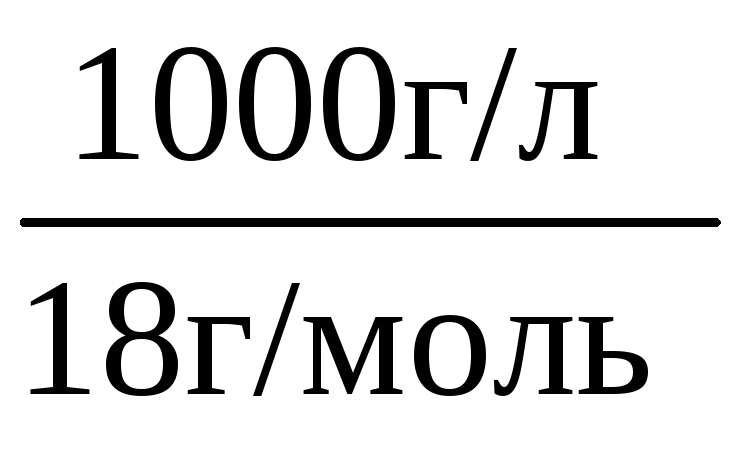 =
55,56 моль/л.
=
55,56 моль/л.
Таким образом,
[Н2О] ∙Кдисс. = [Н+]∙ [ОН ] = 55,56 ∙ 1,8 ∙ 10–16= 10–14.
Эту величину, представляющую собой произведение концентраций ионов водорода на концентрацию ионов гидроксила называют ионным произведением воды, или константой воды Kw:
Кw= [Н+]∙ [ОН ] = 10–14.
Ионное произведение воды Kwявляется постоянной величиной как для чистой воды, так и для разбавленных растворов любых электролитов.
Величина ионного произведения воды увеличивается при повышении температуры.
В чистой воде концентрации гидроксид – ионов и ионов водорода равны:
[
 Н+]
= [ОН] =√Kw
=√10–14 = 10–7моль/л.
Н+]
= [ОН] =√Kw
=√10–14 = 10–7моль/л.
Для оценки реакции среды была введена специальная величина – водородный показатель среды, или рН, представляющая собой логарифм концентрации ионов Н+ с обратным знаком:
рН = – lg[H+].
Для чистой воды:
рН = – lg10–7= 7.
Если в растворе концентрация ионов Н+ больше, чем 10–7моль/л, то рН такого раствора будет меньше 7, что является показателемкислой среды раствора.
Если [Н+] < 10–7моль/л, то рН > 7 и раствор имеетщелочную реакцию среды.
Логарифм концентрации ионов ОН– с обратным знаком называется гидроксильным показателем.
рОН = – lg [ОH–].
Сумма величин водородного и гидроксильного показателей является постоянной величиной для любого водного раствора
рН +рОН = 14.
Зная одну из этих величин, легко определить другую.
-
рН
Концентрация, моль/л
Среда
ионов водорода
гидроксид-ионов
< 7
> 10–7
< 10–7
Кислая
7
= 10–7
=107
Нейтральная
> 7
< 10–7
> 10–7
Щелочная
Величина концентрации (активности) ионов водорода в растворе практически определяется, в основном, двумя методами – колориметрическим и потенциометрическим.
Определение рН-среды колориметрическим методом
Колориметрические методы определения реакции среды основаны на свойстве некоторых веществ изменять свою окраску в зависимости от активности ионов водорода в растворе. Такие вещества получили название кислотно - основных индикаторов. Наиболее распространенными в лабораторной практике индикаторами являются такие вещества, какфенолфталеин, метилоранж и лакмус.
Кислотно-основные индикаторы обычно представляют собой сложные органические вещества: это слабые электролиты, обладающие кислотными или основными свойствами. Любой индикатор такого рода диссоциирует в растворе по уравнению:
HIndH++Ind–,
IndOHInd++OH–,
где HInd и IndOH – молекулярная форма индикатора; Ind–и Ind+– ионная форма индикатора.
Окраска раствора, в котором индикатор находится в молекулярной форме, отличается от окраски раствора, содержащего индикатор в ионной форме. Например, в нейтральном растворе фенолфталеина, обладающего слабыми кислотными свойствами, равновесие сдвинуто влево, и бесцветная молекулярная форма преобладает над ионной формой:
HIndH++Ind–,
