
- •Глава 9 Водородный показатель среды. Гидролиз солей.
- •9.1. Водородный показатель среды.
- •Определение рН-среды колориметрическим методом
- •Бесцветная форма малиновая окраска
- •Изменение окраски наиболее распространенных индикаторов в зависимости от реакции среды
- •9.2. Гидролиз
- •Гидролиз солей.
- •9.3. Вопросы для самоконтроля.
- •9.4. Комплексные тесты для самоконтроля по темам «Водородный показатель среды, гидролиз» Вариант № 1
- •Вариант № 2
- •Вариант № 3
- •9.5. Вопросы и упражнения для самостоятельной работы по изучению темы.
- •9.6. Ответы на задания тестов для самоконтроля
Бесцветная форма малиновая окраска
Поэтому раствор бесцветен. Прибавление в раствор щелочи вызовет смещение равновесия вправо, что характеризуется усилением окраски, характерной для ионной формы индикатора и раствор становится малиновым.
Таблица 9.1
Изменение окраски наиболее распространенных индикаторов в зависимости от реакции среды
-
Индикатор
Окраска в среде
среда
кислая
среда
нейтральная
среда
щелочная
Фенолфталеин
бесцветный
бесцветный
малиновый
Метилоранж
красный
оранжевый
желтый
Лакмус
красный
фиолетовый
синий
Таким образом, переход одной окраски, характерной для молекулярной формы кислотно-основного индикатора, в другую, свойственную его ионной форме, происходит под влиянием Н+или ОН–ионов, то есть зависит от рН раствора.
Изменение окраски наиболее распространенных индикаторов в зависимости от реакции среды приведено в табл. 9.1.
9.2. Гидролиз
Гидролизом называется процесс взаимодействия вещества с водой, в результате которого нарушается ионное равновесие процесса диссоциации воды и меняется реакция среды.
Гидролиз является частным случаем реакций сольволиза, т.е. реакций обмена между растворителем и растворенным веществом.
В рамках ионной теории Аррениуса механизм протекания гидролиза объясняется следующим образом. Вода, хотя и в незначительной степени, диссоциирует на ионы Н+и ОН–. Если в результате гидролиза образуется малодиссоциирующее основание, то часть ионов ОН–оказываются связанными, а равное им количество ионов Н+– свободными, что и обусловливает кислую реакцию раствора. Наоборот, если в результате гидролиза связывается часть ионов Н+, то равное количество ионов ОН–остается свободным, что и обусловливает щелочную среду раствора.
Гидролизу подвергаются: соли, углеводы, белки, мыла, сложные эфиры, жиры, феноляты (щелочная среда), алкоголяты, галогенангидриды и другие вещества.
Гидролиз солей.
Гидролиз солей–это обменное взаимодействие ионов соли с молекулами воды, в результате которого смещается равновесие электролитической диссоциации воды и меняется реакция среды.
Соли – это сложные вещества, диссоциирующее на катионы металла и аниона кислотного остатка. Соли могут быть образованы:
-сильным основанием и сильной кислотой,
- сильным основанием и слабой кислотой,
- слабым основанием и сильной кислотой,
- слабым основанием и слабой кислотой.
Гидролизу подвергаются только те соли, которые образуют при диссоциации ион от слабого электролита. Соли, образованные сильными основаниями и сильными кислотами гидролизу не подвергаются. Таким образом,возможность протекания гидролиза соли определяется наличием иона от слабого электролита.
Соли, образованные слабым основанием и слабой кислотой, гидролизуются практически полностью, а в других случаях гидролиз идет незначительноипреимущественно по первой ступени(один моль ион слабого электролита взаимодействует только с одним моль молекул воды).
Реакцию среды, имеющую место в результате
протекания процесса гидролиза, можно
прогнозировать по иону от сильного
электролита, входящего в состав соли.
Если соль образована анионом слабой
кислоты (S2–,
![]() и др.) и катионом сильного основания, то
происходит гидролиз по аниону, а среда
будет щелочной.
и др.) и катионом сильного основания, то
происходит гидролиз по аниону, а среда
будет щелочной.
Например, карбонат натрия Na2CO3в растворе подвергается гидролизу по
аниону, так как соль образована слабой
угольной кислотой (![]() – анион от слабого электролита).
– анион от слабого электролита).
Процесс гидролиза в этом случае сопровождается образованием малодиссоциирующего гидрокарбонат – иона. Так как в растворе появляется избыток гидроксид – ионов, то раствор будет иметь щелочную реакцию среды (рН > 7).
Na2CO3 + Н2О NaНСО3 + NaOH
2Na+
+
![]() + HOH
HCO3–
+ 2Na+
+ OH–
+ HOH
HCO3–
+ 2Na+
+ OH–
среда щелочная рН > 7.
В соответствии с законом действующих масс гидролиз по аниону протекает тем интенсивнее, чем слабее кислота.
Если соль образована катионом слабого основанияианионом сильной кислоты, то происходитгидролиз по катиону, а среда становится кислотной.
Примером служит процесс взаимодействия с водой нитрата меди (II) Сu(NO3)2. Гидролиз в этом случае обусловлен образованием малодиссоциирующих частиц (CuOH)+. В результате равновесие электролитической диссоциации воды смещается вправо и в растворе появляется избыток ионов водорода, поэтому реакция среды становится кислой (рН < 7). Очевидно, чем слабее основание, тем полнее идет гидролиз.
В общем случае гидролиз протекает незначительно и, преимущественно, по первой ступени.
Сu(NO3)2 + Н2О СuOHNO3 + HNO3
Cu2+
+
![]() + HOH
(CuOH)+
+ H+ +
2NO3 –
+ HOH
(CuOH)+
+ H+ +
2NO3 –
среда кислая рН < 7.
Соль, образованная катионом слабого основанияианионом слабой кислоты подвергается гидролизуипо катиону и по аниону.
Примером служит процесс взаимодействия сульфида хрома (III)Cr2S3с водой. Растворы солей такого типа, в зависимости от соотношения констант диссоциации образующихся при гидролизе кислоты и основания, могут иметь либо слабокислую, либо слабощелочную реакцию среды, т.е. величина реакции среды в растворах таких солей близка к нейтральному значению (рН ≈ 7).
Гидролиз солей, образованных слабым основанием и слабой кислотой, протекает достаточно глубоко (практически полностью):
Cr2S3 + 6Н2О 2 Cr(OH)3 ↓ + 3H2S↑
среда близка к нейтральной рН ≈ 7.
Гидролиз некоторых солей, образованных очень слабыми основаниями и кислотами, является практически необратимым процессом, например гидролиз сульфидов и карбонатов Al3+, Cr3+, Fe3+. Эти соединения нельзя получить в водном растворе. При взаимодействии солей Al3+, Cr3+и Fe3+в растворе с сульфидами и карбонатами в осадок выпадают не ожидаемые сульфиды и карбонаты этих катионов, а их гидроксиды:
2AlCl3 + 3Na2S + 6H2O 2Al(OH)3 ↓ + 3H2S ↑+ 6NaCl
2CrCl3 + 3Na2CO3 + 6H2O 2Cr(OH)3↓+ 3CO2↓ + 6NaCl.
В рассмотренных примерах происходит взаимное усиление гидролиза двух солей (AlCl3и Na2S или CrCl3и Na2CO3) и реакция идет практически до конца.
Соли, образованные сильным основанием и сильной кислотой, гидролизу не подвергаются.
В этом случае равновесие диссоциации воды в присутствии ионов соли почти не нарушается. Поэтому растворы таких солей имеют практически нейтральную реакцию среды.
В растворе хлорида натрия(NaCl) гидролиз не протекает, так как соль образована сильным основанием и сильной кислотой. Среда нейтральная, рН = 7.
Если соль содержит однозарядный катион (анион) и многозарядный анион (катион), то возможен ступенчатый гидролиз. Образующиеся в результате гидролиза по первой ступени по аниону кислые соли могут подвергаться дальнейшему взаимодействию с водой. Однако вторая и последующая ступени гидролиза выражены менее сильно. Это обусловлено изменением величин констант диссоциации соответствующих электролитов.
Например, поскольку ион
![]() диссоциирует слабее, чем Н2СО3,
то он образуется, в первую очередь, при
гидролизе карбоната натрия (Na2CO3):
диссоциирует слабее, чем Н2СО3,
то он образуется, в первую очередь, при
гидролизе карбоната натрия (Na2CO3):
Iступень: Na2CO3+ Н2ОNaНСО3+ NaOH,
IIступень: NaНСО3+ Н2ОNaOH + H2CO3.
Гидролиз солей слабых многоосновных кислот по второй и третьей ступеням протекает мало и содержание в растворе продуктов гидролиза по этим ступеням незначительно и их можно не учитывать в расчетах.
Сульфаталюминия Al2(SO4)3– в водном растворе соль подвергается гидролизу, так как образована слабым основанием и сильной кислотой. Среда – кислая. Гидролиз протекает в малой степени и, преимущественно, по первой ступени.
Молекулярное уравнение гидролиза:
Al2(SO4)3+ 2Н2О2AlOHSO4+H2SO4.
Полное ионно-молекулярное уравнение гидролиза:
2Al3++
![]() + 2HOH2AlOH2++ 2H++
+ 2HOH2AlOH2++ 2H++
![]()
среда кислая рН < 7.
Краткое ионно- молекулярное уравнение гидролиза:
2Al3+ + 2HOH 2AlOH2+ + 2H+,
Al3+ + HOH AlOH2+ + H+.
Гидролиз солей, в ряде случаев, может протекать очень сложно. Продукты гидролиза некоторых солей можно установить точно лишь на основании аналитического исследования.
Поскольку при обратимом гидролизе устанавливается динамическое равновесие, то, в соответствии с законом действующих масс, можно сместить равновесие в ту или иную сторону введением в раствор кислоты или основания. Этим часто пользуются для усиления или подавления процесса гидролиза.
Константа диссоциации воды увеличивается при повышении температуры в большей степени, чем константы диссоциации продуктов гидролиза – слабых кислот и оснований, поэтому при нагревании степень гидролиза возрастает.
Так как реакция нейтрализации является реакцией экзотермической, то гидролиз, будучи противоположным ей процессом, эндотермичен. Поэтому, в соответствии с принципом Ле-Шателье, повышение температуры вызывает усиление гидролиза.
В соответствии с тем же принципом процесс гидролиза проходит полнее при разбавлении раствора, так как увеличивается концентрация воды.
Одной из количественных характеристик процесса гидролиза является степень гидролиза (h).
Степень гидролиза– это отношение числа молекул, подвергшихся гидролизу (N) к общему числу молекул в растворе (N0):
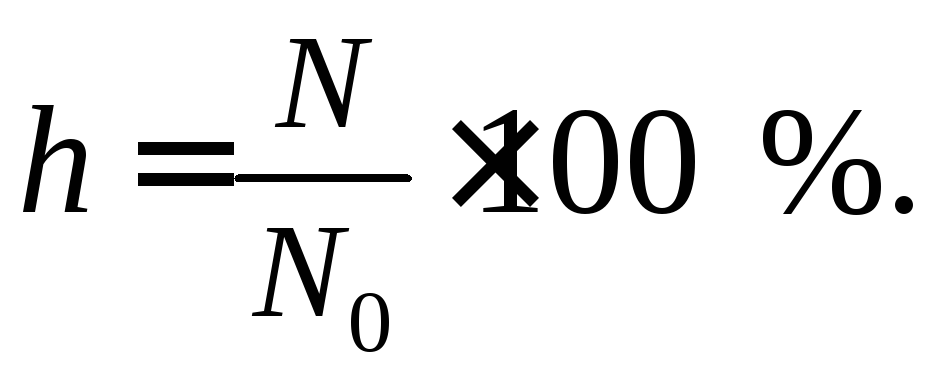
Степень гидролиза изменяется в пределах от 0 до 100 %.
Другой количественной характеристикой процесса гидролиза является константа гидролиза, характеризующая собой равновесия процесса гидролиза.
Если соль образована слабой кислотой, то константа гидролиза равна отношению константы воды и константы диссоциации слабой кислоты (см. табл. 8 приложения).

Если соль образована слабым основанием, то константа гидролиза равна отношению константы воды и константы диссоциации слабого основания.
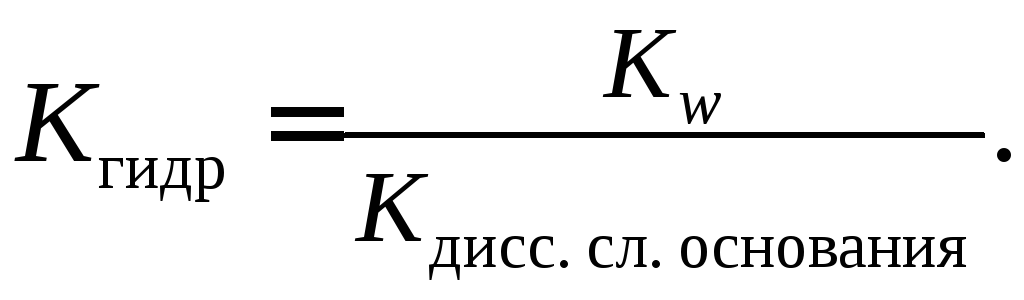
Если соль образована слабым основанием и слабой кислотой, то константа гидролиза равна отношению: в числителе – константа воды, а в знаменателе – произведение констант диссоциации слабой кислоты и слабого основания.

Из приведенных формул следует, что чем слабее электролит, образовавший соль, тем больше значение константы гидролиза и тем глубже протекает процесс гидролиза. Значения величин констант диссоциации ряда слабых кислот приведены в табл. 8 приложения.
