
Lekcija_8
.pdf
Лекция 8
Тема: Физико-химия поверхностных явлений в функционировании живых систем. Адсорбция
Цель лекции: познакомить студентов с особым энергетическом состоянии поверхностного слоя веществ на границах раздела двух фаз; с поверхностным натяжением; с явлением адсорбции, еѐ природой. Рассмотреть различные виды адсорбции.
План:
1.Адсорбционные равновесия и процессы на подвижных границах раздела фаз.
2.Адсорбция на неподвижной границе раздела фаз
3.Удельная адсорбция.
4.Уравнение Ленгмюра
5.Адсорбция на границе твердое тело-жидкость.
6.Адсорбция растворенного в жидкости вещества на твердом адсорбенте
7.Факторы, влияющие на ионную адсорбцию.
I. Адсорбция на поверхности растворов. Уравнение Гиббса. Изменение концентрации растворѐнного вещества в поверхностном
слое раствора (или вообще на границе раздела фаз) называется адсорбцией. Дж. Гиббс на основе второго закона термодинамики в 70-х гг. XIX в.
вывел важное уравнение, связывающее величину адсорбции со способностью растворѐнного вещества изменять поверхностное натяжение раствора:
Г = с d RT dc
где Г – количество адсорбированного вещества, моль/м2; с – молярная концентрация растворѐнного вещества, моль/дм3, Т – температура, при
которой происходит адсорбция, R – газовая постоянная, |
|
d |
– |
|
dc |
||||
|
|
|
поверхностная активность.
Уравнение Гиббса отражает следующую зависимость: чем сильнее уменьшается поверхностное натяжение с увеличением концентрации адсорбируемого вещества, тем больше его поверхностная активность. Это свидетельствует о том, что знак «минус» указывает на обратную зависимость между величиной адсорбции Г и поверхностным натяжением σ.
Если 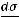 < 0, то Г > 0, т.е. адсорбция положительна (вещество накапливается на поверхности раздела фаз), это характерно для ПАВ. Если
< 0, то Г > 0, т.е. адсорбция положительна (вещество накапливается на поверхности раздела фаз), это характерно для ПАВ. Если

же 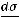 > 0, то Г < 0, т.е. адсорбция отрицательна (вещество накапливается в
> 0, то Г < 0, т.е. адсорбция отрицательна (вещество накапливается в
объѐме), это характерно для ПИВ.
Адсорбция вещества – обратимый процесс, заканчивающийся установлением адсорбционного равновесия, при котором скорость адсорбции равна скорости обратного процесса – десорбции.
В 1915 г Ленгмюр ввел понятие об ориентации молекул ПАВ в поверхностном слое.
Исходя из строения молекул ПАВ, Ленгмюр сформулировал принцип независимости поверхностного действия, заключающийся в том, что при адсорбции полярная группа молекулы, обладающая большим сродством к полярной фазе, втягивается в воду, в то время как неполярный радикал выталкивается в неполярную фазу. Происходящее при этом уменьшение свободной поверхностной энергии ограничивает размеры поверхностного слоя толщиной в одну молекулу. Образуется мономолекулярный слой.
II.Адсорбция на неподвижной границе раздела фаз
Под адсорбцией на неподвижной границе раздела фаз понимается накопление одного вещества на поверхности другого.
Твѐрдое вещество, на поверхности которого накапливается другое вещество, называется адсорбентом, а поглощаемое вещество – адсорбтивом. Уже адсорбированное вещество называется адсорбатом.
В зависимости от природы сил, действующих между адсорбентом и адсорбатом различают физическую и химическую адсорбции.
Физическая адсорбция обусловлена межмолекулярным взаимодействием за счѐт сил Ван-дер-Ваальса (ориентационных, индукционных и дисперсионных) или водородной связью. Поэтому для этого вида адсорбции характерны: обратимость, неспецефичность, экзотермичность.
Химическая адсорбция осуществляется при взаимодействии адсорбента с адсорбатом с образованием химической связи. Энергия возникающих при этом связей 40 – 400 кДж/моль. Хемсорбция практически необратима, специфична и локализована. Повышение температуры усиливает химическую адсорбцию.
III.Удельная адсорбция
При адсорбции веществ на поверхности твѐрдых адсорбентов изменяется химический состав поверхности адсорбента. Количественной характеристикой этого процесса является величина удельной адсорбции Г.
Удельная адсорбция – это равновесное количество поглощаемого вещества, приходящееся на единицу поверхности или массы адсорбента.
В качестве адсорбентов обычно применяют мелкоизмельченные вещества или пористые тела, что обеспечивает большую площадь поверхности раздела фаз, которую определить практически невозможно. Поэтому удельная адсорбция для твердых адсорбентов преимущественно выражается в молях поглощенного вещества на единицу массы адсорбента:
Г = 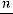 (моль/г),
(моль/г),
где n –количество адсорбата, моль; m – масса адсорбента, г.
Адсорбция газов и паров адсорбата на твердых адсорбентах – процесс, протекающий за счет сил Ван-дер-Ваальса и водородных связей. Количество поглощенного газа или пара на твѐрдых поверхностях зависит от следующих факторов.
1.От свободной поверхностной энергии адсорбента. Она весьма велика у адсорбентов с аморфной структурой (активированный уголь) и у кристаллических веществ (оксиды алюминия, кремния). Адсорбент тем эффективнее, чем меньше измельчен.
2.От сродства адсорбтива к поверхности адсорбента. Полярные вещества лучше адсорбируются на полярных адсорбентах, а неполярные на неполярных. Чем больше адсорбент склонен к межмолекулярным взаимодействиям, тем интенсивнее идет адсорбция.
3.При физической адсорбции из смеси газов или паров лучше адсорбируется тот компонент, который легче сжимается, поскольку его молекулы более склонны к межмолекулярным взаимодействиям
4.От концентрации адсорбата. Зависимость имеет сложный характер, так как с адсорбцией идет одновременно процесс десорбции. При равенстве
скоростей этих процессов наступает равновесие. IV. Уравнение Ленгмюра
Ленгмюр предложил уравнение адсорбции:
Г = |
|
Kc |
|
|
|
|
Kc |
|
1 |
||
Где Г∞ - значение предельной адсорбции; с – равновесная концентрация адсорбента в системе; К – константа адсорбционного равновесия.
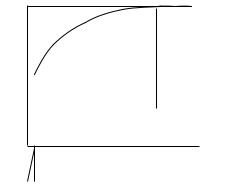
Зависимость адсорбции от концентрации ПАВ (изотерма адсорбции) имеет вид:
|
α |
α∞ |
III |
|
II |
I |
с∞ |
с |
|
|
Рис. 4. Зависимость адсорбции от концентрации ПАВ На кривой четко видны три участка:
I - ый участок – это прямая линия, выходящая из начала координат. Действительно, при малых концентрациях, когда с → 0 и (1 + Кс) ≈1, уравнение принимает вид Г = Г∞·Кс, т.е. величина адсорбции прямо пропорциональна концентрации или давлению адсорбата.
III – участок – соответствует прямой, параллельной оси абсцисс, что означает, что адсорбция достигла своего предельного значения. При этом Кс ›› 1 и (1 + Кс) ≈ Кс, тогда Г = Г∞ (произошло насыщение поверхности адсорбента молекулами адсорбата, так как сформировался мономолекулярный слой).
II – ой участок соответствует криволинейной части графика и описывается полным уравнением Ленгмюра.
V.Адсорбция на границе твердое тело-жидкость.
Существенным отличием адсорбции веществ из растворов является конкуренция между растворенным веществом и растворителем за возможность взаимодействовать с адсорбционными центрами на поверхности твердого адсорбента. Рассматривая этот вид адсорбции, остановимся на следующем:
1.При адсорбции из раствора важным фактором является величина удельной поверхности адсорбента и его сродство к поглощаемому веществу. Гидрофильные адсорбенты (силикагель, глины, пористые стекла) хорошо поглощают полярные вещества, а гидрофобные (сажа, активированный уголь) -–неполярные вещества.
2.Природа растворителя:
Чем хуже данный растворитель смачивает поверхность адсорбента и чем хуже растворяет вещество, тем лучше будет происходить адсорбция растворенного вещества.
3.Природа поглощаемого вещества:
а) выполняется правило «подобное взаимодействует с подобным», т.е. должно быть сродство между адсорбентом и адсорбтивом;
б) Выполняется правило Шилова:
Чем больше растворимость вещества в данном растворителе, тем хуже оно адсорбируется на поверхности твердого адсорбента.
в) правило Ребиндера (правило уравнивания полярностей Ребиндера):
На поверхности раздела фаз прежде всего адсорбируются те вещества, при адсорбции которых происходит выравнивание полярностей соприкасающихся фаз, причѐм с увеличением разности полярности фаз способность к адсорбции этих веществ возрастает
Эффективней всего адсорбируются молекулы веществ, имеющих дифильное строение. В этом случае идѐт эффективная адсорбция на твердом адсорбенте с самопроизвольной четкой ориентацией их молекул на границе раздела, выравнивающей полярности фаз. Полярный фрагмент молекулы обращен всегда к полярной фазе – к воде, силикагелю, а неполярный фрагмент – к неполярной (гидрофобной) фазе – активированному углю, маслу.
5.Влияние концентрации растворенного вещества на процесс адсорбции при постоянной Т описывается уравнением Ленгмюра.
6.Повышение температуры снижает эффективность адсорбции. Это объясняется ослаблением взаимодействия между адсорбентом и адсорбатом.
Молекулярная адсорбция из растворов на твердом адсорбенте широко используется в медицинской практике. Активированный уголь хорошо адсорбирует газы, алкалоиды, барбитураты, токсины из пищеварительной системы. Одна таблетка активированного угля массой 0,25 г имеет адсорбционную поверхность около 100 м2.
VI. Адсорбция растворенного в жидкости вещества на твердом адсорбенте
Различают молекулярную и ионную адсорбцию.
Молекулярная адсорбция – это адсорбция из растворов неэлектролитов (или очень слабых электролитов). При молекулярной адсорбции вещество адсорбируется на поверхности твѐрдого тела в виде молекул.
Особенности молекулярной адсорбции: наряду с растворѐнным веществом адсорбируются молекулы растворителя. Поэтому для адсорбции растворѐнного вещества его молекулы должны вытеснять с поверхности молекулы растворителя.
Экспериментально величину адсорбции «а» изучают измеряя молярную концентрацию раствора до контакта с адсорбентом (с0) и после
наступления адсорбционного равновесия (сs): |
|||
a |
c cs |
V |
моль/г, |
m |
|
||
|
|
|
|
а – количество адсорбированного вещества, приходящееся на 1 г адсорбента; m – масса адсорбента, г: V – объѐм раствора, из которого идѐт адсорбция, л.
На молекулярную адсорбцию влияют:
равновесная концентрация растворѐнного вещества;
природа растворителя;
природа адсорбента;
природа растворѐнного вещества;
температура, время адсорбции.
Ионная адсорбция – это адсорбция из растворов сильных электролитов; в этом случае адсорбируется растворѐнное вещество на поверхности твѐрдого адсорбента в виде ионов.
Ионная адсорбция – процесс более сложный, так как в растворе присутствуют уже частицы как минимум 3 видов: катионы, анионы растворѐнного вещества и молекулы растворителя.
Особенности ионной адсорбции
1.Адсорбируются заряженные частицы (ионы), а не молекулы.
2.Адсорбция происходит только на полярных адсорбентах, поэтому еѐ часто называют полярной адсорбцией.
3.Адсорбция сопровождается образованием двойного электрического слоя (ДЭС).
4.Адсорбция является избирательной, т.е. на каждом данном адсорбенте катионы и анионы адсорбируются неодинаково.
5.В основе ионной адсорбции лежат химические силы, и она чаще всего
кинетически необратима.
6.Для ионной адсорбции характерно явление обменной адсорбции.
VII. Факторы, влияющие на ионную адсорбцию.
1.Химическая природа адсорбента
Чем более полярным является адсорбент, тем лучше он адсорбирует ионы из водных растворов. На активных центрах, несущих положительный заряд, адсорбируются анионы, на отрицательных - катионы.
2.Химическая природа ионов

а) На адсорбцию ионов большое влияние оказывает величина радиуса иона. Чем больше кристаллический радиус иона при одинаковом заряде, тем лучше он адсорбируется, так как с увеличением кристаллического радиуса иона возрастает его поляризуемость, а следовательно, способность притягиваться к полярной поверхности – адсорбироваться на ней. Одновременно увеличение кристаллического радиуса приводит к уменьшению гидратации иона, а это облегчает адсорбцию. В соответствии с этим ионы можно расположить в ряды по возрастающей способности к адсорбции. Эти ряды называют лиотропными рядами или рядами Гофмейстера:
Li+ ‹ Na + ‹ K + ‹ Rb + ‹ Cs +
Mg 2+ ‹ Са 2+ ‹ Sr 2+ ‹ Ва 2+
Cl ‾ ‹ Br ‾ ‹ NO3 ‾ ‹ I ‾ ‹ NCS ‾
Адсорбционная способность возрастает
б) Чем больше заряд иона, тем сильнее ион притягивается противоположно заряженной поверхностью твердого тела, тем сильнее адсорбция:
K + ‹‹ Са 2+ ‹‹ Al 3+
Усиление адсорбции
Рекомендуемая литература
Основная литература:
1.Общая химия. Биофизическая химия. Химия биогенных элементов. Учебник для медицинских вузов. (Ю.А. Ершов, В.А. Попков, А.С. Берлянд и др. Ред. Ю.А. Ершов), 8 изд., 560 с. - М.: Высшая шк., 2010 г.
2.Химия. Основы химии живого. Учебник для студентов ВУЗов, обучающихся по естественнонаучным направлениям. В.И. Слесарев. С.-П.: Химиздат.,2001г.
3.Практикум по общей химии. Биофизическая химия. Химия биогенных элементов. Учебное пособие для студентов медицинских вузов (Ред. В.А. Попков). – М.: Высшая школа, 4 изд. 239 с., 2008 г.
4.Сборник задач и упражнений по общей химии. Учебное пособие. (С.А. Пузаков, В.А. Попков, А.А. Филиппова). - М.: Высшая школа, 4 изд. 255 с., 2010.
Дополнительная литература
1.Общая химия. Учебник для медицинских вузов. (В.А. Попков, С.А. Пузаков), 976 с. - М.: ГЭОТАР Медиа, 2007 г.
2.Методические пособия, рекомендации и т.д., изданные кафедрой:
1. Лекции по общей химии для студентов лечебного и педиатрического факультетов (Ю.А. Алексашин, Ю.В. Куляш, Р. Т. Куцемако), Изд-во СГМУ,186 с., Саратов, 2002.
