
Вьюник. Лекция № 15
.pdf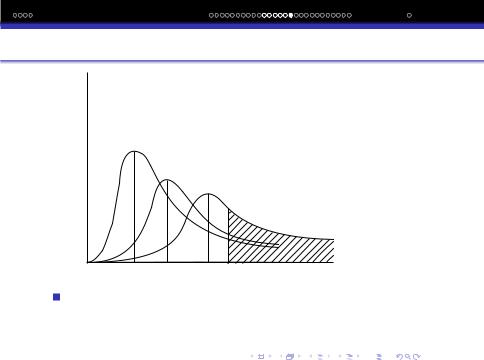
Умови протiкання реакцiй |
Швидкiсть хiмiчної реакцiї |
Хiмiчна рiвновага |
Швидкiсть хiмiчної реакцiї
Вплив температури
доля молекул
T1
T2
T3
Eкінет
Площа пiд кожною кривою пропорцiйна загальному числу молекул. Швидкостi молекул зв‘язанi з енергiєю їх руху. Тому аналогiчний вигляд буде мати i розподiл молекул за
їх енергiєю.
21/33

Умови протiкання реакцiй |
Швидкiсть хiмiчної реакцiї |
Хiмiчна рiвновага |
Швидкiсть хiмiчної реакцiї
Перехiдний стан, енергiя активацiї
Площа пiд кривою дорiвнює загальному числу частинок. Реакцiйноздатними є лише тi частинки, енергiя яких вiдповiдає деякому мiнiмальному значенню, достатньому для здiйснення акту хiмiчної взаємодiї – йому вiдповiдає порiг швидкостi vE.
Вiдповiдна швидкостi vE енергiя (в порiвняннi з середньою енергiєю молекул) i є енергiя активацiї (Ea).
Енергiя активацiї мiнiмальна енергiя достатня для здiйснення акту хiмiчної взаємодiї.
В 1889р С.Арренiус показав, що швидкiсть багатьох вiдомих реакцiй залежить вiд температури i пiдпорядковується
емпiричнiй залежностi: LN k = a+ b , де k - константа швид-
костi, a, b – сталi, характернi дляTданого процесу; b = −ERa , a = LN A, LN k = LN A − RTEa .
22/33
Умови протiкання реакцiй |
Швидкiсть хiмiчної реакцiї |
Хiмiчна рiвновага |
Швидкiсть хiмiчної реакцiї
Перехiдний стан, енергiя активацiї
Рiвняння Арренiуса записують нерiдко в експоненцiальнiй
Ea
формi: k = A·e−RT , де A – передекспоненцiальний умножувальний фактор частоти.
Молекули взаємодiють тiльки тодi, коли їх енергiя ≥ Ea.
Енергiя активацiї i енергiя хiмiчних зв‘язкiв вихiдних молекул. Перетворення H2 +I2 = 2 HI можна реалiзувати через так званий перехiдний стан (промiжний комплекс):
H |
|
H |
|
H |
H |
H |
H |
||||||||
+ |
|||||||||||||||
I |
|
|
I |
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
I |
|
|
I |
I |
I |
||||||
|
|
|
|||||||||||||
|
|
|
|
|
|
||||||||||
Вихідні |
|
Перехідний стан |
Продукти |
||||||||||||
реагенти |
|
(проміжний комплекс) |
реакції |
|
|
||||||||||
23/33

Умови протiкання реакцiй |
Швидкiсть хiмiчної реакцiї |
Хiмiчна рiвновага |
Швидкiсть хiмiчної реакцiї
Перехiдний стан, енергiя активацiї
Перехiдний (активований) стан вiдрiзняється вiд вихiдних молекул H2 i I2 i вiд продуктiв реакцiї молекул HI. В активованому комплексi напiврозiрванi старi зв‘язки i напiвутворенi новi зв‘язки. Недорозкладенi i недоутворенi молекули. Вiдбувається перерозподiл зв‘язкiв.
Утворення активованого комплекса вимагає затрати енергiї. Рiзниця енергiї активованого комплекса i енергiї вихiдних молекул i є енергiя активацiї.
Енергетичний бар‘єр утворюється в результатi взаємного вiдштовхування електронiв хiмiчно не сполучених атомiв. Перехiдний стан, володiючи максимальною енергiєю, є нестабiльним. Його не можна ототожнювати з хiмiчною сполукою.
24/33
Умови протiкання реакцiй |
Швидкiсть хiмiчної реакцiї |
Хiмiчна рiвновага |
Швидкiсть хiмiчної реакцiї
Перехiдний стан, енергiя активацiї
Оскiльки вихiднi молекули ще не розпалися, а вже почали формуватися зв‘язки молекул продуктiв реакцiї, то природно Eакт < енергiї розриву зв‘зкiв в молекулах вихiдних речовин.
Тобто утворення перехiдного стану процес енергетично бiльш вигiдний, чим повний розпад вихiдних молекул. Тому утворення активованого комплексу характерне для бiльшостi процесiв.
25/33
Умови протiкання реакцiй |
|
|
Швидкiсть хiмiчної реакцiї |
Хiмiчна рiвновага |
||
Швидкiсть хiмiчної реакцiї |
|
|
|
|||
Перехiдний стан, енергiя активацiї |
|
|
|
|||
H |
|
|
|
|
|
|
H |
H |
|
|
H |
H |
|
I |
I |
E |
E |
I |
+ |
|
I |
|
|||||
|
|
|
|
|
||
∑Hвих |
ΔHp |
|
|
|
|
|
|
ΔHp<0 |
|
∑Hпр. р. |
|
||
|
|
|
|
|
||
|
|
Реакційний шлях |
|
|
|
|
26/33

Умови протiкання реакцiй |
Швидкiсть хiмiчної реакцiї |
Хiмiчна рiвновага |
Швидкiсть хiмiчної реакцiї
Перехiдний стан, енергiя активацiї
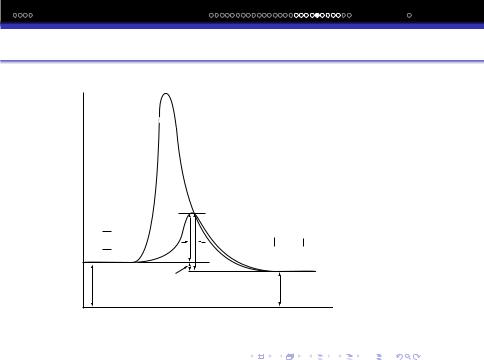
Якби для здiйснення даного процесу необхiдною була дисоцiацiя молекул (H2 i I2), а не послаблення зв‘язкiв, то
→
E = EH−H + EI−I = 435.6 + 151.3 = 586.9Кдж/моль (пунктирна крива).
← |
→ ← |
E = 2EHI = 2 · 299.7 = 599.4 Кдж/моль. Hp = E − E = 586.9 − 599.4 = −12.5 Кдж/моль.
→←
Насправдi E = 171.3 Кдж/моль, а E = 183.9 Кдж/моль.
З точки зору термодинамiки обидва процеси еквiвалентнi. H не залежить вiд шляху за яким розвивається процес.
→←
Тому рiзниця E − E також дорiвнює -12.5Кдж/моль.
З точки зору хiмiчної кiнетики бiльш вигiдним є процес, який iде з утворенням активованого комплекса.
27/33
Умови протiкання реакцiй |
Швидкiсть хiмiчної реакцiї |
Хiмiчна рiвновага |
Швидкiсть хiмiчної реакцiї
Перехiдний стан, енергiя активацiї
Перетворення активованого комплекса в продукти реакцiї процес завжди екзотермiчний.
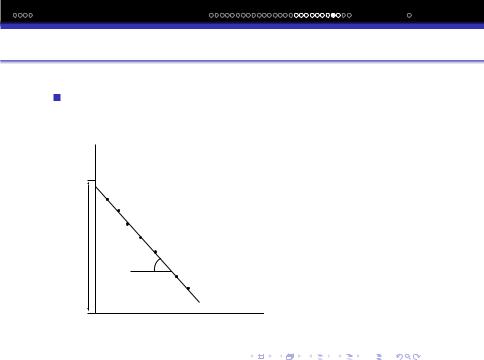
Визначення енергiї активацiї. Для визначення Eакт використовуть рiвняння Арренiуса в логарифмiчнiй формi. Згi-
дно з цим рiвнянням графiчна залежнiсть LN k − T1
мою лiнiєю, за кутом нахилу якої можна визначити Eакт
(tgα = −2.3REакт ).
28/33
Умови протiкання реакцiй |
Швидкiсть хiмiчної реакцiї |
Хiмiчна рiвновага |
Швидкiсть хiмiчної реакцiї
Перехiдний стан, енергiя активацiї
Побудувавши за експериментальними даними указану залежнiсть, находять або графiчним, або аналiтичним методом тангенс кута нахилу прямої.
Lg k
lg A
α
1/T
29/33

Умови протiкання реакцiй |
Швидкiсть хiмiчної реакцiї |
Хiмiчна рiвновага |
Швидкiсть хiмiчної реакцiї
Перехiдний стан, енергiя активацiї
Для переважної бiльшостi процесiв Eакт складає 65 − 250 Кдж/моль. Для реакцiй за участю атомiв i радикалiв Eакт < 60 − 65 Кдж/моль, а для iонних реакцiй - близька до 0.
Iз рiвняння Арренiуса видно, що температура сильно впливає на швидкiсть хiмiчної реакцiї. Змiна температури в арифметичнiй прогресiї викликає змiну константи швидкостi реакцiї в геометричнiй прогресiї.
→←
На вiдмiну вiд k i k Kхр зi змiною температури змiнюється порiвняно мало. Чим > Eакт, тим значнiший вплив температури на швидкiсть хiмiчної реакцiї.
30/33
