
- •С.А. Сергеева, в.Е. Рябинин Практикум по химии
- •Учебное пособие
- •Оглавление
- •Введение
- •Тема: Тепловые эффекты химических реакций. Термодинамические характеристики химических и биохимических процессов
- •1. Практическая часть
- •1.3. Контрольные вопросы
- •2. Экспериментальная часть Лабораторная работа. Определение стандартной теплоты (энтальпии) реакции нейтрализации
- •Экспериментальные данные и результаты измерений
- •4. Вопросы по теме для самостоятельного изучения их студентами.
- •Тема: Кинетика химических и биохимических реакций. Химическое равновесие
- •1. Основные понятия химической кинетики:
- •1. Практическая часть
- •1.3. Контрольные вопросы
- •2. Экспериментальная часть
- •Зависимость скорости разложения от ее концентрации //
- •4. Вопросы по теме для самостоятельного изучения их студентами.
- •Приложения а
- •Значения теплоты сгорания некоторых органических веществ, применяемых в медицине
- •Список литературы Основная литература
- •Дополнительная литература
Зависимость скорости разложения от ее концентрации //
|
№ опыта |
Объем, мл |
Общий объем, мл |
моль/л
|
Промежуток времени от начала отсчета до появления мути, сек. |
| ||||
|
|
|
|
|
|
|
| |||
|
1. |
15 |
0 |
15
|
|
|
|
|
|
|
|
2. |
10 |
5 |
|
|
|
|
|
| |
|
3. |
5 |
10 |
|
|
|
|
|
| |
|
4. |
3 |
12 |
|
|
|
|
|
| |
Обработка результатов. Выполните следующие нижеуказанные расчеты:
а)
Для всех проведенных опытов (т.е. 1, 2, 3 и
4-й), пользуясь полученными данными,
определите молярную концентрацию
тиосерной кислоты
![]() по формуле:
по формуле:
1)
![]() .
.
б)
Вычислите для всех проведенных опытов
(т.е. 1, 2, 3 и 4-й)
![]() по
формуле:
по
формуле:
1)
![]() .
.
в) Рассчитайте скорость химической реакции для всех проведенных опытов (т.е. 1, 2, 3 и 4-й) по формуле:
1)
![]()
![]() .
.
Выводы. 1) Постройте график зависимости скорости
 реакции (ось ординат) от концентрации
реакции (ось ординат) от концентрации (ось абсцисс) реагирующих веществ.
Согласно закону действия масс зависимость
скорости реакции от концентрации должна
выражатьсяпрямой
линией,
проходящей через начало координат. 2)
Сделайте вывод о зависимости скорости
реакции от концентрации и определите
порядок реакции.
(ось абсцисс) реагирующих веществ.
Согласно закону действия масс зависимость
скорости реакции от концентрации должна
выражатьсяпрямой
линией,
проходящей через начало координат. 2)
Сделайте вывод о зависимости скорости
реакции от концентрации и определите
порядок реакции.
3. Контроль усвоения темы (тесты для самоконтроля уровня текущих знаний).
Образец теста
«При увеличении температуры на 10 градусов скорость большинства химических реакций увеличивается в 2-4 раза» – это формулировка _____.
1) закона действующих масс
2) закон Генри
3) правила Вант-Гоффа
4) закона Гесса
Отношение произведения равновесных активностей продуктов реакции, взятых в степенях, равных их стехиометрическим коэффициентам, к такому же произведению активностей исходных веществ при данной температуре есть величина постоянная, называемая _____.
1) константой химического равновесия
2) степенью диссоциации
3) свободной энергией Гиббса
4) константой скорости реакции
Если температурный коэффициент скорости равен 3, то при увеличении температуры от
 до
до скорость
химической реакции _____ раз .
скорость
химической реакции _____ раз .
1) увеличится в 27 раз
2) уменьшится в 27 раз
3) увеличится в 81 раз
4)уменьшится в 81 раз
Количественное влияние температуры на скорость химической реакции выражается уравнением _____.
1) Вант-Гоффа
2) Аррениуса
3) Фарадея
4) Рауля
Реакция окисления этанола в организме человека идет по уравнению:
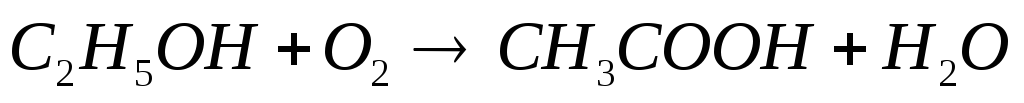 .
При повышении концентрации исходных
веществ в 5 раз скорость данной реакции
_____раз.
.
При повышении концентрации исходных
веществ в 5 раз скорость данной реакции
_____раз.
1) уменьшится в 25 раз
2) увеличится в 25 раз
3) уменьшится в 5 раз
4) увеличится в 5 раз
В организме человека тростниковый сахар (сахароза) под влиянием ферментов превращается в глюкозу и фруктозу. Если увеличить температуру на
 при
при =3,
то скорость этой реакции _____ раз (а).
=3,
то скорость этой реакции _____ раз (а).
1) уменьшится в 3 раз
2) увеличится в 9 раз
3) уменьшится в 9 раз
4) увеличится в 27 раз
Величина
 (константа равновесия) зависит от _____
и рекомендуют ёё использовать для
характеристики смещения равновесия
биохимических процессов.
(константа равновесия) зависит от _____
и рекомендуют ёё использовать для
характеристики смещения равновесия
биохимических процессов.
1) концентрации реагирующих веществ
2) катализатора
3) давления
4) природы реагирующих веществ и температуры
Реакция окисления глюкозы в организме человека протекает по уравнению:
 .
Кинетическое уравнение скорости этой
реакции имеет вид: _____.
.
Кинетическое уравнение скорости этой
реакции имеет вид: _____.
1)
![]()
2) ![]()
3) ![]()
4) ![]()
В растениях в процессе фотосинтеза с участием природного катализатора пигмента (хлорофилла) за счет солнечной энергии образуется глюкоза по схеме:
 ,
Кинетическое уравнение скорости этой
реакции имеет вид: _____.
,
Кинетическое уравнение скорости этой
реакции имеет вид: _____.
1)
![]()
2) ![]()
3) ![]()
4)
![]()
Порядок реакции для указанной реакции:
 имеет вид: _____.
имеет вид: _____.
1) 0
2) 1
3) 2
4) 3
При повышении давления в 4 раза скорость химической реакции:
 увеличивается в _____ раз (а).
увеличивается в _____ раз (а).
1) 64
2) 124
3) 924
4) 1024
Бикарбонат натрия, применяющийся в медицине при отравлении циклическими антидепрессантами, подвергается гидролизу по реакции:
 .
Уравнение константы равновесия этой
реакции имеет вид: _____.
.
Уравнение константы равновесия этой
реакции имеет вид: _____.
1) ![]()
2) ![]()
3) ![]()
4) ![]()
Температурный оптимум действия ферментов в живом организме в градусах составляет_____
 .
.
1) 35-40
2) 65-70
3) 15-20
4) 0-10
