
- •21. Основной закон релятивистской динамики.
- •22. Закон взаимосвязи массы и энергии покоя.
- •23. Частицы с нулевой массой.
- •24. Модель идеального газа. Уравнение состояния.
- •25. Основное уравнение мкт газов.
- •26. Давление газа на стенки сосудов.
- •27. Средняя кинетическая энергия поступательного движения молекул идеального газа.
- •28. Распределение Максвелла. Виды скоростей молекул и их физический смысл.
- •29. Распределение Больцмана. Барометрическая формула.
- •30. Закон равного распределения энергии по степеням свободы. Внутренняя энергия.
- •31. Первое начало термодинамики.
- •32. Работа газа при изменении его объёма.
- •33. Теплоёмкость газа.
- •34. Применение первого начала к изопроцессам.
- •35. Адиабатический процесс. Уравнение адиабаты (Пуассона). Коэффициент Пуассона.
- •Адиабата Пуассона
- •36. Политропические процессы. Уравнение политропы.
- •37. Понятие энтропии. Свойства энтропии. Второе начало термодинамики.
- •38. Изменение энтропии при обратимых и необратимых процессах.
- •39. Третье начало термодинамики (теорема Нернста).
- •40. Принцип работы тепловой машины. Кпд.
- •41. Цикл Карно. Теорема Карно.
- •42. Реальные газы. Уравнение Ван-дер-Ваальса.
- •43. Экспериментальные изотермы.
- •44. Фазовые переходы.
- •45. Строение твёрдых тел. Классификация кристаллов.
- •46. Физические типы кристаллических решёток.
- •47. Дефекты в кристаллах.
- •48. Теплоёмкость твёрдых тел.
- •49. Диаграмма состояния. Тройная точка.
- •50. Физическая кинетика. Явления переноса. Диффузия. Закон Фика.
- •51. Теплопроводность. Внутреннее трение (вязкость).
- •52. Диффузия, теплопроводность и вязкость газов.
- •53. Закон Кулона. Напряженность электрического поля. Принцип суперпозиции.
- •54. Поток вектора. Теорема Гаусса. Расчёт электростатических полей.
- •55. Работа сил электростатического поля.
- •56. Потенциал. Градиент потенциала. Циркуляция вектора. Эквипотенциальные поверхности.
26. Давление газа на стенки сосудов.
Мы знаем, что газы, в отличие от твёрдых тел и жидкостей заполняют весь сосуд, в котором они находятся, например стальной баллон для хранения газов, камеру автомобильной шины или волейбольного мяча. При этом газ оказывает давление на стенки, дно и крышку баллона, камеры или любого другого тела, в котором он находится. Давление газа обусловлено иными причинами, чем давление твёрдого тела на опору. Известно, что молекулы газа беспорядочно движутся. При своём движении они сталкиваются друг с другом, а также со стенками сосуда, в котором находится газ. Молекул в газе много, потому и число их ударов очень велико. Хотя сила удара отдельной молекулы мала, но действие всех молекул о стенки сосуда значительно, оно и создаёт давление газа. Итак, давление газа на стенки сосуда (и на помещённое в газ тело) вызывается ударами молекул газа. При уменьшении объёма газа его давление увеличивается, а при увеличении объёма давление уменьшается при условии, что масса и температура газа остаются неизменными. Давление газа в закрытом сосуде тем больше, чем выше температура газа, при условии, что масса газа не меняется.
27. Средняя кинетическая энергия поступательного движения молекул идеального газа.
Средняя кинетическая энергия поступательного движения молекулы идеального газа

28. Распределение Максвелла. Виды скоростей молекул и их физический смысл.
Распределение Максвелла
Молекулы
газа вследствие теплового движения
испытывают многочисленные соударения
друг с другом. При каждом соударении
скорости молекул изменяются как по
величине, так и по направлению. В
результате в сосуде, содержащем большое
число молекул, устанавливается некоторое
статистическое распределение молекул
по скоростям, зависящее от абсолютной
температуры Т. При этом все направления
векторов скоростей молекул оказываются
равноправными (равновероятными), а
величины скоростей подчиняются
определенной закономерности. Распределение
молекул газа по величине скоростей
называется распределением Максвелла.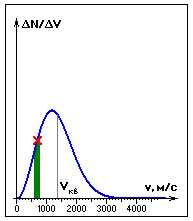
Если
одновременно измерить скорости большого
числа N молекул газа и выделить некоторый
малый интервал скоростей от v до v+![]() v,
то в выделенный интервал
v,
то в выделенный интервал![]() v
попадает некоторое число
v
попадает некоторое число![]() N
молекул. На графике удобно изображать
зависимость величины
N
молекул. На графике удобно изображать
зависимость величины от
скорости v. При достаточно большом числе
N эта зависимость изображается плавной
кривой, имеющей максимум при
от
скорости v. При достаточно большом числе
N эта зависимость изображается плавной
кривой, имеющей максимум при![]() (наиболее
вероятная скорость). Здесь m - масса
молекулы,
(наиболее
вероятная скорость). Здесь m - масса
молекулы,![]() -
постоянная Больцмана.
-
постоянная Больцмана.
Характерным
параметром распределения Максвелла
является так называемая среднеквадратичная
скорость ![]() означает
среднее значение квадрата скорости. В
молекулярной физике доказывается, что
означает
среднее значение квадрата скорости. В
молекулярной физике доказывается, что
![]()
где ![]() -
молярная масса.
-
молярная масса.
Из выражения для среднеквадратичной скорости следует, что средняя кинетическая энергия поступательного движения молекул газа есть

Распределение Максвелла является одной из важнейших статистических закономерностей молекулярной физики.
Скорости молекул подразделяются на:
1)
наиболее вероятную 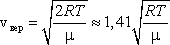 ,
,
2)
среднюю 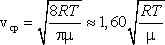 ,
,
3)
среднюю квадратичную 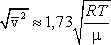
29. Распределение Больцмана. Барометрическая формула.
Барометрическая
формула.
Если
температура не зависит от высоты, то
давление газа меняется с высотой по
закону:
![]() ,
где
,
где![]() —
высота,
—
высота,![]() —
молярная газовая постоянная,
—
молярная газовая постоянная,![]() —
постоянная Больцмана,
—
постоянная Больцмана,![]() —
ускорение свободного падения вблизи
поверхности земли,
—
ускорение свободного падения вблизи
поверхности земли,![]() —
молярная масса газа,
—
молярная масса газа,![]() —
масса одной молекулы,
—
масса одной молекулы,![]() —
абсолютная температура.
—
абсолютная температура.
Поделив
барометрическую формулу на ![]() ,
с учетом уравнения состояния идеального
газа, получим распределение Больцмана
— зависимость концентрации молекул от
потенциальной энергии:
,
с учетом уравнения состояния идеального
газа, получим распределение Больцмана
— зависимость концентрации молекул от
потенциальной энергии:
![]() ,
где
,
где ![]() —
потенциальная энергия молекулы. В
однородном поле силы тяжести
—
потенциальная энергия молекулы. В
однородном поле силы тяжести ![]() .
.
Exp, как я поняла, это «экспериментальное»???????????????
