
Л.р.5 Определение отношения теплоемкостей
.doc16. ОПРЕДЕЛЕНИЕ ОТНОШЕНИЯ ТЕПЛОЕМКОСТЕЙ ВОЗДУХА МЕТОДОМ АДИАБАТИЧЕСКОГО РАСШИРЕНИЯ
Цель работы: определение коэффициента Пуассона для воздуха методом адиабатического расширения.
Оборудование: стеклянный сосуд, жидкостный манометр, барометр, термометр, насос Шинца.
Вопросы теории
Теория теплоемкости идеального газа. Связь теплоемкостей с числом степеней свободы молекул газа. Адиабатический процесс и изопроцессы. Изображение газовых процессов на диаграммах (P,V), (P, T), (V, T). Применение первого начала термодинамики к процессам в идеальном газе.
Указания к теоретической подготовке
Согласно теории теплоемкости изменение внутренней энергии идеального газа зависит от числа степеней свободы молекул i и изменения температуры T:
![]()
С другой стороны, по первому началу
термодинамики при изохорическом процессе
все подводимое количество теплоты
![]() идет на приращение внутренней энергии
U:
Qv = U
.
идет на приращение внутренней энергии
U:
Qv = U
.
Отсюда следует, что молярная теплоемкость при постоянном объеме:
![]()
Применив первое начало к изобарическому
процессу и установив связь между
теплоемкостями С
p и C v:
![]() ;
;
![]() ,
,
можно найти показатель адиабаты через число степеней свободы молекул газа:
![]() .
.
Число степеней свободы молекулы показывает, какое число координат нужно задать для однозначного определения положения молекулы в пространстве. Одноатомные свободные молекулы имеют три степени свободы, связанные с поступательным движением; жесткие двухатомные – пять степеней свободы: три поступательных и две вращательных; трехатомные - шесть: три поступательных и три вращательных. Воздух (смесь газов) состоит, в основном, из двухатомных газов, поэтому считают, что число степеней свободы воздуха равно пяти.
Описание установки и метода измерения
Установка состоит из стеклянного сосуда 1, закрытого пробкой, в которую вставлены клапан 4 и трубки для присоединения насоса и манометра.
С помощью насоса 2 в сосуде можно создать повышенное давление, измеряемое манометром 3. Через некоторое время вследствие теплообмена через стенки сосуда установится тепловое равновесие воздуха в сосуде с окружающей средой, воздух будет иметь комнатную температуру и находиться под давлением P1, превышающим атмосферное давление на величину, измеряемую манометром.
Е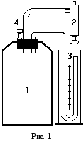 сли
быстрым, кратковременным нажатием
клапана дать воздуху из сосуда расшириться,
то давление уменьшится до атмосферного
(при этом уровни жидкости в правом и
левом коленах манометра сравняются), а
температура понизится. Через некоторое
время из-за теплообмена с окружающей
средой воздух в сосуде нагревается до
комнатной температуры, давление
повышается до P2.
сли
быстрым, кратковременным нажатием
клапана дать воздуху из сосуда расшириться,
то давление уменьшится до атмосферного
(при этом уровни жидкости в правом и
левом коленах манометра сравняются), а
температура понизится. Через некоторое
время из-за теплообмена с окружающей
средой воздух в сосуде нагревается до
комнатной температуры, давление
повышается до P2.
Показания манометра перед адиабатическим расширением h1 и после изохорического нагревания h2 связаны с давлениями газа P1 и P2, которые много меньше атмосферного P0, поэтому рабочую формулу можно получить в виде:
![]()
Задание 1. Экспериментальное определение показателя адиабаты
1. Накачать в сосуд воздух так, чтобы избыточное давление было не больше 25 см водяного столба. Дождаться установления теплового равновесия воздуха в сосуде с окружающей средой. Записать показания манометра h1 перед адиабатным расширением.
2. Произведите быстрое расширение газа кратковременным нажатием клапана. Дождитесь установления равновесия после изохорического нагревания (в течение 5-7 минут) и запишите показание манометра h2 .
3. Вычислите показатель адиабаты экс. по результатам опыта.
4. Повторите опыт 7-10 раз, для каждого опыта вычисляя экс..
5. Найдите среднее значение экс , вычислите погрешности измерений, запишите окончательный результат.
6. Вычислите значение показателя адиабаты через число степеней свободы его молекул. Сравните экс и теор.
Задание 2*. Построение диаграмм процессов
1. В координатах (P,V), (P, T), (T, V) изобразите процессы, происходящие с некоторой массой воздуха в сосуде при выполнении пунктов 1, 2 задания 1.
2. Определите давление воздуха в сосуде в конце адиабатического расширения. На сколько градусов при этом понизилась температура воздуха в сосуде?
Контрольные вопросы
1. Что называют молярной теплоемкостью вещества? Удельной теплоемкостью вещества?
Молярная теплоемкость— скалярная величина, равная количеству теплоты, необходимому для нагревания 1 моль вещества на 1 К
 где =m/М—количество
вещества.
где =m/М—количество
вещества.
Единица молярной теплоемкости — джоуль на моль-кельвин (Дж/(моль К)).
Удельная теплоемкость вещества — скалярная величина, равная количеству теплоты, необходимому для нагревания 1 кг вещества на 1 К:
![]() Единила
удельной теплоемкости — джоуль на
килограмм-кельвин (Дж/(кг
К)).
Единила
удельной теплоемкости — джоуль на
килограмм-кельвин (Дж/(кг
К)).
2. Какая связь между Сp и Сv для идеального газа? Почему молярная теплоемкость при постоянном давлении Сp больше молярной теплоемкости при постоянном объеме Сv ?
Молярная теплоёмкость для идеального газа при постоянном давлении больше молярной теплоёмкости при постоянном объеме на величину универсальной газовой постоянной и зависит только от числа степеней свободы газа.
Т.е. для каждого идеального газа молярная теплоёмкость при постоянном объёме является величиной постоянной.
Отношение молярной теплоёмкости при постоянном давлении к молярной теплоёмкости при постоянном объёме называют показателем адиабаты – γ, или коэффициентом Пуассона.
![]()
3. Что понимают под числом степеней свободы i молекул газа? Числом степеней свободы материального объекта называют число независимых координат, которые необходимо задать, чтобы однозначно определить положение этого объекта относительно рассматриваемой системы отсчета. Например, положение материальной точки в пространстве определяется тремя координатами x, y, z, следовательно, материальная точка обладает тремя степенями свободы. Две материальные точки, находящиеся на неизменном расстоянии друг от друга (например, модель двухатомной молекулы с жесткой связью между атомами), имеют пять степеней свободы – три поступательные и две вращательные. Таким образом, двухатомная молекула может совершать пять независимых движений: три поступательных движения вдоль осей X, Y, Z и два вращения относительно осей X и Y (рис. 1). Опыт показывает, что вращение относительно оси Z, на которой лежат центры обоих атомов, может быть возбуждено только при очень высоких температурах. При обычных температурах вращение около оси Z не происходит, так же как не вращается одноатомная молекула.
|
|
4. Как связаны внутренняя энергия идеального газа и молярная теплоемкость с числом степеней свободы его молекул?
Числом степеней свободы i называют наименьшее число независимых координат, с помощью которых можно однозначно определить положение тела в пространстве.
При нагревании жидких и твердых тел их объем практически не изменяется, и работа расширения оказывается равной нулю. Поэтому все количество теплоты, полученное телом, идет на изменение его внутренней энергии. В отличие от жидкостей и твердых тел, газ в процессе теплопередачи может сильно изменять свой объем и совершать работу. Поэтому теплоемкость газообразного вещества зависит от характера термодинамического процесса. Обычно рассматриваются два значения теплоемкости газов: CV – молярная теплоемкость в изохорном процессе (V = const) и Cp – молярная теплоемкость в изобарном процессе (p = const). В процессе при постоянном объеме газ работы не совершает: A = 0. Из первого закона термодинамики для 1 моля газа следует QV = CVΔT = ΔU.
5. Какие процессы происходят с воздухом в сосуде при определении методом адиабатического расширения? Дайте определение этих процессов.
Одним из
самых простых методов определения у
для газов является метод адиабатического
расширения (метод Клемана и Дезорма).
Метод заключается в следующем. Если в
некоторый сосуд, снабженный открытым
манометром для измерения давления в
этом сосуде и краном для соединения
воздуха в сосуде с атмосферой, накачать
при закрытом кране немного воздуха, то
через некоторое время температура
воздуха в сосуде станет равной
комнатной Т01,давление p1 будет
несколько выше атмосферного (первое
состояние газа).
Если
затем открыть кран и закрыть его опять
в тот момент, когда давление в сосуде
станет равным атмосферному, то произойдет
адиабатическое расширение оставшейся
части газа в сосуде. В этом случае
давление газа будет равно атмосферному
р2,
температура Т2 вследствие
адиабатического расширения. будет ниже
комнатной. Назовем это состояние газа
вторым.
С
течением времени температура воздуха
в сосуде будет повышаться и достигнет
комнатной, давление повысится до
значения р3,
объем останется неизменным (третье
состояние).
Переход
газа из первого состояния во второе
происходит адиабатически и подчиняется
уравнению Пуассона, которое в этом
случае удобно записать в форме ![]()
6. Как с помощью манометра найти давление воздуха в сосуде; как перевести это давление в Паскали?
ЛИТЕРАТУРА [2, 6, 7, 8]
