
- •Фармацевтический анализ по функциональным группам и общие титриметрические методы анализа
- •Часть I. Фармацевтический анализ по функциональным группам Введение
- •Анализ лекарственных веществ по фг Спиртовый гидроксил
- •Химические свойства
- •Реакции подлинности
- •VNaOh(контрольный опыт) - vNaOh(на определение)
- •Фенольный гидроксил
- •Карбонильная (альдегидная и кетонная) группа
Химические свойства
1. Реакция образования сложных эфиров (реакция этерификации). В реакцию вступают все спиртовые гидроксилы.
2. Окислительно-восстановительные. Спирты проявляют слабые восстановительные свойства. Окисляются только сильными окислителями (K2Cr2O7, KMnO4, HIO4, KIO4) в кислой среде. Механизм реакции окисления различен, зависит от характера гидроксила.

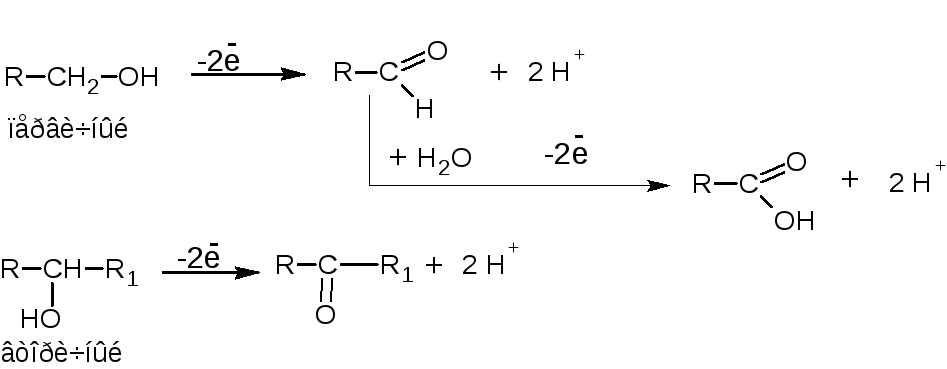
Третичные и многоатомные спирты окисляются трудно, с разрывом углеводородной цепи.
3. Кислотно-основные. Очень слабые кислотные свойства, солей с щелочами не образуют. На силу кислотных свойств влияют характер заместителя в радикале и число гидроксильных групп в соединении: с увеличением числа групп кислотные свойства возрастают. Многоатомные спирты вследствие этого способны образовывать внутрикомплексные (хелатные) соединения с солями металлов (медь, кобальт) в сильнощелочной среде. Наибольший интерес представляет реакция с меди (II) сульфатом в среде натрия гидроксида. Одноатомные спирты вступают в реакцию комплексообразования, если кроме спиртового гидроксила содержат другие электронодонорные группы, способные образовывать координационные связи с металлом.
Реакции подлинности
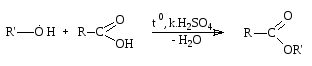 1.
Реакция
образования сложных эфиров.
Спирты
образуют с органическими кислотами или
ангидридами кислот в присутствии
водоотнимающих средств сложные эфиры.
Сложные эфиры, полученные на основе
низкомолекулярных спиртов, обладают
характерным запахом, а сложные эфиры
на основе высокомолекулярных спиртов
являются кристаллическими веществами,
имеющими четкую температуру плавления.
1.
Реакция
образования сложных эфиров.
Спирты
образуют с органическими кислотами или
ангидридами кислот в присутствии
водоотнимающих средств сложные эфиры.
Сложные эфиры, полученные на основе
низкомолекулярных спиртов, обладают
характерным запахом, а сложные эфиры
на основе высокомолекулярных спиртов
являются кристаллическими веществами,
имеющими четкую температуру плавления.
1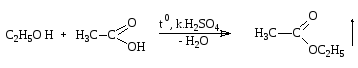 .1.
.1.
Методика. К I мл этанола прибавляют 5 капель ледяной уксусной кис-
лоты, 0,5 мл конц. серной кислоты и осторожно нагревают; обнаруживается характерный запах этилацетата (свежих яблок).
1.2. Реакция ацилирования (ацетилирования).

![]()
2. Реакция окисления спиртов до альдегидов. Образующиеся альдегиды обнаруживают по запаху. В качестве окислителей используют калия гексациано -(III)-феррат, калия перманганат, калия дихромат и др.

2.1.
Методика. Около 0,01 г эфедрина гидрохлорида растворяют в 0,5 мл воды,
прибавляют кристаллик калия гексацано-(III)-феррата и нагревают до кипения, появляется запах бензальдегида.
2.2. В случае кальция лактата одновременно протекает реакция декарбоксилирования.
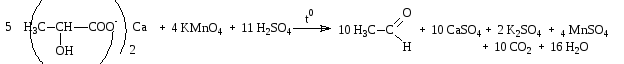
Методика. Около 0,05 г кальция лактата растворяют в 1 мл воды, подкисляют разведённой серной кислотой, прибавляют раствор калия перманганата до красно-фиолетового окрашивания и нагревают; обнаруживается запах ацетальдегида.
3. Реакция образования комплексных соединений.
3![]() .1.Многоатомные
спирты.
.1.Многоатомные
спирты.
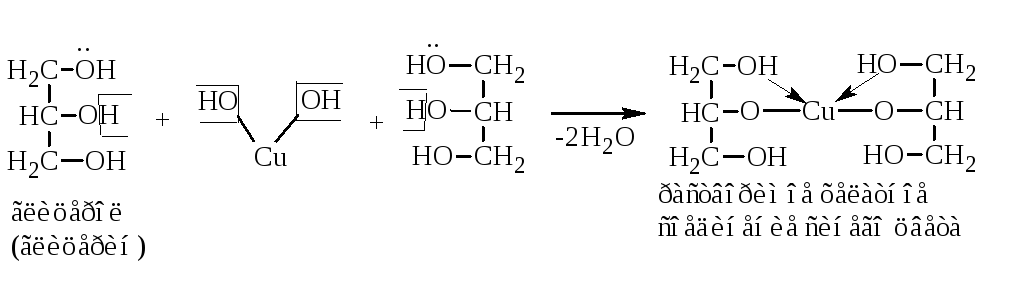
3.1.1.
Методика. К 0,5 мл глицерола (глицерина) прибавляют по 5 капель растворов натрия гидроксида и меди (II) сульфата, появляется интенсивное синее окрашивание.
3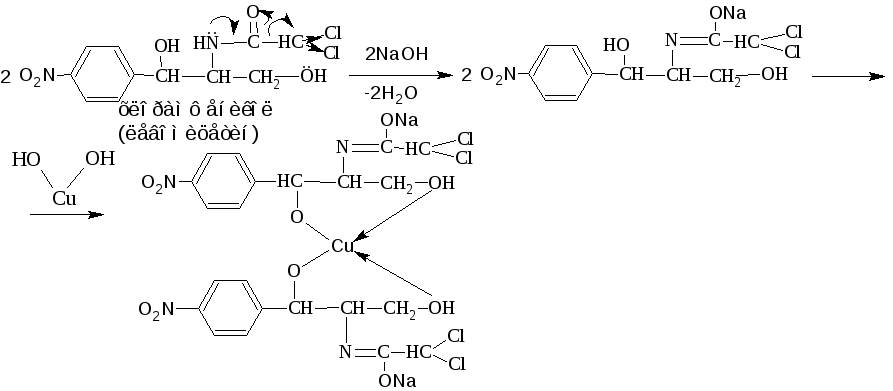 .1.2.
.1.2.
Методика. К нескольким крупинкам левомицетина прибавляют 3 капли раствора меди (II) сульфата и 0,5 мл раствора натрия гидроксида, через 1 минуту взбалтывают с 0,5 мл н-бутанола. Слой н-бутанола окрашивается в сине-фиолетовый цвет.
3.2. Одноатомные спирты.
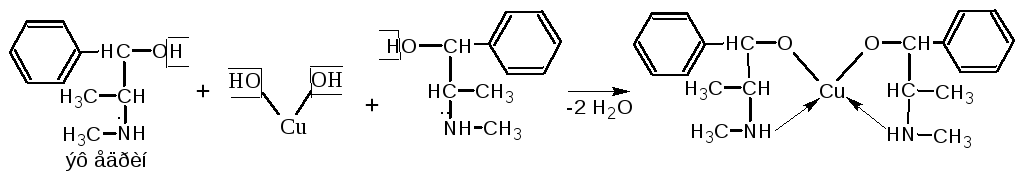
Методика. 0,01 г эфедрина гидрохлорида растворяют в 1 мл воды, прибавляют 2 капли раствора меди (II) сульфата, 10-15 капель раствора натрия гидроксида и 1 мл эфира; при взбалтывании слой органического растворителя окрашивается в красно-фиолетовый цвет; водный слой – в синий.
Количественное определение
1 .Метод
ацетилирования (для высокомолекулярных
спиртов).
Основан на свойстве спиртов вступать
в реакцию ацетилирования с уксусным
ангидридом с образованием нерастворимых
сложных эфиров и выделением эквивалентного
количества уксусной кислоты. Выделившуюся
уксусную кислоту оттитровывают раствором
натрия гидроксида (индикатор -
фенолфталеин).
.Метод
ацетилирования (для высокомолекулярных
спиртов).
Основан на свойстве спиртов вступать
в реакцию ацетилирования с уксусным
ангидридом с образованием нерастворимых
сложных эфиров и выделением эквивалентного
количества уксусной кислоты. Выделившуюся
уксусную кислоту оттитровывают раствором
натрия гидроксида (индикатор -
фенолфталеин).
![]()
Избыток уксусного ангидрида при разбавлении водой подвергают гидролизу с образованием уксусной кислоты, которая тоже будет титроваться щёлочью, поэтому параллельно проводят контрольный опыт.

При расчёте из избытка щёлочи, израсходованного на контрольный опыт, вычитают объём щёлочи, израсходованный на определение:
