
Repetitor_po_Khimii
.pdf•Химические реакции, в результате которых теплота выделяется, называются экзотермическими.
•Химические реакции, в результате которых теплота поглощается, называются эндотермическими.
Количество теплоты, которое выделяется или поглоща-
ется в результате химической реакции, называется тепловым эффектом реакции.
Раздел химии, в котором изучаются тепловые эффекты, называется термохимией.
В термохимии тепловой эффект реакции обозначается символом Q (кю) и выражается в килоджоулях (кДж) или килокалориях (ккал):
1 ккал = 4,187 кДж.
Для экзотермических реакций Q > 0, для эндотермических реакций Q < 0.
В курсе физики вы познакомились с законом сохранения энергии, утверждающим, что энергия не возникает из ничего и не исчезает бесследно. Это всеобщий закон природы, он применим ко всем явлениям, в том числе и химическим.
Выделение теплоты в ходе реакции свидетельствует о том, что еще до реакции вещества обладали определенным запа-
сом энергии. Такая форма энергии, которая в скрытом виде содержится в веществе, называется внутренней энергией ве-
щества (U).
Внутренняя энергия складывается из кинетической и потенциальной энергий. Кинетическая энергия — это энергия движения частиц. Потенциальная энергия опре-
деляется силами притяжения и отталкивания между частицами.
Каждое вещество обладает определенным запасом внутренней энергии. Превращения веществ приводят к измене-
нию их внутренней энергии и сопровождаются выделением или поглощением теплоты.
В каких же случаях теплота выделяется, а в каких поглощается в ходе реакций?
При протекании любой химической реакции происходит разрыв химических связей в молекулах исходных веществ и образование новых химических связей в молекулах продуктов реакции. Разрыв химических связей сопровождается поглощением определенного количества энергии. Образование
160

химических связей — ее выделением. В зависимости от соотношения этих количеств в результате реакции энергия выделяется или поглощается. В ходе реакции:
А2 + В2 = 2АВ
разрываются химические связи в молекулах А2 и B2 и образуются новые связи в молекулах АВ:
(А – А) + (В – В) = 2(А – В),
|
|
|
ЕA |
ЕB |
2ЕАВ |
где ЕA — энергия, которая поглощается при разрыве связи в молекуле А2; ЕB — энергия, которая поглощается при разрыве связи в молекуле В2; ЕАВ — энергия, которая выделяется при образовании связи в молекуле АВ.
Если 2 · ЕАВ > (ЕА + ЕB), то в результате реакции энергия выделяется. Запас энергии исходных веществ больше, чем запас энергии продуктов реакции. Избыточное количество внутренней энергии высвобождается в ходе реакции и выделяется в виде теплоты (рис. 18, а).
Если 2 · ЕАВ < (ЕА + ЕB), то в результате реакции энергия поглощается. Это свидетельствует о том, что запас энергии исходных веществ меньше, чем запас энергии продуктов реакции. Для образования новых веществ необходим приток энергии — энергия поглощается в виде теплоты (рис. 18, б).
Рис. 18. Изменение внутренней энергии веществ в ходе: а) экзотермической реакции; б) эндотермической реакции
161
Таким образом, тепловой эффект реакции можно описать через изменение запаса энергии исходных веществ и продуктов реакции.
Согласно закону сохранения энергии, если к какой-ли- бо системе подводят теплоту (Q), то она расходуется на изменение внутренней энергии ( U) и на совершение работы (А):
Q = U + A, |
(4.2.1) |
где U = U2 – Ul, т. е. разность внутренних энергий конечного и начального состояния системы. Если речь идет о системе, в которой протекает химическая реакция, то U — это разность внутренних энергий продуктов реакции и исходных веществ.
Для химических реакций под работой против внешних сил в основном подразумевается работа против внешнего давления (например, работа расширения).
Химические реакции обычно протекают при постоянном давлении (р) (в открытом сосуде). При р = const работа равна произведению давления на изменение объема в си-
стеме ( V): |
|
A = р V = р(V2 – V1), |
(4.2.2) |
где V2 и V1 — объемы продуктов реакции и исходных веществ соответственно.
Таким образом, тепловой эффект химической реакции, протекающей при постоянном давлении, выражается следу-
ющим образом:
Q = (U2 – U1) + p(V2 – V1) = |
|
= (U2 + pV2) – (U1 + pV1). |
(4.2.3) |
Если обозначить U + pV через Н, то это выражение примет вид
Q = Н2 – Н1. |
(4.2.4) |
Величина Н называется энтальпией. |
|
Энтальпия, как и внутренняя энергия, характеризует
энергетическое состояние вещества (теплосодержание). Теплосодержание включает внутреннюю энергию вещества и энергию, затраченную на преодоление внешнего давления.
Таким образом, изменение энтальпии продуктов реакции по сравнению с энтальпией исходных веществ равно подведенному или выделившемуся количеству теплоты.
162
Для химических реакций изменение энтальпии равно разности между суммой энтальпий продуктов реакции и суммой энтальпий исходных веществ:
Нр-ции = ΣНпрод – ΣНисх. |
(4.2.5) |
Так, для реакции А2 + В2 = 2АВ
Нр-ции = 2НAB – (HA2 + HB2),
где НАВ — энтальпия 1 моль вещества АВ, НA2 — энтальпия 1 моль вещества А2, НB2 — энтальпия 1 моль вещества В2.
Понятно, что для экзотермических реакций Нр-ции < 0, так как сумма энтальпий продуктов реакции меньше суммы энтальпий исходных веществ, а для эндотермических реак-
ций Нр-ции > 0.
Принимая во внимание, что в термохимии тепловой эффект реакции Q считается положительным для экзотермических реакций и отрицательным — для эндотермических, уравнение 4.2.4 следует записать так:
–Q = Н или H = –Q. |
(4.2.6) |
Следовательно, для экзотермических реакций Q > 0,Н < 0, для эндотермических реакций Q < 0, Н > 0.
Н, как и Q, называется тепловым эффектом реакции и измеряется в тех же единицах (кДж или ккал).
Тепловые эффекты реакций (ДН) зависят от условий протекания реакций. Обычно тепловые эффекты измеряются при давлении 1 атм, или 101 325 Па (паскаль), и температуре 25 °С, или 298 К. Эти условия называются стандартными. Тепловые эффекты, измеренные при стандартных условиях, называют стандартными тепловыми эффектами и обозначают символом Н°.
Уравнения химических реакций, в которых записывается величина теплового эффекта, называются термохимически-
ми. Величина теплового эффекта (Q) указывается в правой части уравнения со знаком плюс в случае экзотермической реакции и со знаком минус в случае эндотермической реакции. В термохимических уравнениях можно указывать и изменение энтальпии. Величина Н записывается после уравнения реакции и имеет знак, противоположный знаку Q. В термохимических уравнениях надо указывать агрегатное состояние исходных веществ и продуктов реакции: ж — жид-
163

кое, г — газообразное, тв — твердое. Это объясняется тем, что тепловой эффект реакции зависит от агрегатного состоя-
ния реагирующих веществ.
В термохимических уравнениях тепловой эффект реакции относится к мольным количествам исходных веществ и продуктов реакции.
Коэффициенты перед формулами веществ в термохимических уравнениях показывают число молей соответствующих веществ. Часто расчет теплового эффекта реакции ведется на один моль продукта реакции, поэтому в термохимических уравнениях можно применять дробные коэффициенты.
Типовая задача № 1.
При взаимодействии одного моля азота (N2) с тремя молями водорода (Н2) образуется два моля аммиака (NH3) и выделяется 92 кДж теплоты. Составьте термохимическое уравнение этой реакции (все вещества, участвующие в реакции, — газообразные).
Решение. Термохимическое уравнение образования аммиака записывается так:
N2(г) + 3Н2(г) = 2NH3(г) + 92 кДж
В этом уравнении записана величина теплового эффекта Q. Так как Q = – Н, то для этой же реакции термохимическое уравнение можно записать и в другом виде:
N2(г) + 3Н2(г) = 2NH3(г); Н° = –92 кДж
Типовая задача № 2.
В результате реакции, протекающей по уравнению N2(г) + O2(г) = 2NO(г),
поглощается 180 кДж теплоты. Запишите термохимическое уравнение этой реакции. Как запишется термохимическое уравнение образования 1 моля NO?
Решение . Термохимическое уравнение эндотермической реакции образования оксида азота (II) из азота и кислорода
N2(г) + O2(г) = 2NO(г) – 180 кДж
Для этой же реакции термохимическое уравнение можно записать и в другом виде:
N2(г) + O2(г) = 2NO(г); Н° = +180 кДж
164

Данное термохимическое уравнение показывает, что при взаимодействии 1 моля азота и 1 моля кислорода образуется 2 моля оксида азота (II) и поглощается 180 кДж теплоты. Термохимическое уравнение реакции образования 1 моля оксида азота (II) из азота и кислорода записывается так:
1 |
1 |
Н° = +90 кДж |
—N2(г) + —O2(г) = NO(г); |
||
2 |
2 |
|
Если при образовании какого-либо вещества выделяется (или поглощается) определенное количество теплоты, то при разложении этого вещества такое же количество теплоты поглощается (или выделяется).
Из этого положения следует, что чем больше теплоты выделяется при образовании вещества, тем больше энергии надо затратить на его разложение. Поэтому вещества, при образовании которых выделяется большое количество теплоты, являются очень устойчивыми и трудно разлагаются.
Типовая задача № 3.
Определите тепловой эффект реакции разложения 1 моля СаСО3, если при образовании 10 г СаСО3 по реакции СаО + СО2 = СаСО3 выделилось 16 кДж теплоты.
Решение. Найдем количество теплоты, которое выделяется при образовании 1 моля СаСО3 (М(СаСО3) = 100 г/моль):
при образовании 10 г СаСО3 выделилось 16 кДж теплоты; при образовании 100 г СаСО3 выделилось х кДж теплоты.
16 кДж · 100 г х = —————————= 160 кДж.
10 г
Термохимическое уравнение реакции образования 1 моля СаСО3 запишется так:
СаО + СО2 = СаСО3 + 160 кДж
Тогда термохимическое уравнение реакции разложения 1 моля CaCO3 на исходные вещества имеет вид:
СаСО3 = СаО + СО2 – 160 кДж Ответ: В результате разложения 1 моля СаСО3 поглощается 160 кДж теплоты.
По термохимическим уравнениям можно проводить различные расчеты.
165

Типовая задача № 4.
По термохимическому уравнению
1 |
3 |
Н° = –46 кДж |
—N2(г) + —H2(г) NH3(г); |
||
2 |
2 |
|
рассчитайте, сколько теплоты выделяется при образовании 2 л аммиака (н. у.).
Решение . По данному термохимическому уравнению составляем пропорцию:
при образовании 22,4 л NH3 выделяется 46 кДж теплоты, при образовании 2 л NH3 выделяется х кДж теплоты. Отсюда
46 кДж · 2 л х = ————————= 4,1 кДж.
22,4 л
Ответ: При образовании 2 л NH3 выделяется 4,1 кДж теплоты.
Основным законом термохимии является закон, установленный русским ученым Г. И. Гессом (1840 г.) и представляющий собой частный случай закона сохранения энергии:
• Тепловой эффект реакции зависит только от начального и конечного состояния веществ и не зависит от промежуточных стадий процесса.
Например, углекислый газ можно получать непосредственно из простых веществ. Термохимическое уравнение
этой реакции: |
|
(г); Н° = –393,5 кДж |
С(графит) + О |
(г) = СО |
|
2 |
2 |
1 |
Другой способ получения СО2 из тех же простых веществ состоит в первоначальном образовании оксида углерода (II) и последующем его окислении до СО2:
|
1 |
|
(г) = СО(г); Н° = –110,5 кДж |
|
С(графит) + —О |
||||
|
2 |
2 |
|
2 |
1 |
|
(г) = СО |
(г); Н° = –383,0 кДж |
|
СО(г) + —О |
||||
2 |
2 |
|
2 |
3 |
Как видно из приведенных термохимических уравнений,
Н° = Н° + Н° = –393,5 кДж |
||
1 |
2 |
3 |
166
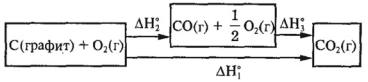
Таким образом, тепловой эффект не зависит от пути превращения исходных веществ в продукты реакции:
Тепловые эффекты различных реакций можно рассчитывать, используя два важных следствия из закона Гесса.
Первое следствие из закона Гесса
Тепловой эффект любой химической реакции можно рассчитать по теплотам образования участвующих в ней веществ.
• Теплота (энтальпия) образования вещества Н°обр —
это тепловой эффект реакции образования 1 моля вещества из простых веществ, устойчивых ири стандартных условиях.
Например, тепловой эффект реакции
Н |
1 |
|
(г) = H |
О(ж); Н° = –286 кДж |
(г) + —О |
||||
2 |
2 |
2 |
2 |
|
является теплотой образования (или стандартной энтальпией образования) жидкой воды.
Теплоты образования различных веществ приводятся в справочниках. Для некоторых веществ теплоты образования даны в табл. 21.
Таблица 21
Теплоты образования некоторых сложных веществ при стандартных условиях
Вещество |
Н°обр, |
Вещество |
Н°обр, |
Вещество |
Н°обр, |
|
кДж |
|
кДж |
|
кДж |
Аl2O3(тв) |
–1670 |
HCl (г) |
–92,3 |
NO (г) |
90,4 |
СО (г) |
–110,5 |
Н2O (г) |
–242 |
NaCl (тв) |
–411 |
СO2(г) |
–393,5 |
Н2O (ж) |
–286 |
SO2(г) |
–297 |
СН4(г) |
–74,5 |
Н2O2 (ж) |
–188 |
SO3 (г) |
–395 |
C2H5OH (ж) |
–277,7 |
H2S (г) |
–20,2 |
SiO2 (тв) |
–880 |
СаО (тв) |
–635,5 |
KNO3 (тв) |
–492,7 |
CS2 |
88 |
Са(ОН)2 (тв) |
–986,2 |
NH3(г) |
46 |
|
|
167

Теплоты образования простых веществ, устойчивых при стандартных условиях, приняты равными нулю.
• Согласно первому следствию из закона Гесса, тепловой
эффект химической реакции равен сумме теплот образования продуктов реакции за вычетом суммы теплот образования исходных веществ.
Так, для реакции аА + bВ = сС + dD тепловой эффект реакции Н° равен:
Н° = (с Н°обр.C + d Н°обр.D) – (а Н°обр.A + b Н°обр.B).
Типовая задача № 5.
Рассчитайте тепловой эффект реакции:
4NH3 (г) + 3O2 (г) = 2N2 (г) + 6Н2О (ж)
Решение. На основании 1-го следствия из закона Гесса записываем, чему равен тепловой эффект этой реакции:
Н° = (2 Н°обр.N2 + 6 Н°обр.H2O) – (4 Н°обр.NH3 + 3 Н°обр.O2)
По табл. 21 находим теплоты образования NH3 (г) и Н2О (ж):
Н°обр.NH3 = –46 кДж/моль, Н°обр.H2O = –286 кДж/моль Теплоты образования простых веществ О2 и N2 равны нулю:
Н°обр.O2 = 0, Н°обр.N2 = 0.
Подставляем эти значения в записанное уравнение:
Н° = 6(–286) – 4(–46) = –1532 кДж.
Следовательно, термохимическое уравнение данной реакции
4NH3(г) + 3О2(г) = 2N2(г) + 6Н2О (ж); Н° = –1532 кДж
Второе следствие из закона Гесса
Тепловые эффекты многих химических реакций можно рассчитать также по теплотам сгорания участвующих в них
веществ.
• Теплотой (энтальпией) сгорания Н°сгор вещества, со-
держащего С, Н, N, О, называется тепловой эффект реакции сгорания 1 моля этого вещества в достаточном количестве кислорода с образованием СО2, Н2О(ж) и N2 (продукты
окисления других элементов специально указываются в каждом случае).
168

Например, если тепловой эффект реакции, рассмотренной в типовой задаче № 5, разделить на 4, то получится теп-
лота сгорания аммиака: |
|
|
H° |
(NH |
) = –383 кДж/моль. |
cгop |
3 |
|
Теплоты сгорания негорючих веществ (Н2О, СО2 и др.) равны нулю.
• Согласно второму следствию из закона Гесса, тепловой
эффект химической реакции равен сумме теплот сгорания исходных веществ за вычетом суммы теплот сгорания продуктов реакции.
Для реакции аА + bВ = сС + dD тепловой эффект Н° равен:
Н° = ( H°cгop. А + b H°cгop. B) – (с H°cгop. C + d H°cгop. D)
Типовая задача № 6.
Рассчитайте тепловой эффект реакции
С2Н4(г) + Н2(г) = С2Н6(г), исходя из следующих термохимических уравнений:
С2Н4(г) + 3О2(г) = 2СO2(г) + 2Н2O(ж); Н° = –337 ккал
7
С2H6(г) + — О2(г) = 2СО2(г) + 3Н2О(ж); Н° = –373 ккал 2
Решение. Тепловые эффекты приведенных реакций являются теплотами сгорания С2Н4 и С2Н6 соответственно. Теплотой сгорания водорода является теплота образования воды (см. табл. 21):
1 Н2(г) + — О2(г) = Н2О(ж); Н° = –286 кДж или —68,3 ккал
2
По второму следствию из закона Гесса тепловой эффект данной реак-
ции Н° |
равен: |
|
|
|
|
x |
Н° |
= ( Н° |
+ Н° |
) – Н° |
= |
|
|||||
|
x |
сгор. C2H4 |
сгор. H2 |
сгор. C2H6 |
|
= –337 – 68,3 – (–373) = –32,3 ккал
Термохимическое уравнение реакции:
С2Н4(г) + Н2(г) = С2Н6(г); Н° = –32,3 ккал
Вопросы для контроля
1.Какие реакции называются: а) экзотермическими; б) эндотермическими?
169
