
Repetitor_po_Khimii
.pdf
Исключения: |
Номер |
|
Элемент |
Высшая |
|
группы |
|
|
валентность |
|
|
|
Cu |
II |
|
I |
|
Ag |
III |
|
|
|
Au |
III |
|
VI |
|
O |
II |
|
|
|
|
|
|
VII |
|
F |
I |
|
В VIII группе только Ru и Os имеют |
|||
|
|
высшую валентность VIII |
||
|
|
|
|
|
Каждая группа состоит из двух подгрупп: главной и побоч-
ной. Главная подгруппа содержит элементы малых и больших периодов. Побочная подгруппа содержит элементы только больших периодов.
Например, рассмотрим 1-ю группу периодической системы:
В главных подгруппах сверху вниз металлические свойства усиливаются, а неметаллические свойства ослабляются. Все элементы побочных подгрупп являются металлами.
80
Вопросы для контроля
1.Кто и когда открыл периодический закон?
2.В каком порядке Д. И. Менделеев расположил все известные элементы?
3.Какое изменение свойств элементов наблюдается при увеличении их атомной массы?
4.Как Д. И. Менделеев сформулировал периодический закон?
5.Что является графическим выражением периодического закона?
6.Сколько периодов и сколько групп в периодической системе?
7.Что такое период? Какие периоды являются малыми и какие большими?
8.Сколько элементов в каждом периоде?
9.Как изменяются свойства элементов в периодах слева направо?
10.Что такое группа? Из каких подгрупп состоит каждая группа периодической системы?
11.Как изменяются свойства элементов в главных подгруппах?
Упражнения для самостоятельной работы
1.В каком периоде, в какой группе и в какой подгруппе находятся элементы с порядковыми номерами 14, 29, 52, 56, 78?
2.Напишите символ, название и порядковый номер элемента, который находится: а) в третьем периоде и в главной подгруппе шестой группы; б) в пятом периоде и в побочной подгруппе второй группы; в) в шестом периоде и в главной подгруппе четвертой группы; г) в четвертом периоде и в побочной подгруппе седьмой группы.
3.Напишите символы, названия и порядковые номера всех элементов, которые находятся: а) в главной подгруппе четвертой группы; б) в побочной подгруппе второй группы; в) в третьем периоде.
4.Какие элементы главной подгруппы пятой группы являются элементами малых периодов? Напишите их символы, названия, порядковые номера.
5.Какое общее свойство имеют элементы главной и побочной подгрупп одной группы?
6.Напишите формулы оксидов всех элементов четвертой группы, в которых эти элементы имеют высшую валентность.
7.Напишите формулы оксидов элементов с порядковыми номерами 16, 21, 25, 48, 76, в которых эти элементы имеют высшую валентность.
8.Какой элемент имеет более выраженные металлические свойства: Са (Z = 20) или Ва (Z = 56)? Почему?
81
9.Какой элемент имеет более выраженные неметаллические свойства: Р (Z = 15) или Cl (Z = 17)? Почему?
10.Какой элемент четвертого периода является самым активным неметаллом? Почему?
11.Какой элемент пятого периода является самым активным металлом? Почему?
12.Какой элемент главной подгруппы шестой группы является самым активным неметаллом? Почему?
13.В каких группах периодической системы все элементы являются металлами?
Тест № 2 по теме: «Периодическая система
химических элементов»
(Число правильных ответов — 6)
Вариант I
1. |
Сколько периодов в периодической системе? |
|
||||||
|
. |
2 |
. |
3 |
. |
7 |
. |
8 |
|
А |
Б |
В |
Г |
||||
2. |
Сколько рядов в периодической системе? |
. |
|
|||||
|
. |
7 |
. |
8 |
. |
9 |
10 |
|
|
А |
Б |
В |
Г |
||||
3. |
Сколько элементов в шестом периоде? |
. |
|
|||||
|
. |
32 |
. |
18 |
. |
8 |
2 |
|
|
А |
Б |
В |
Г |
||||
4. |
Сколько элементов в главной подгруппе пятой группы? |
|||||||
|
. |
3 |
. |
4 |
. |
5 |
. |
8 |
|
А |
Б |
В |
Г |
||||
5.Чему равен порядковый номер элемента, который находится в четвертом периоде, в главной подгруппе второй группы?
. |
. |
. |
. |
А 10 |
Б 20 |
В 30 |
Г 40 |
6.Чему равна высшая валентность элемента хрома (порядковый номер 24)?
. |
. |
. |
. |
А VI |
Б IV |
В III |
Г II |
Вариант II
1. Сколько групп в периодической системе?
. |
7 |
. |
. |
. |
А |
Б 8 |
В 9 |
Г 10 |
82
2. Какой из следующих элементов находится в четвертой
группе? |
. |
. |
. |
. |
|||
А Fe |
Б C |
В Cr |
Г K |
3. Сколько химических элементов в пятом периоде?
. |
. |
. |
. |
А 8 |
Б 9 |
В 18 |
Г 32 |
4.Сколько химических элементов в главной подгруппе четвертой группы?
. |
. |
. |
. |
А 4 |
Б 5 |
В 6 |
Г 7 |
5.Чему равен порядковый номер элемента, который находится
впятом периоде, в побочной подгруппе VI группы?
. |
. |
. |
. |
А 42 |
Б 52 |
В 73 |
Г 83 |
6.Чему равна высшая валентность элемента висмута (порядковый номер 83)?
. |
. |
. |
. |
А VIII |
Б VII |
В VI |
Г V |
§ 3.2. Строение атома: физический смысл порядкового номера элемента, массовые числа атомов, изотопы
В 1913 г. английский физик Г. Мозли установил, что поло-
жительный заряд ядра атома (в условных единицах) равен порядковому номеру элемента в периодической системе Д. И. Менделеева.
Каждый протон имеет заряд +1 (см. § 1.2), поэтому заряд ядра равен числу протонов. Атом является электронейтральной частицей, поэтому число протонов равно числу электронов. Следовательно:
Порядковый |
Заряд |
Число |
Число |
номер |
= ядра = протонов = электронов |
||
элемента |
атома |
в ядре |
в атоме |
Например, элемент железо Fe имеет порядковый номер 26. Следовательно, заряд ядра атома железа равен +26, т. е. ядро солержит 26 протонов, а вокруг ядра движутся 26 электронов.
Элементарные частицы имеют следующие абсолютные и относительные массы:
83
Частица |
Обозначение |
Абсолютная |
Относительная |
|
|
|
масса, кг |
масса, а.е.м. |
|
|
|
|
|
|
Электрон |
e# |
9,11 · |
10-31 |
≈1/1840 |
Протон |
11p |
1,6726 |
· 10-27 |
1,007 ≈ 1 |
Нейтрон |
01n |
1,6750 |
· 10-27 |
1,009 ≈ 1 |
Данные этой таблицы показывают, что масса протона, как и масса нейтрона, приблизительно в 1840 раз больше массы электрона. Протоны и нейтроны находятся в ядре, поэтому масса атома почти равна массе ядра. Масса ядра, как и масса
атома, определяется суммой числа протонов и числа нейтронов. Эта сумма называется массовым числом атома.
Массовое |
Число |
Число |
число |
= протонов + нейтронов |
|
атома (A) |
(Z) |
атома (N) |
|
A = Z + N |
|
• Атомы одного элемента, которые имеют разные массовые числа, называются изотопами.
Атомы изотопов одного элемента имеют одинаковое число протонов (Z) и отличаются друг от друга числом нейтронов (N).
Изотопы обозначаются символами соответствующих элементов, слева от которых вверху записывают массовое число изотопа, а внизу — порядковый номер (заряд ядра атома) элемента. Например:
126 С — изотоп углерода с массовым числом 12; 188 O — изотоп кислорода с массовым числом 18.
Иногда в символах изотопов записывают только массовые
числа (12С, 18О, 27Аl и т. д.).
Элемент водород имеет три изотопа, у каждого из которых есть свое название:
11Н |
12Н(D) |
13Н(T) |
протий |
дейтерий |
тритий |
1 протон, |
1 протон, |
1 протон, |
нейтронов нет |
1 нейтрон |
2 нейтрона |
В названиях изотопов других элементов указываются их массовые числа. Например: 126 С — углерод-12; 3517Cl — хлор-35 и т. д.
84
В природе различные элементы имеют разное число изо-
топов с разным процентным содержанием каждого из них.
Относительная атомная масса элемента Аr, которая приводится в периодической системе, — это средняя величина массовых чисел природных изотопов этого элемента с учетом процентного содержания каждого изотопа.
Например, в природе все атомы хлора представляют собой два вида изотопов: 35Сl (процентное содержание 75,5 %) и 37Сl (24,5 %). Относительная атомная масса хлора
35 · 75,5 + 37 · 24,5
Аr(Сl) = ———————————= 35,453 ≈ 35,5. 100
Химические свойства всех изотопов одного элемента одинаковы. Следовательно, химические свойства элемента зависят не от атомной массы, а от заряда ядра.
Поэтому современная формулировка периодического закона читается так:
• Свойства элементов и их соединений находятся в периодической зависимости от заряда ядра атома, или порядкового номера элемента.
Формулировка периодического закона, данная Д. И. Менделеевым, и современная формулировка не противоречат друг другу, потому что для большинства элементов при увеличении заряда ядра относительная атомная масса тоже увеличивается. Существуют лишь немногие исключения из этого правила. Например, элемент № 18 аргон Аr имеет большую атомную массу, чем элемент № 19 калий К.
Вопросы для контроля
1.Чему равен положительный заряд ядра атома?
2.Почему заряд ядра атома равен числу протонов?
3.Почему число протонов в ядре равно числу электронов в атоме?
4.Чему равны относительные массы: а) электрона; б) протона; в) нейтрона?
5.Во сколько раз масса протона больше массы электрона?
6.Почему масса атома почти равна массе ядра?
7.Что называется массовым числом атома?
8.Что такое изотопы?
9.Чем отличаются атомы изотопов одного элемента?
85
10.Как называются изотопы водорода? Каков состав ядер этих изотопов?
11.Какова современная формулировка периодического закона?
12.Почему формулировка Д. И. Менделеева и современная формулировка периодического закона не противоречат друг другу?
Задания для самостоятельной работы
1.Чему равен заряд ядра и число электронов в атомах следующих элементов: углерод С, сера S, медь Cu, барий Ва, серебро Ag?
2.Назовите элемент, в ядре атома которого содержится 11 протонов.
3.Назовите элемент, в атоме которого содержится 26 электронов.
4.Чему равно число нейтронов в атомах следующих изотопов: 15N,
119Sn, 235U?
5.Напишите символы изотопов олова, атомы которых содержат 66, 68, 69, 71, 72 нейтрона.
6.Определите молекулярную массу воды, молекулы которой содержат тяжелый изотоп водорода — дейтерий.
7.Элемент медь существует в виде двух изотопов: 63Cu и 65Cu. Содержание в природе первого изотопа равно 73 %, второго — 27 %. Вычислите относительную атомную массу меди.
8.Чему равен порядковый номер элемента, массовое число одного из изотопов которого равно 31, а число нейтронов равно 16?
9.Сколько электронов и протонов входит в состав атома элемента, который находится: а) в 5-м периоде и в побочной подгруппе VI группы; б) в 4-м периоде и в главной подгруппе III группы?
§ 3.3. Строение электронной оболочки атома. Квантовые числа. Принцип Паули
Атом состоит из ядра и электронной оболочки.
Электронная оболочка атома — это совокупность всех электронов в данном атоме.
Химические свойства элементов определяются строением электронных оболочек их атомов.
В 20-х годах XX в. ученые установили, что электрон имеет двойственную природу: он является одновременно частицей и волной (имеет свойства частицы и свойства волны).
Представление о двойственной природе электрона привело к созданию квантово-механической теории строения
атома.
86

Согласно этой теории, электрон (как и другие микрочастицы) не имеет определенной траектории движения. Можно
говорить только о вероятности нахождения электрона в разных частях атомного пространства.
• Часть атомного пространства, в которой вероятность нахождения данного электрона наибольшая (равна ≈ 90 %), называется атомной орбиталью.
Каждый электрон в атоме занимает определенную орбиталь и образует электронное облако, которое является сово-
купностью различных положений быстро движущегося электрона.
Атомная орбиталь и облако электрона, который занимает эту орбиталь, имеют одинаковый размер, одинаковую форму и одинаковое направление в пространстве.
Для характеристики орбиталей и электронов используются квантовые числа.
Энергия и размер орбитали и электронного облака характеризуются главным квантовым числом п.
Главное квантовое число принимает значения целых чисел от 1 до ∞ (бесконечности):
n = 1, 2, 3, 4, 5, 6, 7 … ∞
Орбитали, которые имеют одинаковое значение n, близки между собой по энергии и по размеру.
• Совокупность орбиталей, которые имеют одинаковое значение главного квантового числа, — это энергетический уровень.
Энергетические уровни обозначаются большими буквами латинского алфавита.
Значение n: |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
Обозначение |
|
|
|
|
|
|
|
|
уровня: |
К |
L |
М |
N |
О |
P |
Q |
|
|
|
|
|
|
|
|
|
|
Энергия и размер орбиталей увеличиваются
• Совокупность электронов, которые находятся на одном энергетическом уровне, — это электронный слой.
87
На одном энергетическом уровне могут находиться орбитали (электронные облака), которые имеют различные геоме-
трические формы.
Форма орбиталей и облаков характеризуется побочным (орбитальным) квантовым числом l.
Для орбиталей данного энергетического уровня побочное (орбитальное) квантовое число l принимает значения целых чисел от 0 до n–1 (табл. 10).
|
|
Таблица 10 |
Связь между главными и побочными квантовыми числами |
||
|
|
|
Уровень |
Главное квантовое |
Значение побочного |
|
число n |
квантового числа l |
К |
1 |
0 |
L |
2 |
0, 1 |
М |
3 |
0, 1, 2 |
N |
4 |
0, 1, 2, 3 |
|
|
|
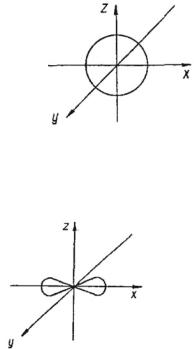
Орбитали, для которых l = 0, имеют
форму шара (сферы) и называются s-ор- биталями (условно
изображаются в виде окружности):
s-Орбитали, как видно из табл. 10, имеются на всех энергетических уровнях.
На К-уровне (на первом энергетическом уровне) имеется только s-орбиталь.
Орбитали, для которых l = 1, имеют форму гантели (объемной восьмерки) и называются р-орбиталями:
p-орбиталъ (l = 1)
88
р-Орбитали имеются на всех энергетических уровнях, кроме первого (К) уровня.
Орбитали с бо@льшими значениями l имеют более сложную форму и обозначаются так:
l = 2: d-орбитали; l = 3: f-орбитали.
d-Орбитали есть на всех энергетических уровнях, кроме первого (К) и второго (L) уровней.
f-Орбитали есть на всех энергетических уровнях, кроме первого (К), второго (L) и третьего (М) уровней.
Энергия орбиталей (Е), которые находятся на одном энергетическом уровне, но имеют различную форму, неодинакова:
Es < Ep < Ed < Ef .
Поэтому энергетические уровни состоят из энергетичес-
ких подуровней.
• Энергетический подуровень — это совокупность орбиталей, которые находятся на одном энергетическом уровне и имеют одинаковую форму.
Значит, орбитали одного подуровня имеют одинаковые
значения главного квантового числа (n) и одинаковые значения побочного квантового числа (l ).
Энергетический подуровень обозначается так: главное квантовое число записывают арабской цифрой, побочное квантовое число записьгаают соответствующей латинской буквой (s, р, d, f и т. д.). Например: 1s — s- подуровень первого энергетического уровня (п = 1, l = 0); 4d — (d-подуровень четвертого энергетического уровня (п = 4, l = 2).
Число значений l для каждого уровня равно главному квантовому числу (см. табл. 10). Поэтому число подуровней
на уровне тоже равно главному квантовому числу.
Сколько орбиталей на различных подуровнях и чем отличаются орбитали одного подуровня?
Орбитали одного подуровня отличаются направлением (ориентацией) в пространстве.
89
