
- •Ароматические кислоты и их соли производные салициловой кислоты
- •Химические свойства
- •Кислота бензойная Натрия бензоат
- •Получение
- •Описанне
- •Растворимость
- •Подлинность
- •Чистота
- •Количественное определение
- •Хранение
- •Применение
- •Салициловая кислота и ее производные
- •Кислота салициловая Натрия салицилат
- •Получение
- •Описанне
- •Растворимость
- •Подлинность
- •6. Реакции электрофильного замещения (на фенольный гидроксил).
- •Чистота
- •Количественное определение
- •1.Методы кuслотно-основного титрования.
- •Хранение
- •Чистота
- •Количественное определение
- •Хранение
- •Примененне
- •Сложные эфиры салициловой кислоты
- •Получение
- •Описание
- •Растворимость
- •Подлинность
- •Чистота
- •Количественное определение
- •Хранение
- •Примененне
6. Реакции электрофильного замещения (на фенольный гидроксил).
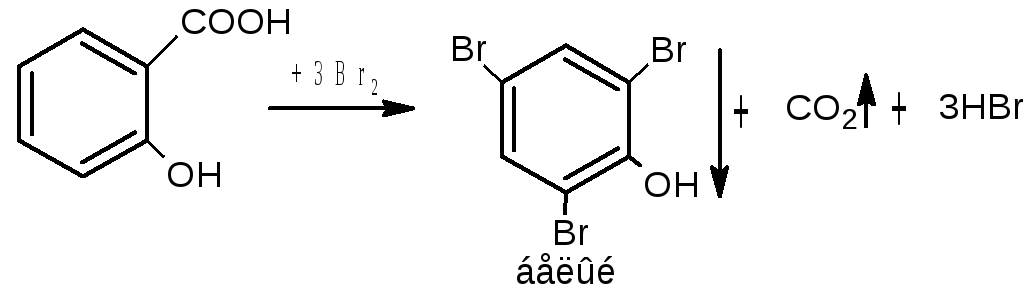
А) Реакция образования бромпроизводных.
Особенность этой реакции для салициловой кислоты в том, что действие брома приводит к декарбоксилированию и поэтому продукт реакции – трибромфенол в виде белого осадка.
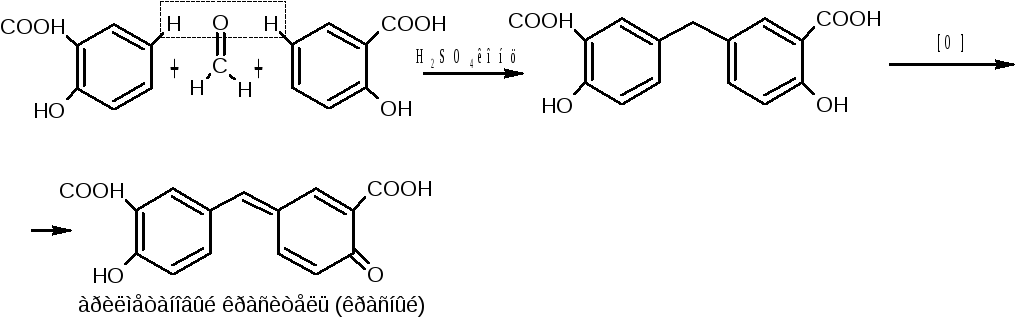
Б) Реакция конденсации с последующим окислением (салициловая кислота, ацетилсалициловая кислота) с реактивом Марки (формальдегид и концентрированная кислота серная). Красное окрашивание арилметанового красителя.
В) реакция образования азокрасителя с солями диазония (диазореактивом) в щелочной среде – желтое окрашивание, переходящее в розовое (обычно красное). Диазореактив – стрептоцид, обработанный НCl разв. и NaNО2

Чистота
В препаратах определяют примеси характеризующие общую степень очистки (хлориды, сульфаты, т.Ме, органические примеси - только в натрия салицилате )
в кислоте салициловой определяют
Температуру плавления
Прозрачность и цветность спиртового раствора (д.б. прозр. и б/цв.)
Красящие вещества и фенол определяют по цвету сухого остатка, полученного после выпаривания спиртового раствора.
Остаток д.б. белого цвета.
Оксидифенил

Препарат растворяют в Na2СО3 (карбонате натрия). Кислота салициловая растворяется, а примесь оксидифенил – нет.
Раствор д.б. прозрачным, если заметно помутнение, проводят экстракцию эфиром (примесь переходит в эфирный слой), эфир испаряют, сухой остаток взвешивают (д.б. не > 0,1%).
в натрия салицилате определяют
избыточную кислотность или щелочность по ф/ф.
Прозрачность и цветность водного раствора (д.б. прозрачным (салициловая кислота) и бесцветным).
Количественное определение
1.Методы кuслотно-основного титрования.
1.1 Алкалиметрический метод, вариант нейтрализации
для определения кислоты салициловой. Титрование ведут в спиртовой среде для превращения гидролиза образующихся натриевых солей. В качестве индикатора используют фенолфталеин.

1.2 Ацидиметрический метод, вариант вытеснения
для определения в водной среде натрия салицилата – это соль сильного основания и слабой кислоты (см. натрия бензоат).
Титрование ведут в присутствии эфира (среда), извлекающего из реакционной среды образующуюся кислоту, которая может изменять окраску до т.э. Эфир подавляет её диссоциацию.
Создается двухфазная система водный слой-эфир. Реакция идет в водном слое, салициловая кислота по мере образования извлекается в верхний эфирный слой. Индикатор смешанный (метилоранж и метиленовый синий в соотношении 2:1). В т.э. переход окрашивания из зеленого в фиолетовое.
1.3 МФ III Ацидиметрический метод титрования натрия салицилата в среде протогенного растворителя (неводное титрование).Растворитель - ледяная CH3COOH, которая повышает основные свойства карбоксилат-ионов. Индикатор кристаллический фиолетовый. Титрант - HClO4 хлорная кислота
лед.
CH3COOH
+HClO4

+
NaClO4
Механизм метода:
R - COONa + СН3СООН → RCOOH + СН3СОО- + Na+
ацетат-ион
НCIO4 + СН3СООН → СН3СООН2+ + CIO4-
ацетоний-ион перхлорат-ион
СН3СОО- + СН3СООН2+ → 2СН3СООН
Na++ CIO4 - → NaCIO4

Суммарно RCOONa + НCIO4 → RCOOH + NaCIO4
fэкв = 1/n, где n - количество СОО- в молекуле, которые титруются.
2. Методы галогенирования. Основаны на реакции электрофильного замещения атомов водорода ароматического кольца на атомы галогена.
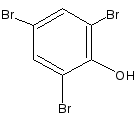
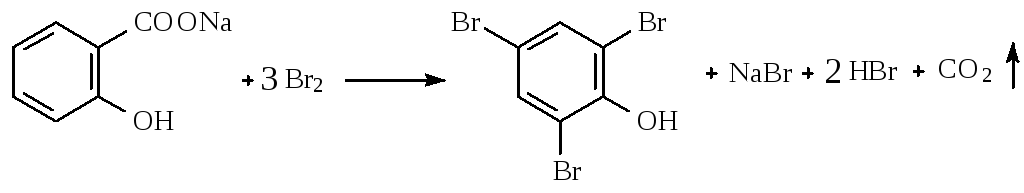
2.1.Броматометрический, вариант обратного титрования
(салициловая кислота, натрия салицилат).
КBгО3 + 5 КBr + 6 НСl → 3 Вr2 + 6KCl + ЗН2О
+
3Br2
+
3HBr
+ CO2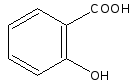


Br2 + 2КI → I2 + 2КВг
I2 + 2 Na2S2О3 → 2NaI + Na2S406
f экв. (кислоты силициповой) = 1/6
Бромирование салициловой кислоты и натрия салицилата идёт с декарбоксилированием. Это происходит в результате согласованной ориентации -ОН и -СООН групп.
KBrO3 + 5KBr + 6HCL → Br2 + 6KCL + 3H2O
Br2 + 2KJ → J2 + 2KBr
J2 + 2Na2S2O3 → 2NaJ + Na2S4O6
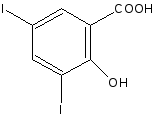
2.2. Йодометрический или йодхлорметрический (кислота салициловая).
в лекции нет
+
2
I2
4
атома
(4
экв.)
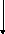
+
2HI


+
2
ICl
4
атома
(4
экв.)
+
2
HCl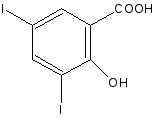
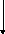

IСl + 2КI → I2 + 2КСl
Избыток йода титруют раствором натрия тиосульфата.
I2 + 2 Na2S2О3 → 2 NaI + Na2S406
f экв (кислоты салициловой) = 1/4
Йодирование идёт без декарбоксилирования.
