
- •1. Витамины, понятие, история открытия и изучения витаминов.
- •11.Активные формы витамина д, их роль в регуляции фосфорно-кальциевого обмена.
- •12. Биохимическая характеристика патогенеза рахита, формы рахита.
- •13. Биохимическая характеристика гипервитаминоза д.
- •21. Витамин pp (b5), химическое строение, биологическая роль, проявления недостаточности
- •22. Витамин b6, химическое строение, биологическая роль, проявления авитаминоза.
- •23. Витамин b9, химическое строение, биологическая роль, проявления недостаточности. Антивитамины фолиевой кислоты
- •24. Витамин b12, химическая природа, роль в процессах метаболизма, проявление недостаточности.
- •25. Биотин, химическое строение, биологическая роль, проявления авитаминоза.
- •26. Витамин с, химическое строение, потребность, роль в процессах метаболизма. Проявление недостаточности витамина с.
- •27. Принципы и химизм качественного открытия и количественного определения витамина с в продуктах и биологических жидкостях.
- •4. Особенности ферментативного катализа.
23. Витамин b9, химическое строение, биологическая роль, проявления недостаточности. Антивитамины фолиевой кислоты
Суточная потребность в свободной фолиевой кислоте для взрослого человека составляет 1-2 мг.

Недостаточность фолиевой кислоты трудно
вызвать даже у животных без предварительного подавления в кишечнике
роста микроорганизмов, которые синтезируют ее в необходимых коли-
чествах; авитаминоз обычно вызывают введением антибиотиков и скарм-
ливанием животным пищи, лишенной фолиевой кислоты. У обязьян фо-
лиевая недостаточность сопровождается развитием специфической анемии;
у крыс сначала развивается лейкопения, а затем анемия. У человека
наблюдается клиническая картина макроцитарной анемии, очень похожая
на проявления пернициозной анемии – следствия недостаточности витамина
В12
, хотя нарушения нервной системы отсутствуют. Иногда отмечается
диарея. Имеются доказательства, что при недостаточности фолиевой
кислоты нарушается процесс биосинтеза ДНК в клетках костного мозга,
в которых в норме осуществляется эритропоэз. Как следствие этого
в периферической крови появляются молодые клетки – мегалобласты – с
относительно меньшим содержанием ДНК.


24. Витамин b12, химическая природа, роль в процессах метаболизма, проявление недостаточности.


25. Биотин, химическое строение, биологическая роль, проявления авитаминоза.


Клинические проявления недостаточности биотина у человека изучены
недостаточно. Это объясняется тем, что бактерии кишечника обладают
способностью синтезировать биотин в необходимых количествах. Недоста-
точность его проявляется в случае употребления большого количества
сырого яичного белка или приема сульфаниламидных препаратов и анти-
биотиков, подавляющих рост бактерий в кишечнике. У человека при
недостаточности биотина отмечаются воспалительные процессы кожи
(дерматиты), сопровождающиеся усиленной деятельностью сальных желез,
выпадением волос, поражением ногтей, часто отмечаются боли в мышцах,
усталость, сонливость, депрессия, а также анорексия и анемия. Все эти
явления обычно проходят через несколько дней после ежедневного введения
биотина. У крыс недостаточность биотина, вызванная введением с пищей
сырого яичного белка, вызывает явления острого дерматита, облысение
и параличи.
26. Витамин с, химическое строение, потребность, роль в процессах метаболизма. Проявление недостаточности витамина с.
Суточная потребность в витамине С для человека составляет 75 мг.

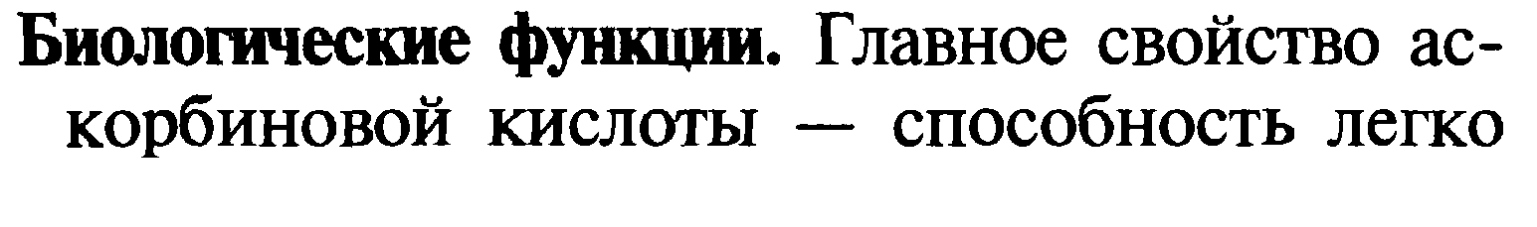


27. Принципы и химизм качественного открытия и количественного определения витамина с в продуктах и биологических жидкостях.
Метод основан на способности витамина восстанавливать 2,6-дихлор-фенолиндофенол. Этот индикатор в щелочной среде имеет синюю окраску, в кислой- розовую окраску, при восстановлении он обесцвечивается. Титрование аскорбиновой кислоты проводится щелочным раствором индикатора. Раствор титруемого продукта при этом подкисляется. Пока в исследуемом продукте присутствует аскорбиновая кислота, приливаемый синий раствор (щелочной) индикатора восстанавливается витамином и переходит в бесцветную форму. Как только все количество витамина окислится, титруемый раствор приобретет розовое окрашивание за счет появления в среде окисленной формы 2,6-дихлорфенолиндофенола.
Ферменты, понятия, химическая природа, роль в процессах метаболизма.
Ферменты- специфические белки, присутствующие во всех живых клетках и обеспечивающие биокатализ, т.е. изменение скорости химических реакций. По химической природе ферменты делятся на однокомпонентные (простые белки), построенные только из аминокислотных остатков, и двухкомпонентные, состоящие из белкового компонента (апофермента) и небелкового (кофактора). Связь между этими компонентами может быть как ковалентной, так и нековалентной.
В основе каталического действия ферментов лежит способность высокоизбирательно образовывать белково- лигандные комплексы с субстратами (веществами, на которые направлено их действие) и вызывать химические превращения субстратов.
История открытия и изучения ферментов.
Явления брожения и переваривания известны с незапамятных времен,
однако зарождение учения о ферментах (энзимология) относится к первой
половине XIX в. Первое научное представление о ферментах было дано еще
в 1814 г. петербургским ученым К.С. Кирхгофом, который показал, что не
только проросшие зерна ячменя, но и экстракты из солода способны
осахаривать крахмал с превращением его в мальтозу. Вещество, извлекае-
мое из проросшего ячменя и обладающее способностью превращать крах-
мал в мальтозу, получило название амилазы. Ю. Либих и Ф. Велер от-
крыли агент, расщепляющий амигдалин, содержащийся в эфирном масле
горького миндаля. Этот агент был назван эмульсином. В последующие
годы были описаны другие ферменты, в частности пепсин и трипсин,
вызывающие распад (гидролиз) белков в пищеварительном тракте.
Наибольшее внимание исследователей привлекали процессы окисления
в организме. Уже был известен феномен химического катализа, означаю-
щий, что многие реакции in vitro протекают быстро и энергично в при-
сутствии ничтожных количеств примесей, как будто не участвующих в реак-
ции. Так, была установлена большая каталитическая роль ряда неорга-
нических веществ. Горение глюкозы на воздухе, например, протекает очень
медленно, а если добавить немного солей лития (или золы, также содержа-
щей ничтожные количества лития), то горение идет весьма интенсивно:
С6Н12О6 + 6O2 –> 6СO2 + 6Н2O.
Известно, что в живых организмах «горение» (а точнее, окисление)
углеводов также протекает быстро и до тех же конечных продуктов обмена,
т.е. СО2
и Н2О, с выделением (и накоплением) энергии. Однако это
«горение» происходит при относительно низкой температуре, без пламени
и, что особенно интересно, в присутствии воды. Разумеется, в этих необыч-
ных условиях без действия ферментов, получивших наименование биоло-
гических катализаторов , не было бы окисления углеводов. Забегая
несколько вперед, укажем, что в процессе превращения (окисления) глю-
козы в организме до СО2
и Н2О участвует последовательно около 15
различных ферментов (см. главу 10).
Биологические катализаторы, т.е. ферменты, как оказалось, не вызы-
вают в отличие от неорганических катализаторов каких-либо побочных
реакций и не участвуют в реакциях, невозможных по термодинамическим
условиям; и те, и другие катализаторы только ускоряют химические
реакции, обычно протекающие очень медленно. Примером может служить
реакция расщепления перекиси водорода на кислород и воду, медленно
протекающая в отсутствие катализатора. При добавлении мелкораздроб-
ленной платины скорость этой реакции резко возрастает:
Эта же реакция будет протекать намного быстрее в присутствии фермен-
та каталазы, содержащейся, в частности, в эритроцитах, причем образуются
те же конечные продукты распада перекиси водорода.
Таким образом, можно считать установленным, что ферменты ката-
лизируют ряд химических реакций, аналогичных химическим реакциям,
катализируемым неорганическими веществами. Более того, считается ус-
тановленным, что любую из протекающих в живых организмах (или
клетках) химическую реакцию можно в принципе осуществить вне орга-
низма (или вне клетки), если экспериментатору удается выделить соот-
ветствующий фермент (или систему ферментов), катализирующий данную
реакцию, и создать оптимальные условия для его действия.
Горизонты энзимологии. В литературе появляются работы, в которых
делаются попытки прогнозирования дальнейшего развития энзимологии на
ближайшее десятилетие. Перечислим основные направления исследований
энзимологии будущего. Во-первых, это исследования более тонких деталей
молекулярного механизма и принципов действия ферментов в соответствии
с законами классической органической химии и квантовой механики,
а также разработка на этой основе теории ферментативного катализа.
Во-вторых, это изучение ферментов на более высоких уровнях (надмоле-
кулярном и клеточном) структурной организации живых систем, причем не
столько отдельных ферментов, сколько ферментных комплексов в сложных
системах. В-третьих, исследование механизмов регуляции активности и
синтеза ферментов и вклада химической модификации в действие фермен-
тов. В-четвертых, будут развиваться исследования в области создания
искусственных низкомолекулярных ферментов – синзимов (синтетические
аналоги ферментов), наделенных аналогично нативным ферментам высокой
специфичностью действия и каталитической активностью, но лишенных
побочных антигенных свойств. В-пятых, исследования в области инже-
нерной энзимологии (белковая инженерия), создание «гибридных» ката-
лизаторов, сочетающих свойства ферментов, антител и рецепторов, а также
создание биотехнологических реакторов с участием индивидуальных фер-
ментов или полиферментных комплексов, обеспечивающих получение и
производство наиболее ценных материалов и средств для народного хо-
зяйства и медицины. Наконец, исследования в области медицинской эн-
зимологии, основной целью которых является выяснение молекулярных
основ наследственных и соматических болезней человека, в основе развития
которых лежат дефекты синтеза ферментов или нарушения регуляции
активности ферментов.
Свойства ферментов как катализаторов.





