
3 курс / Патофизиология / Учебник Литвицкий 4 издание
.pdf♦ Коррекция метаболизма путѐм: ограничения попадания в организм веществ, метаболически не усваивающихся (например, фенилаланина или лактозы); выведения из организма метаболитов, накапливающихся в нѐм в избытке (например, фенилпировиноградной кислоты или холестерина); регуляции активности ферментов (например, подавление активности КФК при
отдельных видах миодистрофий, активация липопротеинлипазы крови при гиперхолестеринемии). ♦ Хирургическая коррекция дефектов (например, создание шунта между нижней полой и воротной венами у пациентов с «гепатотропными» гликогенозами).
• Симптоматическая терапия. Направлена на устранение симпто-
мов, усугубляющих состояние пациента (например, применение веществ, снижающих вязкость секретов экзокринных желѐз при муковисцидозе; хирургическое удаление дополнительных пальцев и перемычек кожи между ними при поли- и синдактилии; выполнение пластических операций при дефектах лица, пороках сердца и крупных сосудов).
Профилактика
Всем семьям, имеющим случаи наследственных заболеваний, т.е. при повышенной вероятности рождения ребѐнка с патологией необходимо проводить медико-генетическое консультирование, задачи которого - выявление генетических заболеваний и определение возвратного риска.
• Выявление генетических заболеваний. В первую очередь необходима
точная диагностика, позволяющая определить природу заболевания и отдифференцировать состояния, имеющие сходную клиническую картину.
• Определение возвратного риска. При установлении точного диагноза
становится возможным рассчитать вероятность повторного случая заболевания. В связи с этим необходима пренатальная диагностика.
• Анализ родословной (см. рис. 3-1) - первый этап медико-генетичес-
кого консультирования. Необходимо собрать полную информацию о состоянии здоровья всех членов семьи (не менее четырѐх поколений).
ГЛАВА 4. ПАТОЛОГИЯ КЛЕТКИ
Клетки - основные структурно-функциональные элементы тканей, органов и организма в целом - для выполнения своих функций поддерживают собственный гомеостаз, осуществляют обмен веществ и энергии, реализуют генетическую информацию,

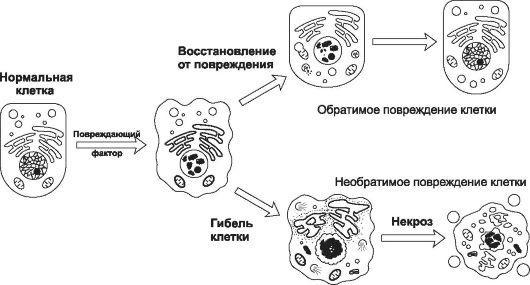
передают еѐ потомству и прямо или опосредованно (через межклеточный матрикс и жидкости) обеспечивают функции организма. Любая клетка (рис. 4-1) либо функционирует в границах нормы (гомеостаз), либо приспосабливается к жизни в изменившихся условиях (адаптация), либо гибнет при превышении еѐ адаптивных возможностей (некроз) или действии соответствующего сигнала (апоптоз).
• Гомеостаз (гомеокинез) - динамическое равновесие в данной клетке, с другими клетками, межклеточным матриксом и гуморальными
Рис. 4-1. Гомеостаз, адаптация и типовые формы патологии клеток. Слева в овале - границы нормы. Существенное свойство типовых патологических процессов - их обратимость. Если степень повреждения выходит за пределы адаптивных возможностей, процесс становится необратимым (примеры - некроз, апоптоз, дисплазия, опухолевый рост).
факторами, обеспечивающее оптимальную метаболическую и информационную поддержку. Жизнь клетки в условиях гомеостаза - постоянное взаимодействие с различными сигналами и факторами.
•Адаптация - приспособление в ответ на изменения условий существования клеток (в том числе на воздействие повреждающего фактора).
•Гибель клетки - необратимое прекращение жизнедеятельности. Происходит либо вследствие генетически программированного процесса (апоптоз), либо в результате летального повреждения (некроз).
•Типовые формы патологии клеток: дистрофии, дисплазии, метаплазия, гипотрофия (атрофия), гипертрофия, а также некроз и патологические формы апоптоза.
Повреждение Повреждающие факторы
•Эффект повреждающего фактора может быть обратимым или необратимым (рис. 4- 2).
•Природа повреждающего фактора трояка: физическая, химическая или биологическая (включая социальную).
• Генез. По происхождению повреждающие факторы подразделяют на экзогенные и эндогенные.
Рис. 4-2.
Признаки обратимого и необратимого повреждения. [по 4].
♦ Экзогенные факторы (действуют на клетку извне):
физические воздействия (механические, термические, лучевые, электрический ток);
химические агенты (кислоты, щѐлочи, этанол, сильные окислители);
инфекционные факторы (вирусы, риккетсии, бактерии, эндо- и экзотоксины микроорганизмов, гельминты и др.).
♦ Эндогенные агенты (образуются и действуют внутри клетки):
физической природы (например, избыток свободных радикалов; колебания осмотического давления);
химические факторы (например, накопление или дефицит ионов H+, K+, Ca2+, кислорода, углекислого газа, перекисных соединений, метаболитов и др.);
биологические агенты (например, белки, лизосомальные ферменты, метаболиты, Ig, цитотоксические факторы; дефицит или избыток гормонов, ферментов, простагландинов - Пг).
• Эффекты повреждающих факторов достигаются прямо (первичные факторы повреждения) или опосредованно (при формировании цепи вторичных патологических реакций - вторичные факторы повреждения).
МЕХАНИЗМЫ ПОВРЕЖДЕНИЯ КЛЕТОК
К наиболее важным механизмам клеточной альтерации относятся:
♦расстройства энергетического обеспечения клетки;
♦повреждение мембран и ферментов;
♦активация свободнорадикальных и перекисных процессов;
♦дисбаланс ионов и воды;
♦нарушения в геноме или экспрессии генов;
♦расстройства регуляции функций клеток.
Расстройства энергетического обеспечения клетки
Энергоснабжение клетки может расстраиваться на этапах ресинтеза, транспорта и утилизации энергии АТФ. Главная причина расстройств - гипоксия (недостаточное снабжение клеток кислородом и нарушение биологического окисления).
•Ресинтез АТФ нарушается в результате дефицита кислорода и субстратов метаболизма, снижения активности ферментов тканевого дыхания и гликолиза, а также повреждения и разрушения митохондрий (в которых осуществляются реакции цикла Кребса и сопряжѐнный с фосфорилированием АДФ перенос электронов к молекулярному кислороду).
•Транспорт энергии. Заключѐнная в макроэргических связях энергия АТФ поступает к эффекторным структурам (миофибриллы, ион-
ные насосы и др.) с помощью АДФ-АТФ-транслоказы и КФК. При повреждении этих ферментов или мембран клеток нарушается функция эффекторных структур.
• Утилизация энергии может быть нарушена преимущественно за счѐт уменьшения активности АТФаз (АТФаза миозина, Na+K+-АТФаза плазмолеммы, протонная и калиевая АТФаза, Са2+-АТФаза и др.), КФК, адениннуклеотидтрансферазы.
Повреждение мембран
Повреждение клеточных мембран происходит за счѐт следующих процессов:
•Активация гидролаз. Под влиянием патогенных факторов активность мембраносвязанных, свободных (солюбилизированных) и лизосомальных липаз, фосфолипаз и протеаз может значительно увеличиться (например, при гипоксии и ацидозе). В результате фосфолипиды и белки мембран подвергаются гидролизу, что сопровождается значительным повышением проницаемости мембран.
•Расстройства репарации мембран. При воздействии повреждающих факторов репаративный синтез альтерированных или утраченных мембранных макромолекул (а
также их синтез de novo) подавляется, что приводит к недостаточному восстановлению мембран.
•Нарушения конформации макромолекул (их пространственной структуры) приводит к изменениям физико-химического состояния клеточных мембран и их рецепторов, что приводит к искажениям или потере их функций.
•Разрыв мембран. Перерастяжение и разрывы мембран набухших клеток и органоидов в результате их гипергидратации (следствие значительного увеличения осмотического и онкотического давления) - важный механизм повреждения мембран и гибели клетки.
•Свободнорадикальные и перекисные реакции - в норме это необходимое звено транспорта электронов, синтеза Пг и лейкотриенов, фагоцитоза, метаболизма катехоламинов и др. В свободнорадикальные реакции вовлекаются белки, нуклеиновые кислоты и, особенно, липиды, учитывая наличие большого их числа в мембранах клеток (свободнорадикальное перекисное окисление липидов - СПОЛ). При действии патогенных факторов генерация свободных радикалов и СПОЛ значительно возрастает, что усиливает повреждение клеток.
♦ Этапы СПОЛ: образование активных форм кислорода - генерация свободных радикалов органических и неорганических веществ - продукция перекисей и гидроперекисей липидов.
Активные формы кислорода - синглетный (Ό2) супероксидный радикал (O2-)
пероксид водорода (H2O2) гидроксильный радикал (OH-).
♦ Прооксиданты и антиоксиданты. Интенсивность СПОЛ регулируется соотношением активирующих (прооксидантов) его и подавляющих (антиоксидантов) факторов.
Прооксиданты - легко окисляющиеся соединения, нейтрализующие свободные радикалы (нафтохиноны, витамины A и D, восстановители - НАДФH2, НАДH2, липоевая кислота, продукты метаболизма Пг и катехоламинов).
Антиоксиданты - вещества, ограничивающие или даже прекращающие свободнорадикальные и перекисные реакции (ретинол, каротиноиды, рибофлавин, токоферолы, маннитол, супероксиддисмутаза, каталаза).
♦ Детергентные эффекты амфифилов. В результате активации липопероксидных реакций и гидролаз накапливаются гидроперекиси липидов, свободные жирные кислоты и фосфолипиды - амфифилы (вещества, способные фиксироваться как в гидрофобной, так и в гидрофильной зоне мембран). Это ведѐт к формированию обширных амфифильных кластеров (простейшие трансмембранные каналы), микроразрывам и разрушению мембран.
Дисбаланс ионов и воды
Внутриклеточная жидкость содержит примерно 65% всей воды организма и характеризуется низкими концентрациями Na+ (10 ммоль/л), Cl- (5 ммоль/л), HCO3- (10 ммоль/л), но высокой концентрацией K+ (150 ммоль/л) и PO43- (150 ммоль/л). Низкая концентрация Na+ и высокая концентрация K+ обусловлены работой Na+,K+-АТФазы, выкачивающей Na+ из клеток в обмен на K+. Клеточный дисбаланс ионов и воды развивается вслед за расстройствами энергетического обеспечения и повреждением мембран.
К проявлениям ионного и водного дисбаланса относятся: изменение соотношения отдельных ионов в цитозоле; нарушение трансмембранного соотношения ионов; гипергидратация клеток; гипогидратация клеток; нарушения электрогенеза.
•Изменения ионного состава обусловлены повреждениями мембранных АТФаз и дефектами мембран. Так, вследствие нарушения работы Na+,K+-АТФазы происходит накопление в цитозоле избытка Na+ и потеря клеткой K+.
•Осмотическое набухание и осмотическое сморщивание клеток. Состояние клеток при изменении осмотичности рассмотрено на рис. 4-3.
•Гипергидратация. Основная причина гипергидратации повреждѐнных клеток - повышение содержания Na+, а также органических веществ, что сопровождается увеличением в них осмотического давления и набуханием клеток. Это сочетается с растяжением и
•микроразрывами мембран. Такая картина наблюдается, например, при осмотическом гемолизе эритроцитов (рис. 4-3).Гипогидратация клеток наблюдается, например, при лихорадке, гипертермии, полиурии, инфекционных заболеваниях (холере, брюшном тифе, дизентерии). Эти состояния ведут к потере организмом воды, что сопровождается выходом из клеток жидкости, а также органических и неорганических водорастворимых соединений.
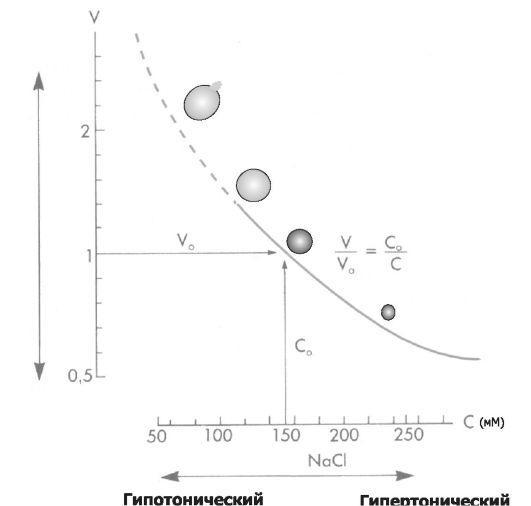
Рис. 4-3. концентрация (С)
NaCl (ммоль/л); по оси ординат: объѐм клеток (V). При концентрации NaCl 154 ммоль/л объѐм клеток такой же, как и в плазме крови (изотонический раствор NaCl), При увеличении концентрации NaCl (гипертонический раствор NaCl) вода выходит из эритроцитов, и они сморщиваются. При уменьшении концентрации NaCl (гипотонический раствор NaCl) вода входит в эритроциты, и они набухают. При гипотоничности раствора, примерно в 1,4 раза превышающей значение изотонического раствора, происходит разрушение мембраны. [5].
• Нарушения электрогенеза (изменения характеристик мембранного потенциала - МП и потенциалов действия - ПД) имеют существенное значение, поскольку они нередко являются одним из важных признаков наличия и характера повреждения клеток. Примером могут служить изменения ЭКГ при повреждении клеток миокарда, электроэнцефалограммы при патологии нейронов головного мозга, электромиограммы при изменениях в мышечных клетках.
Генетические нарушения
Изменения в геноме и экспрессии генов - существенный фактор повреждения клетки. К таким нарушениям относятся мутации, дерепрессии и репрессии генов, трансфекции, нарушения митоза.
•Мутации (так, мутация гена инсулина приводит к развитию сахарного диабета).
•Дерепрессия патогенного гена (дерепрессия онкогена сопровождается трансформацией нормальной клетки в опухолевую).
•Репрессия жизненно важного гена (подавление экспрессии гена фенилаланин 4- монооксигеназы обусловливает гиперфенилаланинемию и развитие олигофрении).
•Трансфекция (внедрение в геном чужеродной ДНК). Например, трансфекция ДНК вируса иммунодефицита приводит к возникновению СПИДа.
•Нарушения митоза (так, деление ядер эритрокариоцитов без деления цитоплазмы наблюдается при мегалобластных анемиях) и мейоза (нарушение расхождения половых хромосом ведѐт к формированию хромосомных болезней).
ПРОЯВЛЕНИЯ ПОВРЕЖДЕНИЙ КЛЕТОК
Любое повреждение клетки вызывает в ней разной степени выраженности специфические и неспецифические изменения.Специфические изменения развиваются при действии определѐнного патогенного фактора на различные клетки или вопределѐнных видах клеток при действии разных повреждающих агентов.
• Патогенные факторы, вызывающие специфические изменения в различных клетках: осмотическое давление, разобщители, гиперальдостеронемия и др.
♦Осмотическое давление. Повышение осмотического давления в клетке всегда сопровождается еѐ гипергидратацией, растяжением мембран и нарушением их целостности (феномен «осмотическая деструкция клеток»).
♦Разобщители. Под влиянием разобщителей окисления и фосфорилирования
(например, высших жирных кислот - ВЖК или Ca2+) снижается или блокируется сопряжение этих процессов и эффективность биологического окисления.
♦ Гиперальдостеронемия. Повышенное содержание в крови и интерстиции альдостерона ведѐт к накоплению в клетках Na+.
• Группы клеток, реагирующие специфическими изменениями на действие различных повреждающих агентов:
♦Мышечные элементы на влияние разнообразных патогенных факторов значительной силы реагируют развитием их контрактуры.
♦Эритроциты при различных повреждениях подвергаются гемолизу с выходом Hb.
Неспецифические изменения (стереотипные, стандартные) развиваются при
повреждении различных видов клеток и действии на них широкого спектра
патогенных агентов. Примеры: ацидоз, чрезмерная активация свободнорадикальных и перекисных реакций, денатурация молекул белка, повышение проницаемости клеточных мембран, дисбаланс ионов и воды, снижение эффективности биологического окисления.
Типовые формы патологии
Основными типовыми формами патологии клеток являются их гипотрофия и атрофия, гипертрофия и дистрофии, дисплазии, метаплазия, а также некроз и апоптоз.
Гипотрофия и атрофия. Гипотрофия характеризуется уменьшением размеров и массы клетки, крайней степенью чего является атрофия. Гипотрофия и атрофия обычно сочетаются с уменьшением количества клеток - гипоплазией. Это приводит к уменьшению объѐма органа, истончению кожи и слизистых оболочек. Пример: уменьшение массы и числа клеток в ишемизированной ткани или органе. Гипертрофия. Для гипертрофии характерно увеличение размеров и массы клетки. Нередко это сопровождается увеличением числа клеток (гиперплазией). Выделяют физиологическую и патологическую гипертрофию.
•Физиологическая гипертрофия носит адаптивный характер (например, гипертрофия скелетных мышц у спортсменов).
•Патологическая гипертрофия имеет (наряду с адаптивным) патологическое значение. Различают рабочую, викарную и нейрогуморальную патологическую гипертрофию, сочетающуюся с ремоделированием органа или ткани.
♦Рабочая гипертрофия развивается при постоянно повышенной нагрузке (например, патологическая гипертрофия миокарда при гипертонической болезни).
♦Викарная (заместительная) гипертрофия развивается в одном из парных органов при удалении второго.
♦Нейрогуморальная гипертрофия развивается при нарушении нейрогуморальной регуляции (например, акромегалия, гинекомастия).
Дистрофии
Клеточные дистрофии - нарушения обмена веществ, сопровождающиеся расстройством функций клеток.
• Механизмы дистрофий разнообразны:
синтез аномальных (в норме не встречающихся в клетке) веществ (например, белковополисахаридного комплекса амилоида);
избыточное превращение одних соединений в другие (например, углеводов в жиры при сахарном диабете);
декомпозиция (фанероз): распад субклеточных структур и веществ (например, белково-липидных комплексов мембран при хронической гипоксии);
инфильтрация клеток и межклеточного вещества органическими и неорганическими соединениями (например, липопротеинами низкой плотности - ЛПНП и Ca2+ интимы артерий при атеросклерозе).
• Классификация. Основным критерием классификации клеточных дистрофий является преимущественное нарушение метаболизма отдельных классов веществ. В связи с этим критерием различают диспротеинозы (белковые дистрофии),липидозы (жировые дистрофии), диспигментозы (пигментные дистрофии), углеводные и минеральные дистрофии. В отдельную группу выделяют тезаурисмозы (болезни накопления).
Диспротеинозы. Для белковых дистрофий характерно изменение физико-химических свойств клеточных белков. Выделяют зернистую, гиалиново-капельную и гидропическую дистрофии.
Липидозы. Для жировых дистрофий характерно увеличение содержания внутриклеточных липидов и их перераспределение в тканях и органах. Выделяют первичные и вторичные липидозы.
Первичные липидозы наблюдаются, как правило, при генетически обусловленных ферментопатиях (например, ганглиозидозы, цереброзидозы, сфинголипидозы).
Вторичные липидозы развиваются в результате воздействия различных патогенных факторов, таких как гипоксия, тяжѐлые инфекции, системные заболевания, отравления (в том числе некоторыми ЛС - цитостатиками, антибиотиками, барбитуратами).
Углеводные дистрофии. Характеризуются нарушениями обмена полисахаридов
(гликогена, мукополисахаридов) и гликопротеинов (муцина, мукоидов).
Полисахариды. При нарушениях метаболизма полисахаридов в клетках можно наблюдать уменьшение содержания углеводов (например, гликогена при СД), отсутствие углеводов (агликогенозы; например, при циррозе печени или хронических гепатитах) и накопление избытка углеводов (например, гликогеноз фон Гирке - нефромегалический синдром - гликогенная инфильтрация клеток почек).
Гликопротеины. Углеводные дистрофии, связанные с нарушением метаболизма гликопротеинов, характеризуются, как правило, накоплением муцинов и мукоидов, имеющих слизистую консистенцию (в связи с этим их называют также слизистыми дистрофиями).
