
Методичні вказівки 2
.pdfVNaCl, см3 |
0 |
2 |
4 |
6 |
7 |
8 |
9 |
10 |
ϕ, мВ |
+50 |
+48 |
+46 |
+40 |
–10 |
–275 |
–300 |
–375 |
Визначити масу HCl у досліджуваному розчині.
Алгоритм розв’язання
Будуємо на міліметровому папері інтегральну криву титрування (аналогічно як у задачі 2). Знаходимо еквівалентний об’єм титранта (Vекв(NaOH) = 7,5 см3) і за законом еквівалентів обчислити масу HCl.
|
|
|
n(HCl) = n(NaOH) |
||
Оскільки ν(HCl) = |
m(HCl) |
, |
то |
m(HCl) |
= C(NaOH) Veкв(NaOH) . |
|
|||||
|
M (HCl) |
|
M (HCl) |
||
Звідки m(HCl)=C(NaOH)Veкв(NaOH) M(HCl)=0,1×7,5×36,5×10–3 =0,028 г.
в) Задачі для самостійного розв’язання
1. Розрахувати рН венозної крові людини, якщо за температури 25 оС ЕРС воднево-хлорсрібного елемента становить 0,65 В. За цієї температурі хлорсрібний електрод має потенціал 0,22 В.
Відповідь: рН = 7,29
2.Знайти рН та рОН шлункового соку людини, яким заповнено водневий
електрод, що з’єднаний у гальванічний елемент із насиченим каломельним електродом при 20 оС. ЕРС цього елемента 0,315 В, а потенціал
|
|
каломельного електрода jк = 0,247 В. |
|
|
|
|
|
|||
Відповідь: рН = 1,15, рОН = 12,85. |
|
|
|
|
|
|
||||
3. |
Розчин HCl титрували потенціометрично 1 М розчином NaOH. За такими |
|||||||||
|
|
результатами титрування визначити масу HCl у досліджуваному розчині: |
||||||||
|
|
VNaOH , см3 |
0 |
0,50 |
0,90 |
0,99 |
1,0 |
1,01 |
1,10 |
|
|
|
ϕ водневого |
398 |
416 |
457 |
516 |
683 |
890 |
929 |
|
|
|
електрода, мB |
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
Відповідь: 0,0365 г. |
|
|
|
|
|
|
|
|
4. |
Матеріал для аудиторної роботи |
|
|
|
|
|
||||
4.1. Перелік практичних завдань, які необхідно виконати на практичному
занятті:
– визначити рН однієї з біологічний рідин людини;
– визначити концентрацію розчину сильної кислоти чи основи.
4.2. Інструкції по виконанню практичних завдань
4.2.1 Визначити рН однієї з біологічний рідин людини Вимірювання величини рН досліджуваної рідини проводять з
використанням рН-метра-мімівольтметра рН-150М у наступній послідовності: 1) за необхідності під’єднати комбінований електрод ЕСК-10301 (в ньому суміщений робочий скляний електрод та електрод порівняння –
хлорсрібний електрод) до приладу через гніздо «ВХОД» (рис. 12.4); 2) натиснути кнопку «ВКЛ» на приладі;
41
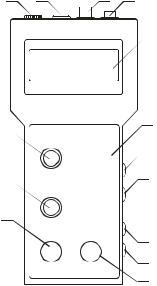
3)встановити температуру розчину натискаючи кнопку «РЕЖИМ» до встановлення одиниці вимірювання «оС» та, обертаючи ручку «РУЧН.ТЕМП.»;
4)перейти в режим вимірювання рН, натискаючи кнопку «РЕЖИМ» до
встановлення одиниць вимірювання «рН»;
13 |
12 |
5 |
8 |
Рис. 12.4 рН-метр-мілівольтметр рН-150М
1– панель приладу;
22 – індикатор;
3 – ручка встановлення температури;
4 – ручка для калі бровки за буферним
|
|
|
|
розчином; |
|
|
|
|
|
||||
|
|
|
|
5 |
|
– |
|
гніздо |
для |
підключення |
комбінованого |
||
|
|
|
|
(вимірювального) електроду, «ВХОД»; |
|
||||||||
4 |
РН-150М |
1 |
6 |
– |
кнопка переключення режимів роботи; |
||||||||
|
7 |
– |
кнопка включення живлення; |
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||
БУФЕР |
|
|
|
8 |
– |
вилка для підключення термокомпенсатора; |
|||||||
|
|
|
9 |
||||||||||
|
|
рНИ |
|
9 |
|
– |
|
резистор |
для |
встановлення |
значення |
||
3 |
|
11 |
координати рНИ; |
|
|
|
|
||||||
|
|
|
|
|
|
||||||||
РУЧН. ТЕМП. |
|
Т1 |
|
10 |
|
– |
резистор |
для |
регулювання |
крутизни |
|||
|
|
|
|
електродної системи; |
|
|
|
||||||
6 |
|
|
|
11 |
– |
резистор для регулювання початку та кінця |
|||||||
|
|
Т2 |
|
діапазону вимірювання температури; |
|
||||||||
|
|
|
11 |
12 – |
гніздо для підключення блоку живлення; |
||||||||
РЕЖИМ |
ВКЛ |
S |
|
||||||||||
ВЫКЛ |
10 |
13 |
|
– |
гніздо |
для підключення |
допоміжного |
||||||
|
|
|
|||||||||||
7електроду, «ВСП.».
5)занурити електроди у досліджуваний розчин, який попередньо наливають у хімічний стакан, і проводять відлік величини рН після їх встановлення, час якого залежить від буферної ємності;
6)після проведення вимірювань промити електроди дистильованою водою
ізанурити у воду або 0,1 М розчин хлоридної кислоти.
4.2.2. Визначити концентрацію розчину сильної кислоти чи основи У стаканчик для титрування налити піпеткою 10,0 см3 задачі-розчину і
помістити його на магнітну мішалку. Відповідно до завдання вибрати електроди – порівняння та індикаторний і занурити їх у досліджуваний розчин. Якщо необхідно, можна долити дистильованої води та перемішати розчин. Вибрані електроди підключити до рН-метра рН-150М для вимірювання ЕРС.
Записати схему гальванічного елемента із вибраних електродів, наприклад:
(–) Ag | AgCl, KCl | скляна мембрана | дослідж. р-н | KCl, AgCl | Ag (+)
Заповнити бюретку титрантом і виміряти ЕРС кола, або величину потенціалу індикаторного електрода
Додати з бюретки порцію (1,0 см3) титранта, перемішати розчин магнітною мішалкою і виміряти величину ЕРС. Розрахувати співвідношення E/ V. Якщо величина E/ V меншa від 20 мВ/см3 – додавати порції титранта
42
по 1,0 см3 . Якщо ж E/ V становить 20–50 мВ/см3 включно – приливати порції титр анта по 0,5 см3. Коли величина E/ V стане більшою від 50 мВ/см3 – титрант треба додавати порціями по 0,1 см3. Титрування продовжувати доти, поки значення E/ V почне зменшуватися приблизно до 20 мВ/см3 і нижче. Після цього титрант додають ще 5 разів по 1 см3 і закінчують титрування.
Результати титрування занести у таблицю 12.1.
|
|
|
|
Таблиця 12.1 |
||
Об’єм титр анта V, |
Е (або ϕ), |
Е ( ϕ), |
V, |
E/ V, мВ/см |
3 |
|
см3 |
мВ |
мВ |
см3 |
|
|
|
0 |
|
|
|
|
|
|
1 |
|
|
|
|
|
|
2 |
|
|
|
|
|
|
і т. д. |
|
|
|
|
|
|
За експериментальними даними побудувати два графіки: інтегральну та диференціальну криві потенціометричного титрування, знайти еквівалентні точки та об’єм титранта і розрахувати концентрацію досліджуваного електроліту (див. рис. 12.2).
4. Підведення підсумків та зарахування теми
Заняття № 13
Тема. Фізико-хімія поверхневих явищ. Адсорбція на рухомій межі поділу фаз
1. Актуальність теми
Явища, які відбуваються у живих організмах у нормі і при патології характеризуються зміною величини поверхневого натягу. Отже, названа величина може використовуватися для оцінки стану профілактичної чи лікувальної роботи.
2.Навчальні цілі:
–робити висновки щодо поверхневої активності речовин на підставі їх будови;
–аналізувати особливості будови поверхневого шару адсорбованих молекул поверхнево-активних сполук, пояснювати принципи будови біологічних мембран;
–аналізувати рівняння адсорбції та межі їх використання, розрізняти мономолекулярну та полімолекулярну адсорбцію;
–інтерпретувати фізико-хімічні властивості білків, що є структурними компонентами всіх тканин організму.
43
3. Матеріали домашньої самостійної роботи
3.1. Засвоїти матеріал навчальної програми
Поверхневі явища та їх значення в біології та медицині. Поверхневий натяг рідин та розчинів. Ізотерма поверхневого натягу. Поверхнево-активні та поверхнево-неактивні речовини. Поверхнева активність. Правило ДюклоТраубе. Адсорбція на межі поділу рідина-газ та рідина-рідина. Рівняння Гіббса. Орієнтація молекул поверхнево-активних речовин у поверхневому шарі. Уявлення про структуру біологічних мембран.
3.2. Блок інформації
Величина поверхневого натягу належить до фізико-хімічних констант, а його зміна характеризує явище адсорбції, утворення та руйнування емульсій, функціонування мембран, стійкість та коагуляцію колоїдних розчинів, змочування , тощо.
Поверхнево-активні речовини (ПАР) – це основне джерело забруднення біосфери. Наявність дифільних молекул ПАР у природних водоймищах порушує кисневий режим, веде до знищення флори та фауни, змінює якість води. В зв’язку з цим для ПАР введено гранично допустиму концентрацію (ГДК) – 0,5 мг/л, а в промисловості дозволяється застосовувати тільки ті із них, які здатні розкладатись у природних умовах.
Вивчаючи |
дифільні молекули |
білків |
Давсон і Даніеллі |
(1935 р.) |
встановили, |
що подвійні шари |
ліпідів |
(ліпідний бішар) |
володіють |
властивостями, характерними для мембран живих клітин. Робертсон (1959 р.) довів тришаровість будови елементарної мембрани – центральний полярний шар складається із ліпідів, розміщених між двома шарами білків. Сінгер і Нікольсон (1972 р.) запропонували рідинно-мозаїчну модель мембрани, згідно якої білкові молекули плавають у рідкому ліпідному бішарі, утворюючи своєрідну мозаїку. Основою всіх цих припущень є полярність білкових молекул та наявність взаємодій на рухомих межах поділу фаз.
3.3.Література
1.Мороз А.С. , Луцевич Д.Д. , Яворська Л.П. Медична хімія (2-ге вид.).– Вінниця: Нова Книга, 2008.– С. 562–576.
2.Медицинская химия/ В.А. Калибабчук, Л.И. Грищенко, В.И. Галинская и др.; под ред. В.А. Калибабчук.– К.: Медицина, 2016.– С. 217–224.
3.Мороз А. С., Ковальова А.Г. Фізична та колоїдна хімія. – Львів: Світ, 1994. – С. 163-173.
4.Дулицкая Р.А., Фельдман Р.И. Практикум по физической и коллоидной химии. – М.: Высшая школа, 1978. – С. 246-248.
3.4.Матеріали для самоконтролю
а) Дати письмові відповіді на контрольні запитання
1.Що таке вільна поверхнева енергія та які причина її виникнення?
2.Що таке поверхневий натяг, одиниці виміру, фактори, які впливають на
44
його величину.
3.Навести ізотерми поверхневого натягу і адсорбції поверхнево-активних речовин на межі рідина– газ та дати їх пояснення.
4.Які речовини відносяться до поверхнево-активних (ПАР) і поверхневоінактивних (П-інАР). Навести приклади.
5.У чому особливості будови молекул ПАР?
6.Як орієнтуються молекули ПАР у поверхневому шарі вода– повітря; бензол– вода (подайте схему). Сформулюйте правило Дюкло-Траубе.
7.Що таке поверхнева активність, одиниці виміру, фактори, які впливають на її величину та зв’язок її з адсорбцією.
8.Що таке питома поверхня адсорбента (частинок дисперсної фази) та як її розрахувати.
9.За якою формулою вираховують площу, яку займає молекула ПАР у поверхневому шарі.
10.Як розрахувати товщину мономолекулярного шару ПАР?
11.Як побудовані біологічні мембрани.
б) Задачі для самоконтролю
Алгоритми розв’язання типових задач
Задача 1. Визначити величину і знак адсорбції при 10 °С розчину, який вміщує 50 мг/дм3 пеларгонової кислоти С8Н17СООН. Поверхневий натяг води 74,22·10–3 Дж/м2, досліджуваного розчину 57,0·10–3 .
Алгоритм розв’ язання
1. Адсорбцію на межі розчин– газ кількісно визначають за зміною поверхневого натягу, використовуючи рівняння Гіббса:
|
|
|
С |
σ 2 − σ1 |
|
С |
σ |
|
|
Г = - |
|
× C1 - C2 |
= - |
|
× DC |
|
|
RT |
RT |
||||
|
|
|
|
|
|
|
. |
де: σ |
– |
поверхневий натяг води, Дж/м2; |
|
||||
1 |
|
поверхневий натяг розчину, Дж/м2; |
|
||||
σ |
– |
|
|||||
2 |
– концентрація розчину ПАР відповідно, моль/дм3 ; |
||||||
С1 і С2 |
|||||||
R |
– |
універсальна газова стала, |
8,314 Дж/(моль·К); |
||||
Т– температура, К;
σ – зміна поверхневого натягу зі зміною концентрації
CПАР, Дж·м/моль
2.Визначити адсорбцію розчину:
Г = - |
50 |
|
× |
(57,0 - 74,22) ×10−3 |
= 7,32 ×10−6 моль/м2. |
8.314 × |
283 |
|
|||
|
50,0 - 0 |
|
|||
3. Оскільки σ2<σ1, то адсорбція Г>0 позитивна, а пеларгонова кислота – ПАР.
Задача 2. Вирахувати питому поверхню золю сульфіду арсену(III), середній діаметр частинок якого дорівнює 1·10–7 м, а густина – 3,43·10 3 кг/м3.
45
Алгоритм розв’ язання.:
1. Розрахувати радіус частинки:
r = d = 10−7 = 5 ×10−8 м.
22
2.Питома поверхня адсорбенту – це площа поверхні частинок (Sпит=4pr2) в одиниці об’єму (V = 4 πr 3 ) або одиниці маси (m) речовини. Приймаючи,
3
що частинки дисперсної фази мають сферичну форму одержуємо:
|
|
|
S |
|
|
|
4πr |
2 |
|
|
3 |
|
|
|
|
|
S |
|
|
S |
|
|
|
4πr |
2 |
|
3 |
|
|
м |
2 |
|
|||||
Sпит |
= |
= |
|
|
|
= |
[м-1 ] |
або Sпит |
= |
|
= |
|
|
= |
|
|
|
|
|
|
= |
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
4 |
|
|
|
|
rρ |
|
|
|||||||||||||||||||
|
4 |
|
|
|
|
|
|
|
|
|
|
|
кг |
||||||||||||||||||||||||
|
|
V |
|
πr 3 |
|
r |
|
|
|
|
|
m Vρ |
|
|
πr 3 × ρ |
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
3. Розрахувати питому поверхню: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
3 |
|
|
|
|
|
|
|
|
7 |
|
–1 |
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
7 |
|
м2 |
|
||||||
Sпит = |
|
|
|
|
|
|
= 6,7 |
×10 |
|
м |
|
або Sпит = |
|
|
|
|
|
|
|
|
|
|
|
= 1,75 ×10 |
|
|
|
|
|
. |
|||||||
5 ×10 |
−8 |
|
|
|
5 ×10 |
−8 |
× 3,43 |
×10 |
3 |
|
|
кг |
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
в) Задачі для самостійного розв’язання
1.Визначити поверхневий натяг аніліну на межі з повітрям при 292 К, якщо методом найбільшого тиску бульбашок одержано такі результати: тиск бульбашки при прориву плівки води дорівнює 11,82·102 Дж/м2, а у аніліну
– 711,5 Дж/м2. Поверхневий натяг води s0=72,55·10–3 Дж/м2.
Відповідь: 43,67·10–3 Дж/м2.
2. Визначити питому поверхню суспензії каоліну (r=1,8·10–3 кг/м3), якщо її частинки вважати кулястої форми з середнім діаметром 0,5·10–6 м. Суспензію вважати монодисперсною.
Відповідь: 4,8·103 м2/кг
3.Визначити величину і знак адсорбції (моль/м2) для розчину хлориду кальцію з концентрацією 20 % при 293 К, якщо поверхневий натяг цього
розчину дорівнює 80·10–3 Дж/м2, води 73·10–3 Дж/м2, густина розчину дорівнює 1,177 г/см3.
Відповідь: –2,86·10 –6 моль/м2.
4.Визначити величину і знак адсорбції при 15 оС для водного розчину, що містить 49 г/дм3 ацетону, якщо поверхневий натяг цього розчину дорівнює 59,4·10–3 Дж/м2. Поверхневий натяг води при тій же температурі 73,49·10–3
Дж/м2. Густина розчину 0,990 г/см3.
Відповідь: 5,8·10–6 моль/м2.
5.Для водних розчинів капронової кислоти з концентрацією 0,005 та 0,01 моль/дм3 при 273 К поверхневий натяг відповідно дорівнює 65,8·10–3 і 60,05·10–3 Дж/м2. Вирахувати величину адсорбції в моль/м2.
Відповідь: 3,82·10–6 моль/м2.
46
4. Матеріал для авдиторної роботи
4.1. Перелік практичних завдань, які необхідно виконати на практичному
занятті:
– навчитися визначати поверхневий натяг на межі рідина– газ за методом Ребіндера;
– навчитися вираховувати величину адсорбції за рівнянням Гіббса.
4.2. Методика виконання практичних завдань
4.2.1. Вивчення впливу концентрації спирту на поверхневий натяг розчинів Для визначення поверхневого натягу за методом Ребіндера необхідно
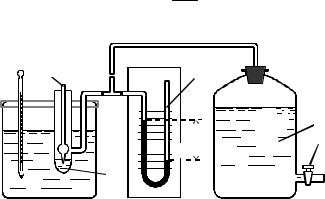
знайти постійну «К» для капіляра приладу (рис. 5.1). Метод Ребіндера (метод максимального тиску бульбашок) полягає у наступному:
1.Посудину 2 (рис. 131) заповнюють дистильованою водою, попередньо добре промивши капіляр 1.
2.Посудину 2 щільно закривають корком із вставленим в нього капіляром 2. При цьому кінець капіляра повинен тільки змочуватись меніском рідини.
3.Посудину 2 термостатують, з’єднують з манометром 3 та аспіратором 4.
4.Відкривають кран 5 і поступово виливають воду з аспіратора. При цьому у посудині 2 виникає розрідження, при якому крізь рідину (розчин) проскакує бульбашка повітря. Бульбашка повинна відриватись від капіляра 1 рівномірно, приблизно кожні 10 с.
5.Тиск Р дорівнює різниці між тиском зовнішнім (атмосферним) і тиском у посудині 2, та пропорційний поверхневому натягу σ=КР, де: К – постійна для даного капіляра величина.
6.Оскільки для води є табличні дані з поверхневого натягу при різних
температурах (див. табл. 9 додатку), постійну К визначають з її допомогою за рівнянням:
К= σН2О . РН2О
1
|
|
|
|
|
|
|
50 |
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
40 |
|
|
|
|
|||
|
|
|
|
|
|
|
30 |
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
20 |
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
|
0 |
|
|||
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
20 |
|
|
|
|
|
2 |
|
|
|
|
|
|
|
30 |
||
|
|
|
|
|
|
|
|
|
|
|
50 |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
40 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
h |
4 |
||||||||||||||||||
5 |
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рис. 13.1 Схема приладу Ребіндера
47

7. Розрахунок поверхневого натягу розчинів проводять згідно з рівнянь:
s = К·Р або σ = σН2 О × |
Рр−ну |
. |
|
Р |
|
|
|
|
Н2 |
О |
|
8.Для виконання завдання лабораторної роботи необхідно визначити методом Ребіндера поверхневий натяг 4-х розчинів спирту (ізоамілового або ізобутилового) з різною концентрацією, починаючи з розчину з найменшою концентрацією. Визначення різниці рівня рідини у трубках манометра 3 проводять для кожного розчину не менш 3-х разів. Одержані експериментальні дані заносять у таблицю 13.1.
|
|
|
|
Таблиця 13.1 |
|
|
|
Концентрація |
Різниця рівнів Р за |
Поверхневий натяг |
|
Речовина |
спирту С, |
|
|||
|
2 |
|
|||
|
|
моль/дм3 |
маномнтром, мм |
σ, Дж/м |
|
1. |
Вода |
0,00 |
|
|
|
2. |
Спирт |
0,025 |
|
|
|
3. |
Спирт |
0,050 |
|
|
|
4. |
Спирт |
0,10 |
|
|
|
5. |
Спирт |
0,20 |
|
|
|
9. Поверхневу активність g = dσ розраховують методом найменших різниць
|
dσ |
dC |
Dσ . |
|
замінюючи |
малими змінами |
|||
dC |
||||
|
|
DC |
10.За рівнянням Гіббса визначають величину адсорбції спирту на межі поділу фаз розчин– повітря
Г = - Сcp × Dσ
RT DC
11.За одержаними експериментальними даними будують ізотерму адсорбції в координатах: вісь ординат – Г (моль/м2), вісь абсцис – концентрація спирту С (моль/дм3).
12.Зробити висновок про залежність величини адсорбції на межі рідина– газ від концентрації речовину.
4.2.2.Вивчення впливу довжини радикалу в молекулі ПАР на поверхневу активність
1.Визначити К для капіляра приладу Ребіндера, як описано в попередньому завданні (п. 4.2.1.)
2.Визначити поверхневий натяг розчинів спиртів гомологічного ряду
(СН3ОН, С2Н5ОН, С3Н7ОН, С4Н9ОН, С5Н11ОН) з концентрацією 0,1 моль/дм3.
3.Побудувати графік в координатах: вісь абсцис – число атомів карбону, вісь ординат – поверхневий натяг (Дж/м2).
48
4.Розрахувати: на скільки збільшується Δσ при зростанні довжини радикалу. Чи виконується правило Дюкло– Траубе?
5.Підведення підсумків та зарахування роботи
Заняття № 14
Тема: Адсорбція на нерухомій поверхні поділу. Сорбція біологічно-активних речовин. Основи адсорбційної терапії. Іонний обмін. Хроматографія
1. Актуальність теми
Адсорбція різних речовин форменими елементами крові та протоплазмою клітин впливає на обмін речовин, тому при лікуванні гострих отруєнь вагоме значення мають адсорбційна терапія і гемосорбція. Створення імуносорбентів дає можливість виводити з організму антитіла, бактеріальні токсини та інші антигени. При лікуванні мікробних інтоксикацій застосовують імуносорбенти. Для виведення із організму важких металів та радіонуклідів призначають алюмагелі.
Йонообмінна адсорбція лежить в основі сучасних методів пом’якшення та знесолення води, виділення солей із молока, очистки різних лікарських препаратів, пепсину, антитіл, вітамінів, антибіотиків, алкалоїдів. За допомогою катіонітів виділяють йони Са2+ із плазми крові перед консервацією, розділяють пуринові та піримідинові основи. Йоніти застосовують для визначення кислотності шлункового соку, регулювання йонного середовища у шлунково-кишковому тракті, зв’язування токсинів і отруйних речовин. Функціонування біологічних мембран й еритроцитів крові також пов’язане з йонообміном. Він використовується для вилучення деяких забруднень із навколишнього середовища, а також у хроматографії.
Хроматографія, як метод розділення сумішей (М.С.Цвіт, 1903 р.), зазнала бурхливого розвитку в останні десятиріччя і широко використовується для розділенні газів, рідин і розчинених твердих речовин. Хроматографія стала лідером в аналізі складних органічних і неорганічних об’єктів у медицині, біології та навколишньому середовищі.
2. Навчальні цілі:
–інтерпретувати закономірності адсорбції речовин з розчинів на твердій поверхні;
–пояснити фізико-хімічні основи методів адсорбційної терапії;
–розрізняти вибіркову та йонообмінну адсорбцію електролітів;
–інтерпретувати методи хроматографічного аналізу та їх роль в медикобіологічних дослідженнях.
49
3. Матеріали доаудиторної самостійної роботи
3.1. Засвоїти матеріал навчальної програми
Адсорбція на межі поділу тверде тіло-газ. Рівняння Ленгмюра. Адсорбція із розчину на поверхні твердого тіла. Фізична та хімічна адсорбція. Закономірності адсорбції розчинених речовин, парів та газів. Рівняння Фрейндліха.
Фізико-хімічні основи адсорбційної терапії (гемосорбція, плазмосорбція, лімфосорбція, ентеросорбція, аплікаційна терапія). Імуносорбенти.
Адсорбція електролітів: специфічна (вибірна) та йонообмінна. Правило Панета-Фаянса. Йонообмінники природні та синтетичні. Роль адсорбції та йонного обміну в процесах життєдіяльності рослин і організмів.
Хроматографія. Класифікація хроматографічних методів аналізу за ознакою агрегатного стану фаз, техніки виконання та механізму розподілу. Адсорбційна, йонообмінна та розподільча хроматографія. Застосування хроматографії в біології та медицині.
3.2. Блок інформації
Адсорбція речовин елементами крові і протоплазмою клітин впливає на обмін речовин, тому важливе значення, зокрема при лікуванні гострих отруєнь, належить адсорбційній терапії і гемосорбції. Метод гемосорбції, який базується на перфузії крові через різні типи вугільних та синтетичних високо селективних сорбентів або йоннообмінних смол, використовують для вилучення токсичних речовини, які мають імунномодулюючий вплив на імунну систему організму.
В медичній практиці широко, поряд з активованим вугіллям, сферичним картбонітом, кокосовим активованим вугілля, сферичним вуглецевим сорбентом, активованими вуглецевими волокнами (ентеросорбція – сорбційні процеси у кишківнику), використовують імуносорбенти, які здатні вилучати із організму антитіла, бактеріальні токсини і інші антигени, наприклад, при лікуванні мікробних інтоксикацій, правця, газової гангрени, алергії.
При лімфосорбції лімфу пропускають через сорбенти і при цьому усувається безпосередній контакт формених елементів крові з сорбентом Аплікаційна терапія передбачає використання паст, мазей і інших композицій для лікування ушкоджених ділянок тіла завдяки сорбційним явищам.
Про явище йонообміну вперше повідомив англійський агрохімік Г.Томпсон у 1850 році. Йонообмінники (йоніти) – це вид адсорбентів, які можуть поглинати не цілі молекули, а тільки йони електроліту з розчину. Одні з них (катіоніти) обмінюють лише катіони(свої на катіони з розчину), а інші (аніоніти) – лише аніони. Відомі також двополярні йоніти (амфоліти), що містять різнополярні групи: одна з яких буде обмінювати лише катіони, а друга – аніони.
Природними катіонітами є цеоліти (кристалічні пористі алюмосилікати),
глини, грунти, а природними аніонітами – |
апатити [Ca5(PO4)3]F. До |
синтетичних катіонітів належать різні типи |
цеолітів (загальна формула |
50 |
|
