
Методичні вказівки 2
.pdfб) Одержання золю сірки.
У пробірку налити 5 см3 дистильованої води і при перемішуванні додати 0,5 см3 насиченого спиртового розчину сірки. Що спостерігається?
4.2.2. Одержання золів методом хімічної конденсації а) Одержання золю йодиду аргентуму за реакцією подвійного обміну.
До 100 см3 0,002 М розчину КІ додати при перемішуванні 1 см3 0,01 М розчину AgNO3. Відмітити забарвлення золю і написати будову міцели (надмір КІ). Який заряд гранули?
Написати будову міцели AgI, одержаного при надлишку AgNO3.
б) Одержання золів берлінської блакиті з різними зарядами гранул. Приготувати у двох пробірках золі берлінської блакиті з 0,005 М розчину
FeCl3 і 0,005 М розчину K4[Fe(CN)6] у таких співвідношеннях:
1)3 см3 розчину FeCl3 і 1 см3 розчину K4[Fe(CN)6];
2)3 см3 розчину K4[Fe(CN)6] і 1 см3 розчину FeCl3.
Написати рівняння реакції і будову міцели для обох золів. Від чого залежить заряд гранули?
в) Одержання золю гідроксиду феруму (ІІІ) за реакцією гідролізу.
Нагріти в колбочці до кипіння 50 см3 дистильованої води. Додати в киплячу воду краплями 5% розчин FeCl3. Що спостерігається? Записати рівняння хімічних реакцій і будову міцели одержаного золю.
г) Одержання золю гексаціано(ІІ)ферату купруму за реакцією подвійного обміну.
До 5 см3 1 % розчину CuSO4 додати декілька крапель 0,01 % розчину K4[Fe(CN)6]. Записати рівняння реакції та будову міцели одержаного золю. Написати будову міцели золю, одержаного при надмірі K4[Fe(CN)6].
г) Одержання золю кремнієвої кислоти.
До 5 см3 5 % розчину Na2SiO3 додати при перемішуванні 0,5 см3 0,1 М розчину HCl. Яка будова міцели одержаного золю?
д) Одержання золю металічного срібла за реакцією відновлення.
До 10 см3 0,001 М розчину AgNO3 додати 2–3 краплі 1 % розчину K2CO3 і 1 см3 свіжовиготовленого розчину таніну (альдегід), нагріти. Утворюється жовто-коричневий золь металічного срібла.
AgNO3 + K2CO3 = AgOK + KNO3 + CO2
стабілізатор
2AgOK + R–COH + H 2O = 2Ag↓ + R–COOH + 2KOH
Написати будову міцели одержаного золю і зробити висновок про метод його одержання.
е) Одержання золю діоксиду мангану за допомогою окисно-відновної реакції.
У колбу з 25 см3 0,1 М розчину KMnO4 додавати з бюретки невеликими
71
порціями 10 % розчин H2O2 до тих пір, поки взята скляною паличкою і нанесена на фільтрувальний папір крапля розчину не перестане забарвлювати папір у рожевий колір. Записати будову міцели золю.
ж) Одержання золю сульфіду плюмбуму.
До 3 см3 1 % розчину Pb(CH3COO)2 додати краплями 3 см3 5 % розчину Na2S. Записати спостереження, рівняння реакції і будову міцели одержаного золю. Яка будова міцели золю PbS, одержаного при надмірі Pb(CH3COO)2?
4.2.3. Одержання золів методом пептизації а) Одержання золю Fe(OH)3.
Одержати осад Fe(OH)3 при взаємодії FeCl3 з NH4OH. Для цього 1 см3 насиченого розчину FeCl3 розвести водою до 20 см3. До одержаного розчину повільно додавати 5 % розчин NH4OH до знебарвлення рідини над осадом. Написати рівняння реакції. Відмітити колір осаду.
Рідину над осадом злити і декілька разів промити дистильованою водою (декантація). Промитий осад розділити у 3 пробірки і додати:
уІ – 10 см3 дистильованої води;
уІІ – 10 см3 2 % розчину FeCl3;
уІІІ – 10 см3 0,02 М розчину HCl.
Через 10 хвилин записати спостереження. Пояснити, що відбулося з осадом у ІІ і ІІІ пробірках? Який тип і механізм пептизації? Написати будову міцел одержаних золів.
б) Одержання золю берлінської блакиті.
До 5 см3 2 % розчину FeCl3 додати 1 см3 насиченого розчину K4[Fe(CN)6]. Осад відфільтрувати і промити дистильованою водою. Після промивання осаду на фільтрі 0,1 М розчином оксалатної кислоти (Н2С2О4) фільтрується синій золь берлінської блакиті. Записати рівняння реакції та будову міцели золю, враховуючи, що осад пептизується оксалатною кислотою за рахунок адсорбції йонів С2О42– .
4.2.4. Визначення знаку заряду колоїдних частинок лікарських засобів У забарвлених золях знак заряду частинок можна визначити методом
капілярного аналізу. Він оснований на тому, що целюлозні стінки капілярів фільтрувального паперу заряджені негативно, а вода, що просочує папір, – позитивно. На клапоть фільтрувального паперу нанести краплю досліджуваного золю. Після всмоктування краплі золь із позитивно зарядженими частинками адсорбується на папері і дає забарвлену в центрі і безбарвну по краях пляму; золь із негативно зарядженими частинками не адсорбується папером і утворює рівномірно забарвлену пляму.
4.2.5 . Визначити знак заряду гранул та величину дзета-потенціалу лікарського засобу (гідрофобного золю, за вказівкою викладача: протарголу або коларголу).
72
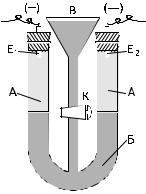
1)У прилад для електрофорезу (рис. 15.1), що закріплений у штативі, налити в коліно А (див. малюнок) проміжної рідини для заданого золю до рівня на 3–5 мм вище від верхнього зрізу крана К. Кран при цьому повинен бути відкритий, щоб через нього виходило повітря.
2)Закрити кран К і в обидва коліна вставити електроди Е, але не затискати корки, щоб з-під них могла потім витікати рідина.
3)Налити заданого золю через лійку В доверху.
Рис 15.1 Схема приладу для електрофорезу:
А – проміжна рідина; Б – золь; В – лійка; Е і Е – електроди; К – кран.
4)За допомогою дротинки прочистити нижній кінець трубки під лійкою В та видалити можливі бульбашки повітря.
5)Злегка відкрити кран К, щоб золь з лійки повільно витікав в низ U- подібної трубки та в обох колінах сформувати чітку межу між золем і проміжною рідиною, яка легша за нього.
6)Додавши в лійку ще трохи золю, вивести межу поділу між ними і проміжною рідиною напроти цифрових поділок на шкалі Ш.
7)Закрити кран К і записати положення межі золю в обох колінах відповідно до шкал Ш (вони можуть не співпадати).
8)Ввімкнути струм. Коли стрілка вольтметра покаже напругу між електродами, відзначити на годиннику час початку електрофорезу.
9)Записати величину напруги Е за прямими показами вольтметра, або розрахувати її, якщо шкала цього приладу має умовні поділки. При цьому звернути увагу, яка саме напруга (300, 450 В чи інша) подається від випрямляча на електрофорез та на якій саме поділці зупинилася стрілка вольтметра.
10)Закінчити електрофорез, вимкнути струм через 5–10 хв (коли межа золю в коліні опуститься на 5–7 мм – шкала Ш). Записати час закінчення електрофорезу та визначити тривалість проходження струму t.
11)За різницею положень межі золю визначити зміщення частинок золю (S). Відзначити, в якому напрямку, до якого електрода зміщувалась межа золю при електрофорезі. Зробити висновок про знак заряду на гранулах
73
дослідженого колоїдного розчину.
12)Після вимкнення струму виміряти за допомогою нитки та лінійки відстань l між електродами (за ходом струму в U-подібній трубці.
13)Вилити розчин з U-подібної трубки, сполоснути її водою.
14)Коротко описати хід виконаної роботи й обчислити результати.
15)Перевести усі виміряні величини у систему СІ, підставити їх у формулу Гельмгольца-Смолуховського для обчислення z-потенціалу:
ζ = |
η × l × S |
|
|
τ × D × E ×ε |
. |
|
|
Крім уже згаданих величин 1 (м), S (м), t (с), Е (В), |
взяти в’язкість |
||
η = 10–3 Па×с та діелектричну константу D = 81 для |
води, а також |
||
абсолютну діелектричну проникність вакууму ε = 8,85×10–12 Ф/м.
16)Перерахувати одержане значення z у вольтах на мілівольти (мВ).
17)Зробити висновок про знак заряду гранул для дослідженого золю та вказати, чи він стійкий, порівнявши одержане значення дзета-потенціалу з критичним значенням (30 мВ).
4.2.6. Визначення порогів коагуляції гідроксиду феруму (ІІІ)
Золь гідроксиду заліза Fe(OH)3 виготовлений з позитивним зарядом гранул. Запишіть будову його міцели, якщо золь утворився при гідролізі солі
FeCl3.
Для коагуляції золю Fe(OH)3 використовують електроліти з аніонами різної валентності, наприклад KCl, K2SO4, K3PO4 або K3[Fe(CN)6] із відповідними концентраціями в моль/л: 2,5; 0,1; 0,01. Пояснити чому?
У три пробірки відміряти піпеткою по 5,0 см3 названого викладачем золю і методом титрування додавати з бюретки краплинами при інтенсивному помішуванні одного із трьох розчинів електролітів до перших ознак коагуляції: помутніння розчину, зміни забарвлення (потемніння), випадання осаду. Одержані дані занести в таблицю 6.1.
Таблиця 6.1
№ |
|
Концентрація |
Коагулюючий |
Об’єм розчину |
Поріг |
|||
Формула |
коагуляції |
|||||||
про- |
електроліту С, |
йон |
електроліту V, |
|||||
|
C ×V |
|
||||||
електроліту |
|
|
||||||
бірки |
моль/л |
та його заряд |
см3 |
П = |
|
|||
|
||||||||
|
|
|
|
|
Vз + V |
|||
1. |
|
|
|
|
|
|
|
|
2. |
|
|
|
|
|
|
|
|
3. |
|
|
|
|
|
|
|
|
Зробити висновок із одержаних даних: який йон і електроліт мають найбільшу коагулюючу дію. Поясніть, чому. Розрахуйте відношення порогів коагуляції для йонів різного заряду.
4.2.7.Визначення порогів коагуляції для золів із від’ємним зарядом гранул (золь срібла, MnO2, коларгол та інші)
74
Запишіть будову міцели відповідного золю, якщо він одержаний при надлишку відповідних електролітів K[Ag(OH)2], KMnO4, K[AgO] та ін.
Для коагуляції золю необхідно використати розчини кожної із солей, що містять катіони різної валентності (NaCl, BaCl2, AlCl3) у порядку зменшення концентрацій.
У три пробірки набрати піпеткою по 5,0 см3 заданого золю і титрувати кожну пробірку одним із трьох електролітів із бюретки до появи перших ознак коагуляції. Дослід провести аналогічно попередньому, скласти відповідну таблицю і зробити висновок.
4.2.8. Перевірка захисної дії ВМC при коагуляції гідрофобного золю
У 4 пробірки відміряти піпеткою по 2,0 см3 золю, вказаного викладачем (Fe(OH)3). Для коагуляції взяти дві пробірки, вибрати відповідні два електроліти з дво- і тризарядними йонами, титрувати з бюретки кожну пробірку різним розчином. У третю і четверту пробірки додати спочатку по 1,0 см3 0,5 % розчину ВМC (желатини, крохмалю тощо) й аналогічно провести коагуляцію тими ж електролітами, що і в перших двох пробірках. Порівняти кількості витрачених розчинів. Результати записати в таблицю 6.2.
Таблиця 6.2
|
Концентрація |
Витрачено на коагуляцію |
Поріг коагуляції |
|||
Формула |
розчину |
V, см3 |
|
П, ммоль/л |
||
електроліту |
електроліту |
без ВМР |
|
з ВМР |
без ВМР |
з ВМР |
|
С, моль/л |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Розрахувати пороги (П) коагуляції за формулою:
П = |
|
C ×V1 |
|
|
+VВМС |
+V1 |
|
Vзолю |
|||
де: С – концентрація електроліту, ммоль/л;
Vзолю; VВМР; V – об’єми розчинів золю, ВМC і електроліту відповідно, см3.
Як пояснити, що на коагуляцію золю в присутності ВМР витратилося більше електроліту? Поясніть цю відмінність за допомогою умовної схемималюнка: гранула + коагулюючі йони.
4.2.9. Взаємна коагуляція золів
Налити в пробірку 2,0 см3 золю Fe(OH)3 з позитивним зарядом гранул (запишіть будову міцели, якщо стабілізатором є FeCl3). В пробірку додати 2,0 см3 золю берлінської блакиті з від’ємним зарядом гранул. Складіть формулу міцели, якщо стабілізатор – K 4[Fe(CN)6]. Що спостерігається після змішування двох золів? Дайте пояснення цим явищам.
75
5. Підведення підсумків та зарахування теми
Заняття № 16
Тема: Властивості розчинів біополімерів
1. Актуальність теми
До високомолекулярних сполук (ВМР) належать як природні, що становлять основу всієї живої матерії, так і синтетичні сполуки, молекулярна маса яких сягає кількох мільйонів. Синтетичні полімери широко застосовуються в народному господарстві, зокрема медицині, для виготовлення протезів, судин, суглобів, серцевих клапанів, кришталиків ока, різних тканин. Волокна із синтетичних полімерів використовуються як шовний матеріал у хірургічній практиці. У фармації полімери використовують для виготовлення оболонок капсул, у які поміщують лікарські речовини, як покриття і складові частини таблеток та як допоміжні речовини для створення мазей і пластирів.
Багато ВМР проявляє біологічну активність і застосовуються як замінники плазми крові (полівінілпіролідон, полівінол), при лікуванні опіків (полівінілбутанол), як пролонгатори дії ліків (похідні целюлози, поліетиленгліколі, полікислоти), для стабілізації лікарських колоїдних препаратів, суспензій та емульсій.
Знайомство з суттю явищ набрякання і желатинування сприяє кращому розумінню багатьох фізіологічних процесів: запалення, утворення набряків, регенерації тканин та ін.
Високомолекулярні речовини (ВМР) із живої природи називаються біологічними або біополімерами. Біополімери (білки, вуглеводи, нуклеїнові кислоти) утворюються у процесі біосинтезу в клітинах і є важливими складовими частинами всіх живих організмів.
Синтетичні полімери широко застосовуються в медицині для виготовлення протезів судин, суглобів, серцевих клапанів, кришталиків ока, як шовний матеріал у хірургічній практиці. Розчини ВМР відіграють суттєву роль при дослідженні деяких властивостей макромолекул, а також у практичному застосуванні полімерів. У медичній практиці розчини деяких полімерів використовуються як плазмозамінники, що тимчасово виконують роль крові як своєрідного “ рідкого органу”. Ряд розчинів полімерів використовують для пролонгованої дії лікарських речовин. Наприклад, препарат йодинол – 1 % водний розчин йодного комплексу з полівініловим спиртом – має високу бактерицидну активність і знайшов широке застосування в медицині та ветеринарії. Ряд полімерів у медичній практиці застосовуються у вигляді гелів.
76
Вивчення структури та властивостей біополімерів, процесів набрякання і желатинування сприяє кращому розумінню найважливіших біологічних процесів, що протікають на клітинному та молекулярному рівнях.
2. Навчальні цілі:
–знати основні методи одержання ВМР;
–знати будову молекул природних і синтетичних ВМР;
–вміти експериментально визначати ступінь набрякання ВМР;
–вміти передбачити вплив електролітів на ступінь набрякання ВМР та біологічних тканин живого організму;
–засвоїти основні властивості поліелектролітів;
–вміти експериментально визначати ізоелектричну точку (ІЕТ) поліелектролітів за набряканням та знати вплив різних факторів на процес набрякання;
–навчитись визначати ІЕТ поліелектролітів за в’язкістю та осіданням.
Матеріал доаудиторної самостійної роботи
3.1. Засвоїти матеріал навчальної програми
Високомолекулярні сполуки - основа живих організмів. Глобулярна та фібрилярна структура білків. Порівняльна характеристика розчинів високомолекулярних сполук, істинних та колоїдних розчинів.
Набухання та розчинення полімерів. Механізм набухання. Вплив рН середовища, температури та електролітів на набухання. Роль набухання в фізіології організму. Драглювання розчинів ВМС. Механізм драглювання. Вплив рН середовища, температури та електролітів на швидкість драглювання. Тиксотропія. Синерезис. Дифузія в драглях. Висолювання біополімерів з розчинів. Коацервація та її роль у біологічних системах.
Аномальна в’язкість розчинів ВМС. В’язкість крові. Мембранна рівновага Доннана.
Ізоелектричний стан білка. Ізоелектрична точка та методи її визначення. Іонний стан біополімерів в водних розчинах.
3.2. Блок інформації
Високомолекулярні сполуки (ВМР) або полімери – це речовини, відносна молекулярна маса яких становить від десятків тисяч до декількох мільйонів одиниць маси. ВМР мають гігантські молекули, які складаються з великої кількості окремих груп атомів, т.з. ланок, пов’язаних між собою ковалентними хімічними зв’язками.
ВМР можна розділити на природні – білки, вуглеводи, РНК і синтетичні – поліхлорвініл, капрон, лавсан, поліетилен та інші. Одержати синтетичні ВМР можна за допомогою реакцій полімеризації та поліконденсації.
Розчини ВМР називають гідрофільними золями і відносять до колоїдів завдяки спільності багатьох властивостей. Вони мають однакові з гетерозолями розміри частинок 10–8 – 10 –9 м, невеликі швидкості дифузії, утворюють невисокий осмотичний тиск, проявляють здатність до коагуляції. І
77
все ж це дещо особливі розчини, які утворюються при звичайному розчиненні, є стійкими, а процеси утворення цих розчинів і навпаки – виділення ВМР із розчину – є зворотними.
Розчинення ВМР відбувається самочинно через стадію набрякання, яке у випадку необмеженого набрякання призводить до утворення розчину. Розчинення ВМР можливе лише у споріднених розчинниках, тому їх називають ліофільними золями. Гідрофільні полімери розчиняються у воді, а олеофільні – у вуглеводнях (желатина розчиняється у воді, а каучук – у бензолі). Процесові розчинення ВМР передує процес набрякання – проникнення молекул розчинника до складної структури молекули полімеру. Розрізняють набрякання обмежене, в результаті якого утворюється сольватний комплекс (гель). Необмежене набрякання закінчується розчиненням ВМР і утворенням ліофільного золю, колоїдного розчину.
Кількісною характеристикою набрякання вважається ступінь набрякання (a), який вказує на відносне збільшення маси полімеру до і після процесу
набрякання: |
α = |
m − m0 |
× 100%. Ступінь набрякання може змінюватись у |
|
|||
|
|
m0 |
|
широкому діапазоні й досягати величин понад 100 % – 200 % ..
На ступінь набрякання впливають різні фактори: природа полімеру і розчинника, температура, додавання електроліту та рН середовища. Останній фактор особливо впливає на поліелектроліти. Вплив електролітів полягає у тому, що деякі аніони змінюють структуру води, дисперизуючи її і цим сприяють перебігові набрякання. До таких йонів належать CNS– > KBr– ... I– > NO3– > Cl– . У той же час інші йони (SO42– > CH3COO– > C2O42– ) наближують структуру води до структури льоду і цим затримують набрякання. У цілому ліотропний ряд Гофмайстера можна подати так:
CNS– > I– > KBr– > NO3– > Cl– > CH3COO– > SO42– .
Розчини ВМР мають біологічне значення та медичне застосування. Так, кров, лімфа та клітинні соки сприяють процесам обміну речовин в організмі. Розчини реополіглюкіну, гемодезу та неогемодезу використовуються як кровозамінники.
Поліелектролітами називають ВМР, що містять йоногенні групи, здатні в розчинах розпадатись на йони. За характером утворюваних йонів поліелектроліти розподіляють на три категорії:
–поліелектроліти, що містять кислотні групи (– СОО– , –SO 3– );
–поліелектроліти, які містять основні групи (–NH 3+);
–поліелектроліти, що містять одночасно як кислотну, так і основну групи. Такі поліелектроліти називаються поліамфолітами.
Білки є важливими представниками поліелектролітів, що містять у
бокових ланцюгах амінокислот багато кислотних і основних функціональних груп. Амінокислоти у водних розчинах містяться у формі біполярних йонів:
H2N–R–COOH +H3N–R–COO – .
78
У кислому середовищі, коли внаслідок надлишку йонів Н+ зменшується йонізація карбоксильних груп, молекула білка веде себе, як основа і набуває додатного заряду:
+H3N–R–COO – + H+ +H3N–R–COOH.
У лужному середовищі, навпаки, зменшується йонізація аміногруп, молекула білка поводиться як кислота і набуває від’ємного заряду:
+H3N–R–COO – + OH– H2N–R–COO – + H2O.
Таким чином, заряд білка залежить від співвідношення у його молекулах карбоксильних та амінних груп, а також від рН середовища. Якщо при йонізації на поверхні білка виникає однакова кількість додатних і від’ємних зарядів, тобто сума електричних зарядів дорівнює нулю (ζ = 0), то такий стан білка називається ізоелектричним (ІЕС). Значення рН розчину, при якому білок перебуває в ізоелектричному стані, називають ізоелектричною точкою (рНІЕТ). При цьому значенні рН протилежно заряджені групи –NH 3+ і – СОО– притягуються одна до одної, і молекула закручується у спіраль, згортаючись у клубок. У зарядженому стані ланцюги білків мають витягнуту форму внаслідок відштовхування однойменно заряджених груп.
В ізоелектричній точці набрякання мінімальне, оскільки ступінь гідратації йоногенних груп найменша. Зміна рН у кислу або лужну ділянку відносно ізоелектричної точки призводить до зростання ступеня набрякання. Це пояснюється тим, що поява електричного заряду посилює ступінь гідратації макромолекул, а також збільшує сили електростатичного відштовхування між ними. Саме різким зменшенням рН і набряканням живої тканини за рахунок сусідніх ділянок пояснюють виникнення набряків при укусах комарів, бджіл, мурашок.
Значення ІЕТ білків залежить від переважання в його молекулах моноамінодикарбонових чи діаміномонокарбонових кислот. Більшість природних білків містять значні кількості дикарбонових амінокислот (глютамінової, аспарагінової) і тому належать до кислих білків, тобто їх ІЕТ лежить у кислій ділянці рН. Невелика група основних білків, у молекулах яких переважають вільні групи –NH 2 за рахунок підвищеного вмісту діамінових амінокислот (лізину, аргініну, та ін.).
3.3.Література
1.Медична хімія: підручник/В.О. Калібабчук, І.С. Чекман, В.І. Галинська та ін.; за ред. проф. В.О. Калібабчук.– К.: ВСВ «Медицина», 2013.– С. 257–275.
2.Мороз А.С. , Луцевич Д.Д. , Яворська Л.П. Медична хімія (2-ге вид.).– Вінниця: Нова Книга, 2008.– С. 676–729.
3.Медицинская химия/ В.А. Калибабчук, Л.И. Грищенко, В.И. Галинская и др.; под ред. В.А. Калибабчук.– К.: Медицина, 2016.– С. 318–341.
4.Мороз А.С., Ковальова А.Г. Фізична та колоїдна хімія. – Львів, 1994. –
С.231-248.
5.Красовский И.В., Вайль Е.И., Безуглый В.Д. Физическая и коллоидная
79
химия, – Київ: Вища школа, 1983. – С. 325-329.5.
3.4. Матеріали для самоконтролю
а) Дати письмові відповіді на контрольні питання
1.Дайте визначення поняттям ВМР, гель, набрякання, желатинування.
2.Якими методами можна одержати ВМР та розчини ВМР? Навести приклади.
3.Спільні і відмінні властивості розчинів ВМР від справжніх розчинів і ліофобних золів.
4.Набрякання і розчинення полімерів. Механізм і стадії набрякання. Типи набрякання.
5.Ступінь набрякання. Представити графік залежності ступеня набрякання від часу для обмеженого і необмеженого набрякання.
6.Пояснити вплив природи електролітів на ступінь набрякання. Ліотропний ряд Гофмайстера.
7.Показати роль явища набрякання у фізіології рослин і тварин.
8.Що таке драглювання полімерів та які фактори впливають на утворення драглів?
9.Що таке онкотичний тиск плазми крові?
10.Поліелектроліти. Амфотерність білків. Заряд білкової молекули в залежності від рН середовища.
11.Ізоелектричний стан білка. Ізоелектрична точка та методи її визначення. Від чого залежить рНІЕТ білка?
12.Властивості розчинів ВМР (в’язкість, осмотичний тиск, тиксотропія, пластифікація і утворення драглів).
13.Порушення стійкості розчинів ВМР. Суть процесу висолювання. Фактори, які впливають на явище висолювання білків. Розмістити аніони в порядку
зростання їх висолювальної дії: CH3COO– , Cl– , I– , SO42– , SCN– , NO3– . Від чого залежить їх висолювальна дія?
14.Біологічне значення полімерів. Значення та застосування розчинів ВМР у
медичній та фармацевтичній практиці.
б) Алгоритми розв’ язування типових задач
Задача 1. Зразок натурального каучуку об’ємом 1,094×10–4 м3 (V0) помістили в сірковуглець. Через 48 год. витримування при 293 К об’єм зразка став 9,204×10–4 м3 (V). Вирахувати ступінь набрякання полімеру (в
%).
Алгоритм розв’язування
Ступінь набрякання полімеру в % вираховуємо за формулою:
α = |
V − V0 |
×100% = |
V ×100% |
|
|||
|
V0 |
V0 |
|
|
9,204 ×10−4 -1,094 ×10−4 |
|
|
8,11×10−4 |
|
α = |
|
|
×100% = |
|
×100% = |
1,094 ×10−4 |
|
1,094 ×10−4 |
|||
|
|
80 |
|
|
|
