
75 группа 2 вариант / Тепломассообмен / ТОТ в примерах и задачах
.pdf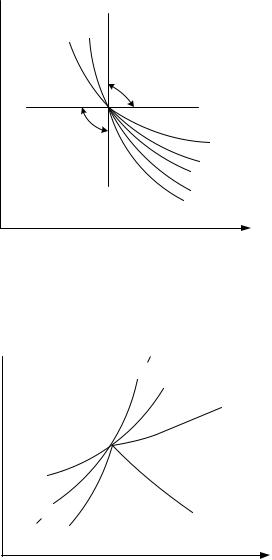
P 
n
=
1
n=0
n<0
n=+ 8
+-
n = k
-+
n=+ 8
n<0 |
|
|
|
|
|
|
|
|||
|
|
|
|
n=0 |
|
|
|
|
||
|
|
|
|
n=0,8 |
|
|
|
|||
|
|
|
|
T= |
|
|
|
|
|
|
|
|
|
|
const |
|
|||||
|
|
|
|
|
n |
|
|
|
|
|
|
|
|
|
|
|
= |
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
, |
||
|
|
|
|
δ |
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
5 |
|
n |
|
|
|
q |
|
|
|
|
|
|
|
|
|
|
= |
|
|
|
|
||
= |
|
|
|
|
0 |
|
|
|
||
|
2 |
|
|
|
|
|
|
|
|
|
|
|
, |
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
v
Рис.1. Политропные процессы изменения состояния идеальных газов в р,v-диаграмме
T 
Рис.2.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
8 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
n |
= |
+ |
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
n=k |
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
= |
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
n |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
,8 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
= |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
n |
|
|
|
|
|
|
n=1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
n=1 |
||
|
|
|
|
|
|
|
|
st |
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
n |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
o |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
c |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
= |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
P |
|
|
|
|
|
t |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
s |
|
|
|
|
|
|
|
|
|
|
||
|
0 |
|
|
|
n |
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
o |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
= |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
n |
|
|
|
c |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
= |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
v |
|
|
|
|
|
|
|
|
|
|
|
|
n |
|
|
|
|
|
|
|
- |
|
|
|
|
|
|
5 |
|
|
|
|
|
= |
|
|
|
|
|
|
|
|
|
|
|
|
, |
|
|
|
|
|
|
1 |
|
|
|||
|
|
8 |
+ |
|
|
2 |
|
|
|
|
|
|
|
|
, |
|
||||
|
|
n |
= |
|
n=k |
|
|
|
|
|
|
|
|
25 |
|
|||||
n |
+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
= |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
s
Политропные процессы изменения состояния идеальных газов в T,s-диаграмме

Рассмотрим изотермический процесс расширения 1-2 и сжатия 1- 2' идеального газа (рис.3)
Рис.3.Изотермический |
процесс |
расширения |
и |
сжатия |
идеального газа |
|
|
|
|
При изотермическом расширении идеального газа (vdv 0 ) совершается положительная работа, т.к. в этом случае dv 0 и из определения механической работыpdv следует 0 . При этом из закона Бойля – Мариотта p v const видно, что с увеличением объема газа
давление падает (p dp 0 ). Из условия изотермическо-
го процесса ( T const dT 0 ) очевидно, что внутренняя энергия газа и энтальпия не изменяются ( u const du 0 и h const dh 0 ). С учетом du 0 первый закон термодинамики принимает вид q , на основании которого можно сделать вывод, что положительная работа изменения объема (работа расширения 0 ) происходит при подводе теплоты q 0 и, следовательно, с увеличе-
нием энтропии (s ds 0 ). Кратко можно записать, что при изотермическом расширении функции состояния постоянны, а термодинамические параметры, работа и теплота изменяются следующим образом:
T const ; v ; p ; |
u h const ; s |
|
32 |
или
dT 0 ; |
dv 0 ; |
dp 0 ; |
du 0 ; |
dh 0 ; |
ds 0 ; |
0 ; |
q 0 ; |
q . |
|
|
|
При изотермическом сжатии идеального газа (v dv 0 ) направление процесса изменяется на противоположное (процесс 1- 2' ), а изменение термодинамических параметров, работы и теплоты меняет знак:
T const ; v ; |
p ; |
u h const ; s |
|
|
|||||
или |
|
|
|
|
|
|
|
|
|
dT 0 ; |
dv 0 ; |
dp 0 ; |
du 0 ; |
dh 0 ; |
ds 0 ; |
||||
0 ; |
|
q 0 ; |
q . |
|
|
|
|||
Анализ политропного процесса изменения |
|||||||||
|
|
состояния идеальных газов |
|
||||||
Условие. Идеальный двухатомный газ политропно |
|||||||||
расширяется с показателем политропы n = 0,4. |
|
||||||||
Анализ. Из уравнения рvn = рv0,4 = const следует, что |
|||||||||
при расширении по политропе |
с n = 0,4 давление газа по- |
||||||||
нижается, так как v2 > v1, по условию. |
|
|
|
||||||
Изменение температуры определяется |
по уравнению |
||||||||
Tvn 1 Tv0,4-1 |
|
T |
const . Так как v2 > v1 |
по условию, то |
|||||
|
|||||||||
|
|
v0,6 |
|
|
|
|
|
|
|
процесс протекает с повышением температуры Т2 > Т1, поэтому и с увеличением внутренней энергии u2 > u1 ( u > 0) и энтальпии h2 > h1 (Δh > 0).
Согласно уравнению первого закона термодинамики dq = du + d , так как dv > 0 и d > 0 (по условию), du > 0, то dq > 0. Теплота на исследуемом процессе подводится,
следовательно, энтропия увеличивается.
33

Изобразим политропный процесс расширения идеального газа с показателем политропы n = 0,4 в р,v- и T,s- диаграммах
p |
|
|
1 |
|
|
p1 |
|
|
p2 |
|
2 |
|
|
|
|
ℓ>0 |
|
v1 |
v2 |
v |
|
|
T |
|
|
|
2 |
|
T2 |
|
|
1 |
|
|
T1 |
|
|
|
q>0 |
|
s1 |
s2 |
s |
|
|
Рис.4. Политропный процесс расширения (n=0,4) идеального газа в p,v- и T,s- диаграммах.
Примеры решения задач
Задача 1
1 кг азота ( 28 кг/кмоль) с начальными параметрами p0 10 бар и t0 3000 C расширяется. При этом объ-
ём газа увеличивается в 5 раз. Процессы расширения газа: а) изобарный; б) изотермический; в) адиабатный.
Определить количество теплоты, работу изменения объёма, изменение внутренней энергии и изменение энтропии.
Изобразить процессы в p, v и T,s диаграммах. Решение
Процессы в p, v и T,s диаграммах изображены на рис.5.
34

p |
|
|
|
|
|
|
|
|
T |
|
|
|
|
|
|
|
p0 |
0 |
|
|
|
|
|
1 |
|
|
|
|
|
|
. |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
т |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
с |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
о |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
п |
|
|
|
|
|
|
|
T |
|
|
|
|
|
|
|
= |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
р |
|
|
|
|
|
|
|
|
|
= |
|
|
|
|
|
|
|
|
|
|
|
v=пост. |
|
|
|
|
|
по |
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
ст |
|
|
|
|
|
|
|
|
|
|
||
|
|
|
d . |
|
|
0 |
|
|
|
|
|
|
|
|||
|
|
|
|
q |
|
|
|
|
|
|
2 |
|
|
|||
|
|
|
|
= |
|
2 |
|
|
|
|
|
|
||||
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
3 |
|
3 |
|
|
|
|
|
|
|
|
v0 |
|
|
|
|
v=5v0 |
v |
s0=s3 |
s2 |
|
|
s1 |
s |
|||
Рис.5. |
Процесс расширения газа: |
|
|
|
|
|
|
|
|
|
||||||
|
0-1 – изобарный процесс расширения идеального газа; |
|
|
|
||||||||||||
|
0-2 – изотермический процесс расширения идеаль ного газа; |
|
||||||||||||||
|
0-3 – адиабатный процесс расширения идеального газа. |
|
|
|||||||||||||
а) Изобарный процесс p const
По условию p0 10 бар , T0 300 273 573 K.
При p const |
T1 |
|
v1 |
5 . |
|
T0 |
v0 |
||||
|
|
|
Конечная температура газа
T1 5 T0 5 573 2865 K 25920 C .
Количество теплоты на изобарном процессе q сp (t1 t 0 ) 1,04 (2592 300) 2383 кДж / кг,
где массовая изобарная теплоёмкость
с |
|
4,157 |
(i 2) |
4,157 |
7 |
1,04 кДж /(кг К). |
|
p |
|
28 |
|||||
|
|
|
|
||||
|
|
|
|
|
Работа изменения объёма
R (t1 t 0 ) 0,2969 (2592 300) 681 кДж / кг,
где газовая постоянная
RR 8314 296,9 Дж /(кг К) 0,2969 кДж /(кг К).
28
35
Работа изменения объёма для изобарного процесса может быть определена также по формуле
p (v |
1 |
v |
0 |
) 103 |
|
0,851 0,1702 681 кДж/кг, |
||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
где |
|
v |
|
|
R T0 |
, |
|
|
v |
|
5 v |
|
|
|
|
по условию. |
|
|
||||||||||||||||||||
|
0 |
|
|
|
|
|
1 |
0 |
|
|
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
p0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
v |
|
|
296,9 573 |
0,1702 м3 / кг, |
|
|
||||||||||||||||||||||||||||
|
|
|
|
0 |
|
|
|
|
|
|
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
106 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
v |
1 |
5 0,1702 0,851 |
|
|
м3 / кг. |
|
|
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Изменение внутренней энергии |
|
|
|||||||||||||||||||||||||||||||||||
u1 u 0 |
|
|
cv (t1 t 0 ) 0,742 |
2592 300 1702 |
кДж / кг, |
|||||||||||||||||||||||||||||||||
где |
c |
|
|
|
4,157 |
i |
4,157 |
5 |
|
|
0,742 кДж /(кг К). |
|||||||||||||||||||||||||||
v |
|
|
|
|
|
|
||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
28 |
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
Проверка: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
q u 1702 681 2383 кДж / кг. |
|
|
||||||||||||||||||||||||||||||||||||
|
Изменение энтропии |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
s c |
|
|
|
ln |
T1 |
|
|
1,04 ln |
2865 |
|
1,67 |
кДж /(кг К). |
|
|
||||||||||||||||||||||||
p |
|
|
|
|
|
|
||||||||||||||||||||||||||||||||
|
|
|
|
|
|
T0 |
|
|
|
|
|
|
|
|
|
573 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
Конечное давление: |
|
p1 p0 |
10 бар . |
|
|
||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
б) Изотермический процесс T const |
|||||||||||||||||||||||||||||||
|
По условию p |
|
|
10 бар, T |
T 573K, |
v2 |
5. |
|||||||||||||||||||||||||||||||
|
0 |
|
||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
0 |
|
v0 |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
При T const |
pv const и |
|
|
|
p0 |
|
5. |
|
|
|||||||||||||||||||||||||||||
|
|
|
p2 |
|
|
|||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
Конечное давление |
p |
|
|
|
|
p0 |
|
10 |
2 бар . |
|
|
||||||||||||||||||||||||||
|
2 |
|
|
|
|
|
||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5 |
|
5 |
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
При |
|
T const |
|
|
|
u const и |
|
u 0, т.е. |
внутренняя |
||||||||||||||||||||||||||||
энергия газа не изменяется.
Количество теплоты на изотермическом процессе равно работе изменения объёма.
36
q R T ln |
р2 |
R T ln |
v |
2 |
0,2969 573 ln 5 |
|||||
р0 |
v |
0 |
||||||||
|
|
|
|
|
|
|
||||
274 кДж / кг. |
|
|
|
|
||||||
|
Изменение энтропии |
|
|
|||||||
s |
q |
|
274 |
0,48 кДж /(кг К). |
||||||
|
|
|||||||||
|
T |
573 |
|
|
|
|
|
|
||
|
|
|
в) Адиабатный процесс dq 0 |
|||||||
|
|
|
По условию p |
|
|
10 бар, |
T |
573 K, |
v3 |
|
5. |
|
|
||||||||||||||||||||||
|
|
|
0 |
|
|
|
|
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
|
|
v0 |
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Уравнение адиабатного |
процесса |
|
pvk пост, |
|
в котором |
||||||||||||||||||||||||||||||
показатель |
|
|
|
адиабаты |
|
|
для |
|
|
|
|
двухатомных |
|
газов |
|||||||||||||||||||||
k |
сp |
|
|
|
|
i 2 |
1,4. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
сv |
|
|
|
|
|
i |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
Конечное давление |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
v0 |
|
k |
|
|
1 |
1,4 |
|
10 |
|
|
|
|
|
|
|
|
|
|
||||||||||
p |
3 |
p |
0 |
|
|
|
|
|
|
|
10 |
|
|
|
|
|
|
|
|
1,05 бар . |
|
|
|
|
|
||||||||||
|
|
|
|
|
|
1,4 |
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
v3 |
|
|
|
|
|
5 |
|
|
|
5 |
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
Конечная температура определяется по уравнению |
||||||||||||||||||||||||||||||||
Tvk 1 пост. : |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
v0 |
k 1 |
|
|
|
|
1 |
1,4 1 |
573 |
|
|
|
|
0 |
|
|||||||||||||||
T |
T |
|
|
|
|
573 |
|
|
|
|
|
|
|
|
|
|
301,5 K |
28,5 |
|
C. |
|||||||||||||||
|
|
|
|
|
|
|
|
0,4 |
|
||||||||||||||||||||||||||
|
3 |
|
0 |
|
|
|
|
|
|
|
|
|
|
5 |
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
v3 |
|
|
|
|
|
|
5 |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
Для адиабатного процесса: |
q 0, |
s 0, s const. |
|
|
|||||||||||||||||||||||||||||||
Работа изменения объёма
u u 0 u3 cv (t 0 t 3 ) 0,742 (300 28,5)201,5 кДж / кг.
Ответ: а) q = 2383 кДж/кг;
= 681 кДж/кг; Δu = 1702 кДж/кг;
Δs = 1,67 кДж/(кг·К).
37
б) q = = 274 кДж/кг;
Δu =0;
Δs = 0,48 кДж/(кг·К).
в) q = 0;
= - u = 201,5 кДж/кг;
Δs =0.
Задача 2
1 м3 воздуха (µ = 28,96 кг/кмоль) с начальными параметрами р1 = 8 бар и t1 = 160 0С расширяется политропно до р2 = 1 бар и t2 = 52 0C. Определить количество теплоты, полученное 1 м3 воздуха, работу изменения объема, изменение внутренней энергии.
Решение Определим показатель политропы из уравнения:
|
|
|
1 n |
|
|
|
|
|
|
|
|
1 n |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 n |
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T |
р |
2 |
|
n |
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
T р n |
T р |
|
n ; |
|
|
|
1 |
|
|
|
|
; |
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
1 |
|
1 |
|
|
|
|
|
2 |
|
|
|
2 |
|
|
|
|
|
|
T2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
р1 |
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
433 |
|
||||||
|
T1 |
|
|
|
1 n |
|
|
|
|
р2 |
|
|
|
|
|
|
n |
|
|
n |
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||
|
|
|
|
|
1 |
|
|
|
|
|
325 |
|
|
|||||||||||||||||||||||||||
n |
|
|
|
|
n |
; |
|
|
|
|
|
; |
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
n |
|
|
|
|
|
|
р1 |
|
|
|
|
|
|
n |
|
|
|
|
|
|
1 |
|
|
|
|||||||
T2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
n |
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
0,287 n 1 n 2,08 ; |
|
|
|
|
|
|
|
|
|
|
|
|
|
8 |
|
|
|
|||||||||||||||||||||||
|
|
|
n = 1,16. |
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
|
|
|
|
Масса воздуха |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
m |
|
р V |
|
|
|
|
|
|
|
8 105 1 |
|
6,42 кг, |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
1 |
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
R T |
|
|
|
287 273 160 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R |
|
|
R |
|
|
8314 |
|
287 |
|
Дж |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
где |
|
|
|
|
|
|
|
|
|
|
|
. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
28,96 |
|
кг К |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
Количество теплоты
Q m q m c t 2 t1 6,42 1,079 52 160748,2 кДж,
38

где с с |
|
|
n k |
|
|
R |
i |
|
n k |
|
8,314 |
|
5 |
|
1,16 1,4 |
|
|||||||
v |
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
n -1 |
|
|
2 |
|
n -1 |
28,96 |
|
2 1,16 1 |
||||||||||||
|
|
|
|
|
|
|
|
||||||||||||||||
1,079 |
кДж |
. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
кг К |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
Работа изменения объема |
|
|
|
|
|
|
|
|
|||||||||||||||
L m m |
R |
|
t |
|
t |
|
6,42 |
0,287 |
|
160 52 |
|||||||||||||
|
1 |
2 |
|
|
|||||||||||||||||||
|
|
|
|
|
n -1 |
|
|
|
|
|
1,16 1 |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
1246,2 кДж.
Изменение внутренней энергии
U m u m cv t 2 t1 6,42 8,31428,96 52 52 160498,5 кДж.
Ответ : n 1,16; Q 748,2 кДж; |
L 1246,7 кДж; |
U 498,5 кДж. |
|
Контрольные задачи
1. Воздух расширяется по политропе с показателем
n = 1,2 от р1 = 6 бар и t1 = 320 0С до р2 = 1 бар. Определить параметры начальной и конечной точек процесса, за-
трату теплоты, работу изменения объема на 1 кг воздуха и изобразить процесс в p, v и T,s диаграммах.
Ответ : v |
|
0,284 |
м3 |
; v |
|
1,26 |
м3 |
; |
T 439 К; |
|||||||
1 |
|
|
2 |
|
||||||||||||
|
|
|
кг |
|
|
|
|
|
кг |
|
|
2 |
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
q |
|
|
110,6 |
кДж |
; |
|
|
|
220 |
кДж |
. |
|||||
1-2 |
|
|
1 2 |
|
||||||||||||
|
|
|
кг |
|
|
|
|
|
|
|
|
кг |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
2. Газовая смесь имеет состав по массе: H2 = 10%, CO2 = =10%, CH4 = 30%, N2 = 50%. Начальные параметры смеси p1 = 2 бар, t1 = 27 0C. Определить конечную температуру и работу сжатия, если смесь сжимается адиабатно до
39
давления р2 =10 |
бар. Изобразить процесс в p, v и |
T,s диаграммах. |
|
Ответ: t2 = 195 0C; = -325 кДж/кг.
3. Воздух массой 1,5 кг сжимается политропно от p1 = 0,09 МПа и t1 = 18 0C до p2 = 1 МПа. Температура при этом повышается до t2 = 125 0C. Определить показатель политропы, конечный объём, затраченную работу и количество отведенной теплоты. Изобразить процесс в p, v и
T,s диаграммах.
Ответ: n = 1,149; V2 = 0,171 м3; L = -309,2 кДж; Q = -195,4 кДж.
4. Определить, является ли политропным процесс сжатия газа, для которого параметры трёх точек имеют следующие значения: p1 = 0,12 МПа, t1 = 30 0C; p2 = = 0,36 МПа, t2 = 91 0C; p3 = 0,54 МПа, t3 = 116 0С. Изобра-
зить процесс в p, v и T,s диаграммах.
Ответ: процесс политропный n = 1,2.
5. Кислород массой 1 кг при начальном давлении 2 МПа и температуре 300 0C расширяется политропно до давления 0,25 МПа. Конечный объём 0,35 м3/кг. Определить количество теплоты процесса, работу изменения объёма, изменение внутренней энергии, энтальпии и энтропии. Изобразить процесс в p, v и T,s диаграммах.
Ответ : q 28,1 кДж/кг; u -153,4 кДж/кг;
181,5 кДж/кг; h -224,2 кДж/кг; s 0,066 кДж/(кг К).
6. Углекислый газ, занимающий объём 4 м3 и имеющий начальную температуру 20 0C, нагревается при постоянном объёме. При этом его давление повышается от 0,1 МПа до 0,3 МПа. Затем газ адиабатно расширяется до давления 0,15 МПа. Определить количество теплоты, работу изменения объёма, изменение внутренней энергии, из-
40
