
voronina
.pdfло, ікра та ін.), розщеплюються в кишечнику за допомогою панкре- атичної холестеролестерази. Цей фермент активується жовчними кислотами. Після ферментативного гідролізу утворюються вільний холестерин і жирні кислоти.
Всмоктування ліпідів та їх транспорт
Утонкому кишечнику відбувається всмоктування таких продук- тів перетравлювання ліпідів: жирних кислот, гліцерину, 2-моноацил- гліцерину, холіну й інших спиртів, Н3РО4, сфінгозину, холестерину.
Близько 50% ліпідів всмоктується у вигляді 2-моноацилгліцери- нів, проходячи мембранний бар'єр завдяки простій дифузії.
Близько 3–6% ліпідів всмоктується у вигляді триацилгліцеринів шляхом піноцитозу.
Всмоктування жирних кислот залежить від довжини вуглеводне- вого ланцюга. Так, коротколанцюгові жирні кислоти (до 12 вуглецевих атомів) транспортуються простою дифузією всередину кишкового епітелію. Жирні кислоти, які мають більше за 14 вуглецевих атомів, утворюють транспортні комплекси з жовчними кислотами, що звуть- ся холеїновими комплексами. Це полегшений транспорт, в якому роль переносника виконують жовчні кислоти. Усередині стінки кишечника холеїновий комплекс розпадається, і жовчні кислоти по системі пор- тальної вени надходять до печінки.
З печінки вони знову повертаються із жовчю в кишечник. Цей кругообіг називають кишково-печінковою циркуляцією жовчних кислот.
Інші продукти перетравлювання ліпідів, такі як гліцерин, фосфати у вигляді натрієвих і калієвих солей, а також спирти (холін, сфінгозин) легко всмоктуються, в основному, шляхом па- сивного транспорту.
Продукти перетравлювання ліпідів, які потрапили в результаті всмоктування в слизову оболонку кишечника, транспортуються в кров і лімфу.
Укров воротної вени і далі в печінку надходять коротколанцю- гові жирні кислоти, гліцерин, фосфати, холін та інші спирти гліце- рофосфатидів.
Довголанцюгові жирні кислоти, холестерин, триацилгліцерини, моноацилгліцерини і більша частина фосфоліпідів після всмокту- вання виявляються в лімфі.
Перед надходженням у лімфу в стінці кишечника ліпіди ресинте-
зуються.
В епітелії кишечника відбувається ресинтез триацилгліцеринів, фосфоліпідів та ефірів холестерину.
Біологічне значення ресинтезу ліпідів полягає в утворенні ліпі- дів, притаманних організму людини, які відрізняються від харчових жирів за фізико-хімічними і біологічними властивостями.
Процес ресинтезу ліпідів, який починається в стінці тонкої киш- ки далі продовжується в печінці.
301
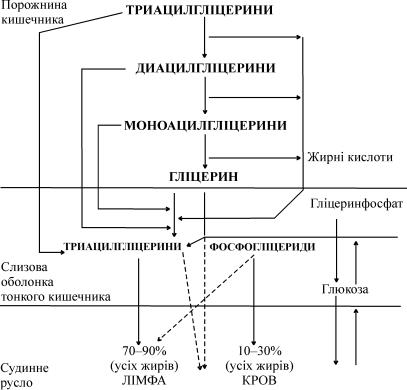
Рис. 70. Схема травлення і всмоктування ліпідів у тонкому кишечнику
Транспорт ресинтезованих у кишечнику ліпідів відбувається та- ким чином.
Деяка частина фосфоліпідів, що утворилася внаслідок ресинтезу, завдяки своїй гідрофільності надходить у кров воротної вени. Зали- шок фосфоліпідів, всі триацилгліцерини, ефіри холестерину і вільний холестерин потрапляють до лімфатичної системи, а відтіля через грудну протоку – у загальне коло кровообігу.
Оскільки більшість ліпідів нерозчинна у воді, їх перенос здійсню- ється за допомогою транспортних форм. Головну роль у транспорті ліпідів виконують білки. Перенесення ліпідів кров'ю до різних органів і тканин відбувається у вигляді розчинних ліпопротеїнових комплек- сів.
За допомогою ультрацентрифугування, електрофорезу та інших методів ліпопротеїни плазми крові розділяються на цілий ряд фракцій за розмірами їх частинок і фізико-хімічними властивостями. Білки, які входять до складу ліпопротеїнів плазми крові, синтезуються, головним чином, у печінціі в епітеліальних клітинахтонкого кишечника.
Характерною особливістю структури ліпопротеїнів є те, що не- розчинні, тобто гідрофобні, ліпіди (жири, холестериди) розташовані
302
в центрі комплексу, а відносно розчинні (наприклад, фосфоліпіди) – розміщені ближче до поверхні. Зовнішня оболонка такої частинки складається в основному з білка, що й надає їй стійкості у водному середовищі. Зв'язок між окремими компонентами в ліпопротеїнах є, головним чином, гідрофобним. Тому ці комплекси, підходячи до клітин, відносно легко розпадаються, що сприяє використанню ліпі- дів як енергетичного або пластичного матеріалу для організму.
У крові виявлено декілька форм ліпопротеїнів; основні з них – хі- ломікрони, ліпопротеїни дуже низької густини (ЛПДНГ), ліпопротеї- ни низької густини (ЛПНГ) і ліпопротеїни високої густини (ЛПВГ).
Ліпопротеїни відрізняються за електрофоретичною рухливістю: при рН 8,6 хіломікрони залишаються на місці нанесення біля катоду, ЛПДНГ мігрують попереду фракції β-глобулінів сироватки крові (пре-β-ліпопротеїни), ЛПНГ – разом із β-глобулінами (β-ліпопроте- їни), ЛПВГ – з α-глобулінами (α-ліпопротеїни).
Набір білків у складі різних ліпопротеїнів різноманітний. Густина й електрофоретична рухливість ліпопротеїнів є прямо
пропорційними вмісту білків і обернено пропорційними вмісту три- ацилгліцеринів.
Вільні жирні кислоти транспортуються в комплексі з альбумі- нами сироватки крові. Це найбільш рухлива транспортна форма лі- підів. Вміст вільних жирних кислот та їх комплексів з альбумінами в крові складає близько 0,15–0,25 мг/л і значно зростає при всмокту- ванні ліпідів. Завдяки великій швидкості обміну, вільні (неетерифі- ковані) жирні кислоти в комплексі з альбумінами складають важли- вий рухомий резерв енергетичного матеріалу організму.
Транспорт ліпідів у кров здійснюється не лише за допомогою утворення вищеназваних комплексів, але й за участю клітинних еле- ментів крові – еритроцитів і лейкоцитів. Еритроцити містять велику кількість фосфоліпідів і вільного холестерину (холестеридів у їх складі немає). У лейкоцитах під час всмоктування ліпідів виявлено велику кі- лькість фосфогліцеридів і нейтральних жирів (триацилгліцеринів).
Вміст ліпідів у крові залежить від характеру харчування, режиму праці і побуту, віку, статі та інших факторів, і їх кількість може змінюва- тися внаслідок деяких патологічних станів організму. Так, підвищення вмісту загального холестерину й особливо β-ліпопротеїнів є патогене- тичнимфактором розвитку атеросклерозу йішемічноїхвороби серця.
Уразі збільшення вмісту ліпідів плазма крові стає каламутною
зсильною опалесценцією. Така плазма називається ліпемічною.
Це викликає появу в крові так званого просвітляючого фактора
(clearing factor – англ.).
До складу просвітляючого фактора входить ліпопротеїнліпаза, яка утворюється в печінці, жировій тканині, легенях, ендотелії судин у неактивній формі.
Фермент активується гепарином, який надходить у кров із туч- них клітин сполучної тканини. У результаті відбувається гідроліз триацилгліцеринів у складі хіломікронів та інших ліпопротеїнів на
303
гліцерин і жирні кислоти. Плазма крові просвітляється. Жирні кис- лоти одразу ж акцептуються альбумінами плазми і транспортують- ся до тканин і органів. Гліцерин, розчиняючись у плазмі, також з то- ком крові надходить в органи. Основна частина жирних кислот і глі- церину використовується жировою тканиною, де відбувається їх де- понування у вигляді триацилгліцеринів, а також серцем, печінкою та іншими органами, в яких вони окислюються зі звільненням енергії.
Внутрішньоклітинний гідроліз ліпідів
У тканинах організму відбувається безперервне оновлення ліпі- дів. Основну масу ліпідів тіла людини складають триацилгліцерини, які містяться в більшості тканин, але особливо на них багата жирова тканина, котра майже повністю складається з триацилгліцеринів. Оскільки вони виконують енергетичну роль, то процеси оновлення триацилгліцеринів (нейтральних жирів) пов'язані з мобілізацією і де- понуванням їх у процесі утворення енергії. Період напівперетворення триацилгліцериніву різних органахколивається від2 до 18 діб.
Близько половини енергії основного обміну забезпечується за рахунок окислення неетерифікованих, тобто вільних жирних кислот – НЕЖК (С.М.Лейтес).
Складні ліпіди (фосфоліпіди, сфінголіпіди, гліколіпіди), холес- терин та його ефіри, що входять до складу біологічних мембран, оновлюються менш інтенсивно, ніж триацилгліцерини. Їх оновлення спричинене або відновленням пошкодженої ділянки мембрани, або заміною «дефектної» молекули на нову.
Обмін кожної із груп складних ліпідів має свої специфічні особ- ливості і загальні закономірності.
І оновлення ліпідів, і їх використання як джерела енергії, потре- бує попереднього внутрішньоклітинного гідролізу їх ферментами.
Одним із перших етапів обміну ліпідів є розщеплення триацилг- ліцеринів під впливом тканинних ліпаз на гліцерин та жирні кисло- ти. Цей процес особливо активно відбувається в жировій тканині. У ній міститься декілька ліпаз, із яких найбільше значення мають триацилгліцеринліпаза (так звана гормоночутлива ліпаза), диацил- і моноацилгліцеринліпази. Активність двох останніх ферментів у 10– 100 разів перевищує активність першого, проте вони не чутливі до дії гормонів. Триацилгліцеринліпаза активується адреналіном, норад- реналіном, глюкагоном тощо, тобто є регулюємим ферментом. Ця гормоночутлива ліпаза перебуває в жировій тканині в неактивній формі й активується цАМФ.
Унаслідок дії гормонів первинний клітинний рецептор модифі- кує свою структуру і в такій формі активує фермент аденілатциклазу, яка у свою чергу стимулює утворення цАМФ із внутрішньоклітинної АТФ. Утворений цАМФ активує фермент протеїнкіназу, яка в ре- зультаті фосфорилювання неактивної триацилгліцеринліпази пере- творює її в активну форму. Остання розщеплює триацилгліцерин (ТГ) на диацилгліцерин і жирну кислоту (ЖК). Дія ди- і моноацилг-
304
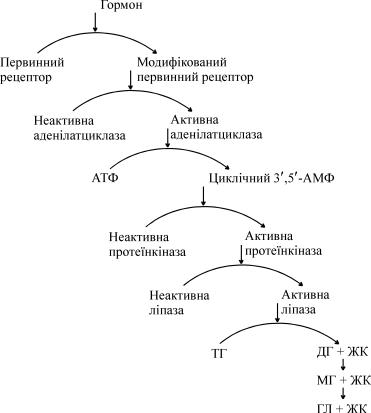
ліцеринліпаз завершує утворення кінцевих продуктів ліполізу – глі- церину (ГЛ) і вільних жирних кислот (див. Ліполітичний каскад).
Ліполітичний каскад (за Стайнбергом)
ТГ – триацилгліцерини; ДГ – диацилгліцерини; МГ – моноацилгліцерини; ГЛ – гліцерин; ЖК – жирні кислоти
Установлено, що гідроліз внутрішньоклітинних ліпідів у жировій тканині не призводить до накопичення в ній гліцерину і вільних жирних кислот. Останні не окислюються в жировій тканині, а надходять у кро- в'яне русло, зв'язуються з альбумінами плазми і з током крові надхо- дять уінші органиі тканини, в яких комплекс розпадається.
Більша частина жирних кислот окислюється з утворенням кінце- вих продуктів СО2 и Н2О і звільненням енергії. Частина жирних кис- лот використовується в процесі біосинтезу фосфоліпідів, гліколіпі- дів, етерифікації холестерину.
Іншим джерелом жирних кислот є фосфогліцериди клітинних мембран, які безперервно оновлюються.
Фосфогліцериди клітинних мембран гідролізуються за допомо- гою фосфоліпаз А1, А2, С и D, локалізованих переважно в лізосомах.
305

Окремі фосфоліпази є і в інших органоїдах клітини. Продуктами гід- ролізу фосфогліцеридів є гліцерин, жирні кислоти, азотовмісні спо- луки і неорганічний фосфат. Є також специфічні ферменти гідролізу сфінголіпідів і гліколіпідів, що беруть участь у їх оновленні.
Окислення гліцерину
Обмін гліцерину тісно пов'язаний з гліколізом, до якого він за- лучається, попередньо фосфорилюючись за рахунок АТФ із участю ферменту гліцеролфосфокінази.
Гліцеролфосфат за допомогою НАД-залежної гліцеролфосфат- дегідрогенази перетворюється на дигідроксиацетонфосфат, який є звичайним метаболітом гліколізу і перетворюється його фермента- ми до лактату в анаеробних умовах і до СО2 и Н2О – в аеробних.
Гліцерин – є енергетичним субстратом, який використовується практично всіма органами і тканинами.
Перетворення однієї молекули гліцерину дає одну молекулу АТФ в анаеробних умовах і 22 молекули АТФ – в аеробних.
Окислення жирних кислот
Окислення вищих жирних кислот уперше було вивчено в 1904 р. Кноопом. Годуючи кроликів різними жирними кислотами, в яких один атом водню в кінцевій метильній групі був заміщений на фені- льний радикал (С6Н5–), він установив, що окислення молекули жир- ної кислоти в тканинах організму відбувається в β-положенні. Це призводить до послідовного відщеплення від молекули жирної кис- лоти двовуглецевих фрагментів з боку карбоксильної групи.
Жирні кислоти, які входять до складу природних жирів тварин і рослин, містять переважно парну кількість вуглецевих атомів. Будь- яка така кислота, відщеплюючи по парі вуглецевих атомів, утворює декілька молекул оцтової кислоти (наприклад, зі стеаринової – 9, із пальмітинової – 8).
306

Зрештою, окислення жирної кислоти відбувається через стадію масляної кислоти, яка після чергового β-окислення дає ацетоацетил- КоА. Остання далі гідролізується на дві молекули ацетил-КоА.
Узв'язку з тим, що відщеплення оцтової кислоти відбувається внаслідок розриву молекули вищої жирної кислоти в β-положенні, весь процес Кнооп назвав β-окисленням.
У1948–1949 рр. Кеннеді та Ленінджер встановили, що окислення жирних кислот відбувається тільки в мітохондріях. Пізніше (1954– 1958 рр.) були описані основні ферментативні реакції окислення жирних кислот. Сьогодні β-окислення жирних кислот називають циклом Кноопа-Лінена.
Молекулярні механізми окислення вищих жирних кислот, які утворилися в клітині шляхом гідролізу ліпідів чи надійшли до неї
зкрові, складаються з таких основних етапів.
Усі жирні кислоти до окислення їх у мітохондріях зазнають активації. Механізм активації складається з двох етапів і відбува- ється на зовнішній мембрані мітохондрій. Спочатку жирні кисло- ти реагують з АТФ і перетворюються в ациладенілати. При цьому від АТФ відщеплюється молекула пірофосфорної кислоти (ПФ). Далі ациладенілати під впливом ферментів ацил-КоА-синтетаз (тіокіназ жирних кислот) реагують з цитоплазматичним КоА, в результаті чого утворюються сполуки жирних кислот з коензи- мом А – ацилкоензим А (ацил-КоА), і відщеплюється аденозин- монофосфорна кислота (АМФ)
Оскільки окислення вищих жирних кислот відбувається в міто- хондріях клітин, то ацил-КоА, тобто активні форми жирних кислот, переносяться із зовнішньої мембрани всередину мітохондрій.
У перенесенні ацилів через мембрани мітохондрій значну роль ві- діграєкарнітин(γ-триметиламіно-β-гідроксибутират).
Ацили, як відомо, мають кислий характер, що може бути одні- єю з причин, які перешкоджають їх проникненню через ліпопротеї- новий подвійний шар мембрани, котрий також має кислі властиво-
307

сті. Карнітин же виявляє основні властивості, до того ж він віднос- но добре розчиняється у воді на відміну від ацилів вищих жирних кислот. Тому ацил-КоА, з'єднуючись з карнітином, за участю спе-
цифічного цитоплазматичного ферменту ацил-КоА-карнітинтранс-
ферази утворює ацилкарнітин, тобто ефір карнітину і жирної кисло- ти, що має здатність проникати у мітохондрії.
Після проходження ацилкарнітину через мембрану мітохондрії відбувається зворотна реакція – розщеплення ацилкарнітину за до- помогою КоАSН і мітохондріального ферменту ацил-КоА-карнітин- трансферази. Карнітин, який вивільняється після руйнування ком- плексу, повертається до цитоплазми, а ацил-КоА окислюється в мі- тохондріях шляхом β-окислення.
У циклі беруть участь чотири ферменти, які послідовно діють на активовану жирну кислоту – ацил-КоА.
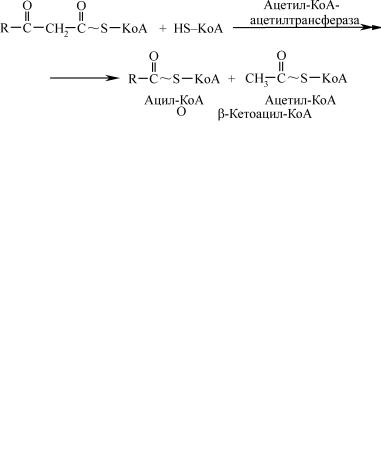
Перша стадія дегідрування. Ацил-КоА в матриксі мітохондрій насамперед дегідрується за допомогою ферменту ацил-КоА-де- гідрогенази (ФАД-залежний фермент).
308
Ймовірно, існує декілька ацил-КоА-дегідрогеназ, які містять ФАД, і є специфічними відносно ацил-КоА з певною довжиною вуг- леводневого ланцюга.
Стадія гідратації. Ненасичений ацил-КоА (єноїл-КоА) за допо- могою ферменту єноїл-КоА-гідратази приєднує молекулу води. У ре- зультаті утворюється β-гідроксиацил-КоА
Друга стадія дегідрування. Утворений β-гідроксиацил-КоА потім дегідрується. Цю реакцію каталізують НАД-залежні дегідрогенази
Тіолазна реакція. У цій реакції β-кетоацил-КоА взаємодіє з кое- нзимом А. У результаті відбувається розщеплення β-кетоацил-КоА і утворюється скорочений на два вуглецевих атоми ацил-КоА і двову- глецевий фрагмент у вигляді ацетил-КоА. Ця реакція каталізується ферментом ацетил-КоА-ацетилтрансферазою (тіолазою).
Ацил-КоА, яка вкоротилась на два вуглецевих атоми, знову бага- торазово проходить увесь шлях β-окислення до утворення бутирил- КоА, який у свою чергу окислюється до двох молекул ацетил-КоА.
Продуктами окислення жирної кислоти з парним числом вугле- цевих атомів є ацетил-КоА, ФАД Н2 і НАД Н2.
Далі ацетил-КоА, що утворився, вступає в цикл трикарбонових кислот (цикл Кребса), а ФАД Н2 и НАД Н2 – в дихальний ланцюг.
Окислення жирних кислот з непарним числом вуглецевих атомів
полягає в тому, що поряд із звичайними (для парних) продуктами
309

окислення – ацетил-КоА, ФАД Н2 и НАД Н2, утворюється одна моле-
кула пропіоніл-КоА ( ) на молекулу окисленої жирної кислоти. Пропіоніл-КоА перетворюється в сукциніл-КоА:
Карбоксилювання пропіоніл-КоА відбувається під дією ферме- нту пропіоніл-КоА-карбоксилази за участю АТФ. Коферментом цьо- го ферменту є біотин – переносник карбоксигруп. Метилмалоніл- КоА, який утворився, перетворюється на сукциніл-КоА під впли- вом ферменту метилмалоніл-КоА-мутази. Коферментом остан- нього є похідне вітаміну В12 – дезоксиаденозилкобаламін. Сукциніл- КоА вступає в цикл Кребса.
Окислення ненасичених жирних кислот. Ненасичені жирні кис-
лоти окислюються швидше за насичені, причому активність цього процесу значною мірою залежить від кількості подвійних зв'язків. До місця подвійного зв'язку ненасичені жирні кислоти окислюють- ся так само, як насичені. Подальше їх перетворення має ряд особ- ливостей. Справа в тому, що подвійні зв'язки природних ненасиче- них жирних кислот (олеїнової, лінолевої та ін.) мають цис- конфігурацію, а в КоА-ефірах ненасичених кислот, які є проміжни- ми продуктами при β-окисленні насичених жирних кислот, подвійні зв'язки мають транс-конфігурацію. Окрім цього, послідовне вилу- чення двовуглецевих фрагментів при окисленні ненасичених жир- них кислот до першого подвійного зв'язку дає ∆3,4-ацил-КоА, а не ∆2,3-ацил-КоА, який є проміжним продуктом під час β-окислення насичених жирних кислот:
Було з’ясовано, що в тканинах присутній фермент, котрий здій- снює переміщення подвійного зв'язку з положення 3–4 в положення 2–3, а також змінює конфігурацію подвійного зв'язку з цис- у транс-.
Цей фермент одержав назву ∆3,4-цис-∆2,3-трансєноїл-КоА-ізомерази.
310
