
voronina
.pdf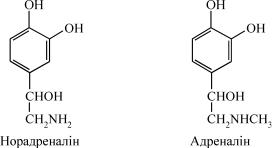
глюкозитагормонів, щовикликаютьгіперглікемію, наприклад, глюкагону абоадреналіну.
Практичне застосування інсуліну. Препарати інсуліну використо-
вуються, головним чином, для лікування цукрового діабету. З цією ме- тою використовують препарати інсуліну різної тривалості дії, що зале- жить від тяжкості та особливостей хвороби. На сьогодні в багатьох країнах випробовують програмовані портативні насоси для інфузії інсу- ліну. Такий насос споряджено резервуаром із багатодобовим запасом інсуліну, який подається малими порціями відповідно складеної для кожною хворого програми. Такий спосіб, який називається «безперерв- ною підшкірною інфузією інсуліну», є ефективнішим, ніж звичайна інсу- лінотерапія.
Гормони надниркових залоз
Надниркові залози – парні ендокринні залози, розміщені над верх- німи полюсами нирок. Даний ендокринний орган фактично являє со- бою сполучення в одному анатомічному утворенні двох самостійних за- лоз: мозкової речовини, що складає внутрішню частину органу, і зовні- шнього шару – кори надниркових залоз. Обидві структури розрізняють- сяза своєюбудовоюй синтезують різні гормони.
Гормони мозкової речовини надниркових залоз
Мозкова речовина надниркових залоз складається із хромафінних клітин і являє собою похідне нервової тканини. Її можна розглядати як спеціалізований симпатичний ганглій, позбавлений продовження у вигляді аксона. Хромафінні клітини мозкової речовини надниркових залоз виробляють дві біологічно активні сполуки з гормональною ак- тивністю – адреналін і норадреналін. Ці гормони і близькі до них амі- ни, що містять у своїй структурі катехолове ядро, мають загальну на- зву катехоламіни.
У мозковому шарі надниркових залоз людини вміст адреналіну становить ≈ 80% а норадреналіну – 10–20%. Адреналін утворюється тільки в мозковому шарі, у той час як основним джерелом норадре- наліну є симпатичні нерви. Третій катехоламін – нейромедіатор до- фамін – функціонує переважно в нервових шляхах мозку. Він є про- міжним продуктом біосинтезу адреналіну і норадреналіну в мозковій речовині надниркових залоз та в нервових клітинах. У разі хвороби
491
Паркінсона порушується синтез дофаміну в мозку. Для лікування да- ного захворювання використовують ДОФА, оскільки тільки ця спо- лука легко долає гематоенцефалічний бар'єр (катехоламіни через цей бар'єр не проходять).
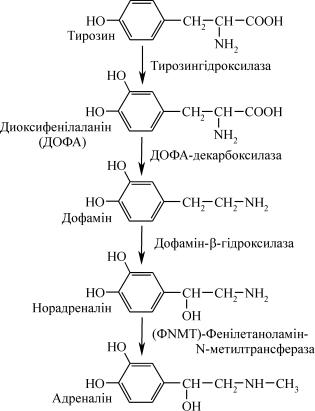
Біосинтез і секреція катехоламінів
Попередником катехоламінів є амінокислота тирозин. Їхній біосинтез можна подати у вигляді такої схеми:
У мозковому шарі надниркових залоз містяться хромафінні гра- нули – спеціалізовані органели, здатні до синтезу, поглинання, резер- вування та секреції катехоламінів. Синтез і секреція катехоламінів знаходяться під контролем центральної нервової системи і значно зростають в умовах гострого стресу, у тому числі – емоційного збу- дження. Сигналом до секреції гормонів є нервова стимуляція мозко- вого шару надниркових залоз. Ацетилхолін, який потрапляє із преган- гліонарних волокон, взаємодіє з рецепторами хромафінних клітин, ви- кликаючи деполяризацію мембран і входження у клітини Ca2+, який стимулює вивільнення адреналіну і норадреналіну шляхом екзоцито- зу. Цей процес стимулюється холінергічними і β-адренергічними аге-
492
нтами і гальмується α-адренергічними агентами. Катехоламіни крові пригнічують свій власний синтез і секрецію. У плазмі крові гормони транспортуються в комплексі з альбуміном. Вони мають дуже корот- кий період напівжиття, який складає 10–30 с. Концентрація адреналіну в плазмі крові – близько 0,05 мкг/л, а норадреналіну – приблизно в чо- тири рази вища (0,2 мкг/л). Стрес підвищує вміст катехоламінів у 4–8 разів.
Катехоламіни інактивуються або шляхом зворотного захвату нервовими закінченнями, або внаслідок метаболічних перетворень, що відбуваються в постсинаптичних клітинах, а також у печінці. Ін- активація адреналіну і норадреналіну здійснюється трьома голо- вними шляхами: О-метилюванням, окислювальним дезамінуван- ням і кон'югацією. Продукти метаболізму катехоламінів виділяються із сечею яку вільному стані, так іу вигляді парних сполук.
Роль катехоламінів і їх перетворення в організмі були глибоко досліджені в роботах А.М.Утєвського, який довів, що біологічна роль гормонів зумовлена не тільки самими катехоламінами, але і продук- тами їх обміну. У процесі метаболізму – шляхом відщеплення і при- єднання двох атомів водню – утворюється цілий ряд катехінових (ок- си-) і хіноїдних (кето-) форм. Причому катехінові форми (адреналін, норадреналін) мають гормональні властивості, а хіноїдні похідні (дегідроадреналін, адренохром, оксоадренохром) ці властивості втрачають. Однак цей процес є оборотним, і дегідроадреналін під впливом вітаміну С (або інших відновників) може знову перетвори- тися на адреналін.
Дія катехоламінів
Ефекти адреналіну і норадреналіну пов’язані майже з усіма фун- кціями організму. Їх головними мішенями є: серце, печінка, мозок, скелетні м'язи, гладка мускулатура судин, бронхів, матки, шлунково- кишкового тракту.
Катехоламіни діють через два головні класи рецепторів: α-ад- ренергічні і β-адренергічні, які, у свою чергу, підрозділяються на α1- і α2-, β1- і β2-адренорецептори. Адреналін зв'язується як із α-, так і з β-адренорецепторами, і його дія на тканину, що містить обидва кла- си рецепторів, залежить від їх відносної спорідненості до гормону. Норадреналін у фізіологічних концентраціях зв'язується головним чином з α-адренорецепторами.
Взаємодія гормонів з β1 і β2-адренорецепторами активує адені- латциклазу і підвищує рівень цАМФ, тоді як зв'язування із α2-ре- цепторами гальмує її і зменшує вміст цАМФ у клітині. За взаємодії гормонів з α1-рецепторами відбувається підвищення внутрішньоклі- тинної концентрації Ca2+ або продуктів метаболізму фосфати- дилінозитолу (або і те й інше).
Збільшення внутрішньоклітинної концентрації цАМФ, яка утворюється в клітинах-мішенях при зв'язуванні адреналіну з β1- і β2-рецепторами, зумовлює більшість його ефектів. У м'язах і мен- шою мірою в печінці гормон через цАМФ-залежний механізм сти- мулює розпад глікогену, активуючи фосфорилазний каскад. Це
493
призводить до підвищення рівня глюкози в крові і збільшення утворення лактату в м'язах, який частково переноситься в печінку, де перетворюється на глікоген. Норадреналін на відміну від адре- наліну справляє незначний вплив на вуглеводний обмін.
Вплив катехоламінів на ліпідний обмін виявляється в їх ліпідмобілі- зуючій дії. Жирова тканина – одна з найбільших тканин-мішеней для катехоламінів в організмі. Адреналін стимулює в ній ліполіз, сполучаю- чись з β1-рецепторами й активуючи (фосфорилюючи) ліпазу через аде- нілатциклазну систему. Це спричиняє збільшення вільних жирних кис- лот і гліцерину в крові. Жирові клітини (адипоцити) мають крім β1- та- кож α2-рецептори, які опосередковують антиліполітичний ефект. Від- ношення β1/α2 у різних жирових депо одного організму варіюється. Чим вище відношення β1/α2, тим швидше відбувається кругообіг триацилглі- церинів в адипоцитах і тим більшою є кількість вільних жирних кислот, що надходитьу кров.
Дія надлишкової кількості адреналіну на білковий обмін уперше була встановлена О.В.Палладіним і А.М.Утєвським, які показали, що гіперадреналінемія супроводжується посиленим розщепленням білків і підвищеним виведенням кінцевих продуктів азотистого об- міну (особливо креатину) із сечею.
Одним із головних напрямків дії катехоламінів є їх вплив на се- рцево-судинну систему. Постійне пристосування функції серця до зміни умов і регуляція артеріального тиску в основному зумовлю- ється норадреналіном, у той час як адреналін діє в умовах стресу, включаючи напругу, пов'язану зі страхом і тривогою. Через β1-ре- цептори катехоламіни збільшують силу і частоту серцевих скоро- чень, хвилинний об'єм серця, що призводить до підвищення артеріа- льного тиску. Адреналін має складний вплив на коронарний крово- обіг, переважно розширюючи коронарні судини. Діючи через β2- ре- цептори, він виявляє потужну бронхорозширюючу дію, у той час як норадреналін відрізняється більш слабким бронхолітичним ефек- том. Обидва гормони викликають звуження судин органів черевної порожнини, шкіри і слизових оболонок.
У цілому дія катехоламінів і всієї симпато-адреналової системи спрямована на швидку додаткову мобілізацію енергії в умовах гострого стресуі забезпечує готовність організму дозахисних реакцій.
Порушення функції мозкової речовини надниркових залоз
Експериментальних або клінічних станів, що пов'язані з гіпофунк- цією мозкової речовини надниркових залоз, не описано. Гіперфункція ці- єї структури виникає в людини при пухлині хромафінної тканини, яка називається феохромоцитомою. При цьому захворюванні нерідко спо- стерігається гіпертонія, підвищення основного обміну, глюкозурія, у плазмі підвищується вміст вільних жирних кислот. Вміст адреналіну і норадреналіну в плазмі крові може збільшитися більше ніж у 500 разів, крімтого, підвищується їх рівень у сечі.
Практичне використання катехоламінів. Катехоламіни застосо-
вують для стимуляції серцевих скорочень та для підвищення артері-
494
ального тиску. Адреналін використовують при алергічних реакціях, анафілактичному шоку; він є ефективним засобом для зняття брон- хоспазму при бронхіальній астмі. Його також застосовують для усу- нення гіпоглікемії, викликаної передозуванням інсуліну. Введення катехоламінів (адреналін, норадреналін) може бути необхідним при недостатності периферичного кровообігу, а також як місцевий су- динозвужуючий засіб.
Гормони кори надниркових залоз
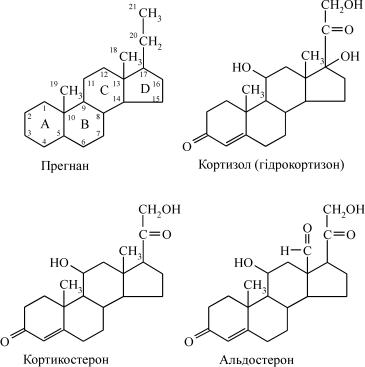
У корі надниркових залоз утворюється близько 50 стероїдних сполук, але далеко не всі з них мають значну гормональну актив- ність. Гормони кори надниркових залоз, які одержали загальну назву «кортикостероїди», розділяють на три класи відповідно до їхньої переважаючої дії: глюкокортикоїди, які діють переважно на вуглево- дний обмін, мінералокортикоїди, які регулюють мінеральний обмін, і статеві гормони, які виробляються в невеликих кількостях.
Всі стероїдні гормони побудовані на основі 17-вуглецевої структури циклопентанпергідрофенантрену. Глюкокортикоїди і мінерало- кортикоїди є похідними прегнану, який утворюється з холестерину і мі- стить 21 вуглецевий атом. Надниркові залози людини в нормі секрету- ють глюкокортикоїди – кортизол (основний глюкокортикоїд), кортико- стерон та мінералокортикоїд– альдостерон:
495
Синтез і секреція
Глюкокортикоїди і мінералокортикоїди утворюються з холестери- ну, який надходить у надниркові залози головним чином з крові. У про- цесі синтезу відбувається відщеплення бокового ланцюга холестерину, якому передує гідроксилювання 20 і 22 атомів вуглецю, і утворення проміжного продукту– прегненолону. Гідроксилювання стероїдного ядра прегненолону по 17, 21, 11 і 18 атомах вуглецю призводить до утворення різних гормонів. Для стероїдогенезу необхідні специфічні монооксигенази, що використовують НАДФН2 (донор водню), моле- кулярний кисень, цитохромР-450.
Синтез і секреція глюкокортикоїдів знаходяться під контролем АКТГ гіпофіза, виділення якого, у свою чергу, регулюється кортико- ліберином гіпоталамуса. Ці гормони пов'язані між собою петлею зворотного зв'язку. Підвищення рівня глюкокортикоїдів гальмує се- крецію АКТГ безпосередньо або через кортиколіберин; зниження їх рівня нижче за норму активує систему. Кортикотропін посилює син- тез глюкокортикоїдів у клітинах кори надниркових залоз через цАМФ-залежний механізм.
На секрецію глюкокортикоїдів впливає також стрес, стан тривоги, страху. Відповідно до теорії Г.Сєльє про стрес, система гіпофіз- надниркові залози відіграє найважливішу роль у «неспецифічних сис- темних реакціях організму, які виникають в умовах тривалого стресу». Будь-який надмірний подразник Г.Сєльє назвав стресором, а сукуп- ність фізіологічних та біохімічних реакцій, яка названа ним «загаль- ним адаптаційним синдромом», є механізмом, за допомогою якого ор- ганізм адаптується до змін внутрішнього та зовнішнього середовища. Цього не відбувається за відсутності гіпофіза або надниркових залоз, тому гіпофізектомовані або адреналектомовані тварини і людина дуже погано переносять стрес і можуть загинути. Існує добовий ритм, який визначає секрецію кортиколіберину, а отже, АКТГ та глюкокортикоїдів. Так, максимальний рівень кортизолу в крові спостерігається вранці, по- тім поступовознижуєтьсяімаємінімальнезначення вкінці дня.
Синтез і секреція альдостерону регулюються переважно через ренін-ангіотензинову систему і К+, але в цьому процесі беруть участь також Na+ і АКТГ. Ангіотензин II, збільшуючи проникність мем- бран клітин кори надниркових залоз для Ca2+, стимулює синтез альдостерону. Низький вміст Na+ або підвищений – K+ у сироватці крові посилює синтез і секрецію мінералокортикоїду.
У людини кірковий шар надниркових залоз секретує у нормі за добу 10–30 мг кортизолу, 2–4 мг кортикостерону і 300–400 мкг альдо- стерону. Гормони практично не накопичуються в клітинах наднир- кових залоз, а вивільняються в плазму по мірі утворення. Кортизол та кортикостерон у плазмі головним чином зв'язуються із специфіч- ним α-глобуліном крові – транскортином. Невелика кількість кор- тизолу може зв'язуватися з альбуміном. Період напівжиття корти- золу 1,5–2 год, а кортикостерону – 1 год. Альдостерон транспорту- ється переважно альбуміном.
496
Метаболізм стероїдних гормонів відбувається в печінці, нирках, ки- шечнику та інших тканинах. Він зводиться в основному до відновлення подвійного зв'язку в кільці А, гідроксилювання 3-кетогрупи та утворення парнихсполукізсірчаноюабоглюкуроновоюкислотами.
Дія глюкокортикоїдів
Органами-мішенями для глюкокортикоїдів є печінка, нирки, лім- фоїдна тканина, сполучна тканина (кістки, жирова тканина та ін.), ске- летні м'язи. Глюкокортикоїди прямо або опосередковано регулюють практично всі фізіологічні та біохімічні процеси в організмі, однак в їх дії умовно можна виділити наступні основні напрямки: 1) вплив на ме- таболізм вуглеводів, ліпідів і білків; 2) вплив на метаболізм електролі- тів і води; 3) вплив на імунну реакцію організму; 4) вплив на запальні процеси; 5) вплив на стійкість до ушкоджуючих факторів.
Дія глюкокортикоїдів на метаболізм вуглеводів характеризується підвищенням утворення глюкози, яке забезпечується координованим гормональним впливом на різні тканини і включає як катаболічні, так і анаболічні процеси. Збільшення вмісту глюкози в плазмі крові дося- гається: 1) збільшенням швидкості глюконеогенезу в печінці і нирках; 2) стимуляцією вивільнення амінокислот (субстратів глюконеогенезу) із периферичних тканин (м'язової, лімфоїдної); 3) гальмуванням ви- користання глюкози в непечінкових тканинах (м'язах, жировій та лім- фоїдній тканинах). Сигналом для стимуляції глюконеогенезу служить зниження концентрації глюкози в крові. Однак цей сигнал діє не без- посередньо на надниркові залози, а через гіпоталамо-гіпофізарну сис- тему. У здоровому організмі гіперглікеміч- на дія гормонів урівноважується інсуліном, який виявляє протилежний ефект, що і забезпечує нормальний рівень глюкози в плазмі.
Посилення глюкокортикоїдами глюконеогенезу відбувається шля- хом стимуляції синтезу його ферментів – фосфоєнолпіру- ваткарбоксикінази і глюкозо-6-фосфатази. Глюкоза, яка утворюється в процесі глюконеогенезу, використовується в синтезі глікогену в печінці, який посилюється внаслідок активації глікогенсинтетази.
На обмін білків та нуклеїнових кислот глюкокортикоїди чинять протилежний вплив у різних типах тканин. У печінці вони стимулю- ють синтез білків, зокрема ферментів глюконеогенезу та синтез РНК, а в інших органах, таких як м'язи, шкіра, лімфоїдна і жирова тканини, кістки – значно пригнічують синтез білків і в деяких (лімфоїдна тка- нина, м'язи) навіть призводять до їх розпаду. Гормони також знижу- ють швидкість синтезу РНК у периферичних тканинах (особливо в лі- мфоїдній та м'язовій). Такий характер дії глюко- кортикоїдів збільшує концентрацію вільних амінокислот у плазмі і цим створює оптимальні умови для глюконеогенезу. Цьому сприяє і активація гормонами амінотрансфераз, що призводить до швидкого перетворення амінокислот у кетокислоти та вуглеводи. Посилення деградації амінокислот створює негативний азотистий баланс.
Вплив глюкокортикоїдів на обмін ліпідів у печінці і в периферичних тканинах також має протилежний характер: надмірна кількість гормо-
497
нів стимулює ліпогенез у печінці і ліполіз у периферичних тканинах. По- силення ліполізу в жировій тканині спричиняє підвищення рівня вільних жирних кислот у плазмі крові. Це підвищення пов'язане як із прямою стимуляцією ліполізу, так і зі зниженням споживання глюкози жировою тканиною для утворення гліцерину, що пригнічує синтез триацилгліце- ринів і вивільняє жирні кислоти в плазму. У результаті посилюється їх окислення в печінці, яке забезпечує її енергетичні потреби, а надлишок ацетил-КоА використовується в кетогенезі. Кетонові тіла, що утво- рюються, надходять у кров. Крім прямого впливу на ліпідний обмін, глюкокортикоїди посилюють через цАМФ ліполітичну дію катехоламі- нів, секреція яких підвищується глюкокортикоїдами.
На водно-електролітний обмін глюкокортикоїди чинять схожу з мінералокортикоїдами дію, однак вона більш слабка в порівнянні з останніми.
У високій концентрації глюкокортикоїди пригнічують імунну ре- акцію організму. Вони пригнічують запальні процеси, які запуска- ються реакціями гіперчутливості, обумовленими взаємодією антитіл з антигенами, тобто зменшують стан сенсибілізації (підвищеної чут- ливості до чужорідних агентів), розвиток наступних алергічних реак- цій і запалення. Депресивна дія гормонів на імунні процеси пов'яза- на з їх здатністю зменшувати кількість лімфоцитів і викликати інво- люцію лімфоїдної тканини. Саме з цієї причини глюкокортикоїди служать цінним допоміжним засобом при лікуванні тяжких алергіч- них станів і використовуються для пригнічення реакції відторгнення при трансплантації тканин.
На здатності глюкокортикоїдів пригнічувати запальні реакції засно- ване їх широке використання в клініці. У терапевтичних дозах вони галь- мують практично всі фази запального процесу; блокують розширення ка- пілярів, адгезію і міграцію лейкоцитів, секрецію гістаміну і серотоніну (що має значення в механізмі розвитку алергічних реакцій), утворення кі- нінів, синтез простагландинів та ін. Гальмування синтезу простагланди- нів пов'язано з гальмуванням фосфоліпази А2, що звільняє арахідонову кислоту зі складу фосфоліпідів, яка є попередником простагландинів. У результаті гальмується синтез простагландинів, які стимулюють реакції запалення. Механізм гальмування фосфоліпази А2 полягає в різкому стимулюванні глюкокортикоїдами синтезу і секреції ліпопротеїну, що одержавназвуліпокортин, якийігальмуєфермент.
Глюкокортикоїди підвищують стійкість організму до різноманіт-
них стресорних факторів (хірургічне втручання, травма, інфекції, го- лодування). У цих умовах секреція кортизолу зростає в декілька разів, і якщо реакція послаблена, то значно зменшуються шанси на виживан- ня. Зростає також секреція адреналіну, ефект якого посилюється за- вдяки пермисивній дії глюкокортикоїдів. У таких випадках допомагає замісна терапія даними стероїдами. Глюкокортикоїди впливають на специфічні внутрішньоклітинні процеси шляхом зміни вмісту в клітині критично важливих білків, як правило, ферментів. Це визначається їх- ньою здатністю регулювати швидкість транскрипції специфічних ге- нів. Як і всі стероїдні гормони, вони здатні проникати усередину клі-
498
тин і в цитоплазмі клітин-мішеней з’єднуватися з рецепторним біл- ком, створюючи комплекс. Стероїд-рецепторний комплекс потрапляє в ядро і зв'язується зі специфічними ділянками ДНК поблизу сайту ініціації транскрипції, стимулюючи або гальмуючи синтез білків. Ре- гуляція швидкості транскрипції – це важливий, але не єдиний елемент механізму дії глюкокортикоїдних гормонів. Вони можуть регулювати також процесінг і транспорт ядерних транскриптів, швидкість розпаду специфічних мРНК і посттрансляційний процесінг.
Дія мінералокортикоїдів
Головною мішенню дії найбільш сильного мінералокортикоїду аль- достерону є нирки. Гормон регулює баланс в організмі життєво необхід- них іонів. Він підвищує реабсорбцію в дистальних ниркових канальцях Na+, Cl– і HCO3– із сечі в міжклітинну рідину і далі в кров. Одночасно збі- льшуєтьсяекскреціяізсечею K+ (який унирках обмінюється на Na+), H+ і NH4+. Альдостерон впливає на транспорт іонів і в інших епітеліальних тканинах: потових залозах, слизовій кишечника, слинних залозах. У ре- зультаті ефект гормону проявляється затримкою Na+, Cl–, HCO3– і води в організміівиведеннямзньогоK+, H+, NH4+.
Механізмдіїальдостеронуподібнийдомеханізмудіїіншихстероїдних гормонів. Існує припущення, що гормон індукує утворення одного або де- кількох білків, які збільшують проникність апікальної (люмінальної) мем- брани для Na+, що підвищує його внутрішньо-клітинний рівень, а також стимулює активний транспорт Na+ із клітини в інтерстиціальний простір через базальну мембрану за допомогою Na+, K+-АТФази. Підвищення ак- тивності мітохондріальних ферментів, яке відбувається під впливом аль- достерону, може сприяти збільшенню кількості АТФ і, отже, підвищенню ефективностіроботиNa+, K+-АТФази.
Порушення гормональної функції кори надниркових залоз
Гіпофункція, або гіпокортицизм, проявляється як захворювання, яке називається Адисоновою, або бронзовою хворобою. Воно обумовле- не дефіцитом як глюкокортикоїдів, так і мінералокортикоїдів і про- являється відповідними порушеннями обміну речовин і функцій ор- ганізму. За недостатності глюкокортикоїдів знижується стійкість ор- ганізму до емоційного стресу, дії ушкоджуючих факторів (інфекцій- них, хімічних); спостерігається гіпоглікемія, висока чутливість до ін- суліну, втрата маси тіла. Недостатність альдостерону призводить до порушень водно-електролітного обміну. Організм втрачає натрій і воду, але утримує калій, внаслідок чого розвивається гіпотонія, різка м'язова слабість, прогресуюча стомлюваність – результат порушень калій-натрієвого градієнта на мембрані м'язових клітин (гіперполя- ризація). У хворих часто посилена пігментація шкіри та слизових оболонок, що обумовлено компенсаторно підвищеною секрецією АКТГ та відповідних продуктів проопіомеланокортину.
Гіперфункція або гіперкортицизм, який пов'язаний із надлишком глюкокортикоїдів, називають хворобою Іценко-Кушинга. Вона може бути наслідком виникнення пухлини надниркових залоз (які активно синтезу-
499
ють кортизол), пухлини гіпофізу або наслідком порушення утворення ко- ртиколіберину в гіпоталамусі. При цьому захворюванні знижується толе- рантність до глюкози, виникає гіперглікемія та інші симптоми, які харак- теризують розвиток стероїдного діабету. Різке посилення катаболізму білків спричиняє стоншування шкіри, зменшення м'язової маси і в цілому негативний азотистий баланс. Характерним проявом гіперкортицизму є остеопороз – зміна мінерального складу кісткової тканини, внаслідок чо- го різко знижується міцність кісток. Це може бути наслідком гальмуван- ня кортизолом активності деяких ферментів, які беруть участь в утво- ренні колагену і глікозаміногліканів, що спричиняє порушення синтезу колагену в кістках, а внаслідок цього і включення в кісткову тканину со- лейкальціюіфосфатів.
При гіперкортицизмі, який пов'язаний з підвищеною секрецією альдостерону (хвороба Конна), розвиваються гіпертензія, набряки, гіпернатріємія та алкалоз, а також спостерігається сильна слабість, обумовлена низькою концентрацією К+.
Практичне застосування кортикостероїдів. У медичній практиці широко застосовуються синтетичні препарати кортикостероїдів та їх похідні. Отриманий ряд синтетичних аналогів глюкокортикоїдів (преднізолон, дексаметазон та ін.), які більш активні, ніж природні го- рмони. Препарати глюкокортикоїдів застосовуються при алергічних станах та аутоімунних захворюваннях, таких як ревматизм, ревматої- дний артрит, колагенози, бронхіальна астма, нейродерміти, як імуно- депресивні, протизапальні, десенсибілізуючі засоби. Із аналогів міне- ралокортикоїдів найбільш широке застосування має дезоксикортикос- терон при хворобі Аддісона, міастенії, загальній м'язовій слабкості. Імунодепресивна дія глюкокортикоїдів дозволяє використовувати їх при трансплантації органів і тканин для пригнічення реакції відторг- нення. Однак при вживанні препаратів кортикостероїдів можуть ви- никнути побічні ефекти, тому їх використання в медичній практиці потребує великої обережності й чіткого знання показань та протипо- казань до застосування.
Гормони статевих залоз
Статеві залози (гонади) – парні органи, представлені в чоловіків сім’яниками, у жінок – яєчниками. Сім’яники та яєчники – залози змішаної секреції. Їхня екзокринна функція полягає в утворенні ста- тевих клітин (сперматозоїдів або яйцеклітин), а ендокринна – в біо- синтезі та секреції статевих гормонів. Попередником для синтезу всіх статевих гормонів є холестерин; багато стадій їх утворення збі- гаються, тому невелика кількість чоловічих і жіночих статевих гор- монів синтезуються в істот обох статей.
Нормальне функціонування статевих залоз, пов'язане з їх структур- ною та гормональною цілісністю, необхідне для розмноження, а отже, і для виживання видів. Розвиток статі і формування вторинних статевих ознак залежить від особливостей секреції статевих гормонів, які окрім своєї основної функції– впливу на розмноження, беруть участь і в інших важливих процесахорганізму.
500
