
voronina
.pdfсистеми поділяються на дві групи: диоксигенази і монооксигенази. Диоксигенази каталізують реакції, в яких у молекулу органічного субстрату включаються обидва атоми кисню: А + О2 → АО2. Моно- оксигенази (цю групу ферментів називають також гідроксилазами) приєднують до субстрату тільки один із двох атомів кисню. Як пра- вило, постачальником атомів водню для відновлення другого атома кисню до води служить НАДФ Н і рідше – НАДН, наприклад:
RH + O2 + НАДФ Н +Н+  ROH + H2O + НАДФ+
ROH + H2O + НАДФ+
Джерелом НАДФ Н є пентозофосфатний шлях перетворення глюкози, а НАДН – гліколіз.
Біологічне окислення, що каталізується системами мікросома- льних ферментів, включає широке коло реакцій, але багато з них можуть бути зведені до одного загального механізму – гідроксилю- вання, тобто включення гідроксильної групи до складу молекули субстрату, який окислюється, у тому числі й лікарської речовини. Слід зазначити, що гідроксилювання – дуже поширена реакція. Гід- роксильна група може бути введена не тільки при окисленні, але й при відновленні та гідролізі. Однак найпоширенішим є окислюваль- не гідроксилювання. Мікросомальний ланцюг ферментів, що здійс- нює гідроксилювання, достатньо вивчений. Він містить НАДФ Н, флавопротеїн (ФП), коферментом якого служить ФАД, білок (адре- нодоксин), що містить негемове залізо, і гемопротеїн, який познача- ється як цитохром Р-450. Флавопротеїн має НАДФ·Н-дегідрогеназну активність, причому ФАД акцептує 2Н+ і 2е–. З флавопротеїнів елек- трони транспортуються на залізовмісний білок, потім – на цитохром Р-450, а протони – в оточуюче середовище. Цитохром Р-450 являє собою складний фермент – фосфоліпідпротогемсульфідпротеїновий комплекс. Білкова частина його представлена одним поліпептидним ланцюгом. Молекулярна маса цитохрому Р-450 становить близько 50000. У відновленій формі споріднений до оксиду вуглецю (СО). Такий комплекс має максимум поглинання при 450 нм. Звідси і ви- никла назва цього цитохрому. Цитохром Р-450 виявлено в мікросо- мах печінки, у мікросомах і мітохондріях кори надниркових залоз, проте в мікросомах мозку і скелетної мускулатури його не знайдено. Виділити цитохром Р-450 із мембран дуже важко, бо він легко пере- творюється в неактивну форму – цитохром Р-420.
Основна роль монооксигеназного ланцюга полягає в гідрокси- люванні, тому флавопротеїни і цитохроми, які функціонують у цьому ланцюзі окислення, дуже відрізняються від ферментів дихального мітохондріального ланцюга. У загальному вигляді ланцюг переносу електронів у мікросомах, за участю якого здійснюється гідроксилю- вання, поданий на рис. 95.
571

Рис.95. Схематичне зображення монооксигеназного ланцюга мікросом: ФП – флавопротеїн, кофактором якого служить ФАД; Fе-білок – білок, який містить негемове залізо; RH – субстрат окислення; Р-450 – цитохром Р-450
Електрони НАДФ Н, які мають високий енергетичний потенціал, переносяться на флавопротеїн цього ланцюга; потім вони передають- ся на адренодоксин (білок, який містить негемове залізо); останній переносить електрони на окислену форму цитохрому Р-450, після чого відновлена форма Р-450 активує кисень. Вважається, що цитохром Р-450 виконує подвійну функцію. По-перше, він зв'язує субстрат гідро- ксилювання, по-друге, – активує молекулярний кисень з утворенням радикалів •ОН, НО2• та ін. При цьому активований кисень використо- вується для окислення речовини (R) та утворення води. Як результат один атом кисню включається в речовину (RОН), що окислюється, а інший, зв’язуючи два іони Н+ із середовища, входить до складу води. Велике значення має мікросомальне окислення у метаболізмі лікарсь- ких речовин і ряду токсичних сполук.
Іноді помилково вважають, що монооксигеназний ланцюг мік- росом печінки призначений тільки для окислення ксенобіотиків. На- справді ж він служить універсальною системою окислення неполяр- них сполук будь-якого походження. Цитохром Р-450 не є специфіч- ним до якогось певного субстрату. Субстрат, що окислюється цито- хромом Р-450, мусить відповідати одній вимозі – бути неполярним. У даному випадку проявляється специфічність не до структури, а до фізико-хімічних властивостей субстрату. При цьому джерелом кисню гідроксильної групи є не вода, а молекулярний кисень.
У наш час відомо понад 7000 сполук, здатних окислюватися за участю монооксигеназного ланцюга. При цьому гідроксилювання робить сполуку більш полярною. Як результат та чи інша потенційно токсична речовина легше розчиняється у водному середовищі, зазнає подальших перетворень і виводиться з організму. На жаль, іноді бу- ває навпаки. Наприклад, монооксигеназний ланцюг, окислюючи не- токсичний бензпірен (міститься в тютюновому димі, копченостях, у вихлопних газах автомобілів), призводить до утворення токсичного гідроксибензпірену, який є сильним канцерогеном.
Таким чином, мікросомальне окислення відрізняється від мі- тохондріального, де провідну роль відіграють реакції дегідруван- ня, а кисень є кінцевим акцептором електронів і використовується лише для утворення води. У процесі мікросомального окислення активний кисень безпосередньо впроваджується в сполуку, яка окислюється. При цьому функціональна роль мітохондріального і
572

мікросомального окислення в клітині різна. Мітохондріальне оки- слення – це механізм використання кисню в біоенергетичних про- цесах. При цьому енергія, що вивільняється, завдяки спряженню з фосфорилюванням, акумулюється в АТФ. Мікросомальне гідро- ксилювання не супроводжується утворенням АТФ, тому його роз- глядають як вільне окислення.
Механізм гідроксилювання лікарських речовин включає ряд ос- новних стадій:
1.Зв'язування окисленої форми цитохрому Р-450 із субстратом, зокрема з лікарською речовиною (ЛР):
2.Відновлення фермент-субстратного комплексу:
3.Утворенняпотрійногофермент-субстратногокомплексузкиснем:
4.Утворення активної форми кисню і приєднання його до ЛР:
Утворений комплекс містить лабільний зв'язок, з розривом яко- го може відбутися впровадження одного із атомів кисню в молекулу ЛР, що окислюється.
5. Розпад комплексу на гідроксильовану ЛР, цитохром Р-450 і молекулу води:
Таким чином, унаслідок цієї багатостадійної реакції один із ато- мів молекулярного кисню використовується для гідроксилювання лікарської речовини, а інший іде на утворення води. Багато момен- тів цього механізму функціонування цитохрому Р-450 ще потребують уточнень і експериментальних доказів.
Швидкість реакції гідроксилювання змінюється під впливом ба- гатьох зовнішніх факторів (гіпоксії, гіпероксії, радіації), унаслідок ін- токсикації окремими ксенобіотиками та під впливом ряду біологічно
573

активних речовин (вітамінів, гормонів). Кількісне визначення актив- ності цитохрому Р-450 має практичне значення під час вивчення функ- ції мікросом як у нормі, так і у випадку патології, а також для встанов- лення ступеня забруднення навколишнього середовища.
Біохімічна трансформація лікарських речовин
ворганізмі (доля ліків в організмі)
Ворганізмі людини і тварин відбуваються різноманітні процеси перетворення лікарських речовин, що позначається на їхній фармако- логічній активності. Сутність процесів метаболізму лікарських сполук
полягає в перетворенні їх у найбільш прийнятну для виведення з ор- ганізму форму. Метаболічні перетворення лікарських речовин при- зводять до введення в їхню молекулу нових полярних функціональних груп (–ОН, –NH2, –SН, –СООН та ін.), які можуть послаблювати або посилювати їхню фармакологічну дію і токсичність, а також спричи- няти дезактивацію або активацію метаболітів. Далі при взаємодії лі- ків і їхніх метаболітів з ендогенними молекулами нормального обміну організму (УДФГК, ФАФС, ацетил-КоА, амінокислотами тощо) від- бувається блокування функціональних груп з утворенням більш поля- рних і водорозчинних молекул та їхня дезактивація.
Окремі лікарської сполуки в організмі не зазнають метаболізму і виділяються з нього в незмінному вигляді (закис азоту, значною мі- рою етиловий ефір, хлороформ, веронал тощо). Однак метаболічна інертність є відносною і застосування більш чутливих методів біофа- рмацевтичного аналізу виявляє ознаки метаболізму. Наприклад, сно- творний засіб веронал, після введення в організм, на 95% виводиться із сечею в незмінному вигляді і тільки 5% метаболізується шляхом гі- дроксилювання. Більшість лікарських речовин зазнає в організмі різ- них метаболічних перетворень, даючи один і більше метаболітів. Так, виявлено 6 метаболітів мепробамату, 11 – апресину, понад 15 продук- тів перетворення аміназину (Ж.Хірц, 1975 р.).
Вивчення метаболізму й характеру дії метаболітів дозволяє під- вищити ефективність та безпеку лікування.
У процесі метаболізму лікарських речовин відмічаються:
1. Інактивація (дезактивація) лікарського препарату, тобто втра- та лікарської або біологічної активності і токсичності. Як приклад ін- активації можна навести перетворення фенобарбіталу (люміналу):
574

Як інший приклад інактивації лікарського засобу можна навести перетворення антимікробних сульфаніламідів шляхом приєднання ендогенного субстрату ацетил-КоА.
Отже, більшість ліків, після завершення певної дії, інактивують- ся в організмі через утворення нетоксичних проміжних сполук, які легко виводяться з нього.
2. Посилення токсичності лікарського препарату (токсифіка- ція). Наприклад, жарознижуючий, болетамуючий та протизапальний препарат фенацетин під час метаболізму утворює парафенетидин, який викликає гіпоксію за рахунок утворення метгемоглобіну.
Останніми роками встановлено, що фенацетин зобов'язаний своєю анальгетичною дією парацетамолу – одному з продуктів його метаболізму (див. нижче). Це призвело до впровадження в лікарську практику парацетамолу, котрий менш токсичний, ніж фенацетин, при його вживанні менш ймовірна небезпека утво- рення метгемоглобіну.
Коли проміжні продукти метаболізму лікарської речовини більш токсичні, ніж самі ліки і можуть викликати побічні важкі ефекти – то така речовина не може бути лікарським засобом. Наприклад, препа- рат талідомід (ФРН), який випускався раніше і використовувався як седативний засіб, давав за певних умов серйозну побічну дію. Так, виявилося, що при рН середовища 6,0–6,5 талідомід дає 12 різних метаболітів і серед них – ацилюючий агент, який викликає терато- генну дію (від грецьк. teratos – виродок). Як наслідок відмічалося на- родження дітей із ластоподібними, як у тюленя, кінцівками. У зв'язку з цим, у разі впровадження нових лікарських препаратів обов'язко- вою вимогою Фармакологічного Комітету є вивчення їх тератоген- ної та ембріотоксичної дії.
575

3. Активація, тобто виявлення активності неактивного медика- менту. Деякі лікарські засоби самі по собі не виявляють фармаколо- гічної дії, і тільки в організмі в процесі метаболізму набувають її. Для цього необхідна наявність відповідних ферментів. Коли їх немає або недостатньо, то процес активації не відбувається і лікувального ефекту не спостерігається. Неактивний препарат, накопичуючись, може викликати ускладнення, отруєння. Наприклад, протималярій- ний засіб бігумаль (прогуаніл) стає активним після метаболічного перетворення – циклізації в 1,3,5-триазинове похідне:
Новарсенол і міарсенол перетворюються в тканинах на арсенок- сид, який має більш сильний спірохетоцидний ефект.
Уротропін, який у кислому середовищі в сечоводах перетворюється на формальдегід, що має бактерицидну дію, знайшов застосування в урологічній практиці. Улужномусередовищі вінне активний.
4. Посилення активності лікарської речовини. Наприклад, боле- тамуючий анальгетик кодеїн, деметилюючись, тобто втрачаючи СН3- групу, перетворюється на морфін, який справляє сильнішу дію (нар- котичний анальгетик).
5. Зміна спрямованості фармакологічної дії в процесі модифі- кації препарату в організмі. Наприклад, стимулятор центральної нервової системи іпроніазид (N-ізопропілізонікотиновий гідра-
576
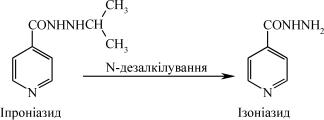
зид), метаболізуючись шляхом N-дезалкілування, перетворюється на ізоніазид – препарат протитуберкульозної дії.
Основні реакції перетворення лікарських речовин
Лікарські ксенобіотики можуть проходити під час свого метабо- лізму дві фази: модифікації (несинтетична) і кон'югації (синтетич- на). Фаза модифікації – це процес метаболічних перетворень лікар- ських речовин відповідними ферментами (оксидоредуктазами, гід- ролазами, ізомеразами, ліазами). Такі перетворення ведуть до по- рушення структури речовин у зв'язку з окисленням, відновленням, дезалкілуванням, дезамінуванням, циклізацією, дециклізацією (роз- ривом кільця), гідролізом та іншими модифікаційними реакціями. Як результат зникають одні функціональні групи і з'являються інші (–СООН, –ОН, –NH2, –SН та інші). При цьому молекули, які важко матаболізуються, стають більш полярними і можуть виводитися в такому вигляді через нирки або з'єднуватись з іншими сполуками (кон'югація) і також виводитися.
У другій фазі важливу роль відіграють біосинтетичні кон’юга- ційні механізми. Це здійснюється шляхом приєднання до молекул фармпрепаратів і їхніх метаболітів різних сполук, які містяться в організмі (глюкуронової, оцтової, сірчаної кислот, амінокислот, пептидів тощо), а також внаслідок реакцій детоксикації, що відбу- ваються за участю сульфгідрильних груп.
Унаслідок кон’югаційного метаболізму ліпофільні, важкороз- чинні у воді молекули стають, як правило, більш водорозчинними, тобто полярними сполуками, що полегшує подальше виведення їх з організму нирками.
Деякі лікарські речовини метаболізуються тільки в одну фазу, інші – у дві.
Фаза модифікації. Під впливом мікросомальних ферментів лікарські речовини зазнають різноманітні хімічні перетворення, які відносяться переважно до реакцій окислення. Більшість з них можуть бути зведені до загального механізму – гідроксилюван- ня, тобто появи гідроксигрупи в речовині, що окислюється. Гід- роксилююча система, як уже зазначалося, включає НАДФ Н, ФП, білок, який містить негемове залізо, цитохром Р-450 (його ізо- ферменти) і кисень. Отже, у разі недостатнього постачання ор-
577

ганізму киснем (особливо печінки), процес окислення фармпре- паратів значно сповільнюється, що негативно впливає у випадку отруєння лікарськими речовинами та порушення функцій печін- ки внаслідок її ураження.
Шляхом гідроксилювання протікають реакції аліфатичного, алі- циклічного, ароматичного і гетероциклічного окислення; О-, S-, N- дезалкілування, дезамінування, сульфоокислення тощо.
1. С-гідроксилювання - поява ОН-групи біля атома вуглецю: а) аліфатичних сполук (угрупувань), загальний вигляд:
Наприклад:
б) аліцикличних сполук, загальний вигляд:
578
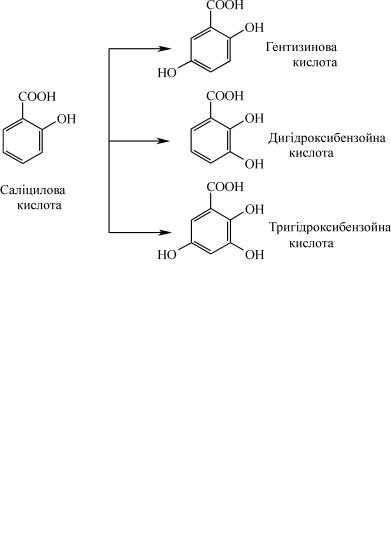
Наприклад:
в) ароматичних сполук, загальний вигляд:
Наприклад:
г) гетероциклічних сполук з одним гетероатомом.
У випадку гетероциклічних азотистих сполук, таких, як піридин, гідроксилювання проходить у третьому положенні, а якщо бензоль- не кільце приєднане до гетероциклу, то гідроксилювання проходить, окрім того, і в орто- і в пара-положеннях відносно атома азоту, тоб- то в положеннях 3-, 6-, 8-.
579

Загальний вигляд:
2. N-гідроксилювання – приєднання гідроксильної групи до атома азоту. Ароматичні аміни зазнають гідроксилювання аміногрупи, утворюючи гідроксиамінові сполуки.
Загальний вигляд:
Наприклад:
580
