
- •Строения атома
- •Анализ радиальной части
- •Вывод
- •Энергетическая
- •Анализ выражения для Е
- •Спектры атомов
- •Правила отбора для
- •Спектральные серии
- •Правила запрета спектральных
- •Атомно –эмиссионные
- •Взаимосвязь квантовых чисел l и m
- •Спин электрона. (Уленбек и Гаудсмит)
- •Спин-орбиталь электрона
- •Спин – орбитальное расщепление линий
- •Тонкая структура спектральных линий
- •Типы CОB атомов
- •Магнитные свойства электрона
- •Эффект Зеемана
- •Многоэлектронный
- •Приближенные методы решения уравнения Шредингера
- •Метод Слейтера.
- •Метод Слейтера.
- •Метод Слейтера.
- •Атомная орбиталь
- •Константы экранирования и эффективные заряды Z ядер атомов.
- •Выводы
- •Выводы
- •Распределение атомных орбиталей по энергии.
- •ПРАВИЛА
- •ПРАВИЛА
- •Проверка
- •Полная волновая функция атома.
- •Полная волновая функция
- •АТОМНЫЙ ТЕРМ
- •Составляющие механического момента многоэлектронного атома.
- •Составляющие механического момента многоэлектронного атома
- •АТОМНЫЙ ТЕРМ
- •Мультиплетность терма
- •Квантовое число L
- •Энергетическая диаграмма атома С
- •Микросостояния электронов в С
- •Микросостояния электронов в С
- •Строения атома

 Строения атома
Строения атома 
Лекция 5
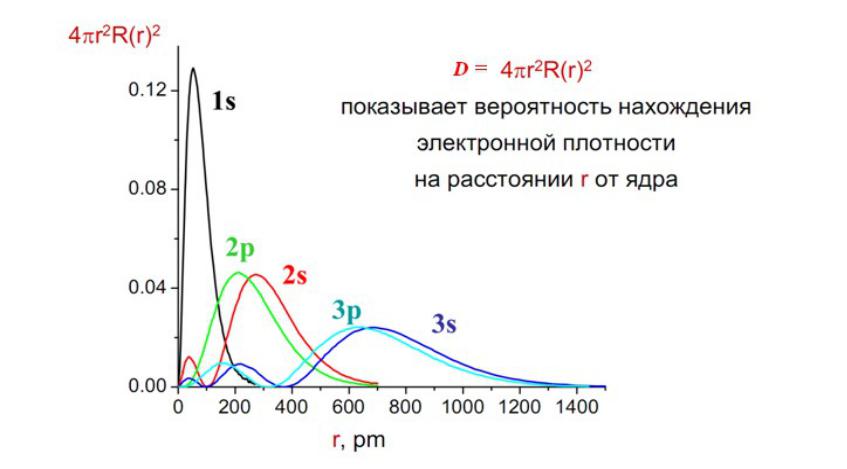
Анализ радиальной части
Вывод
•Радиальная часть волновой функции является индивидуальной характеристикой каждого атома и распределение электронной плотности реализуется совокупностью гармоник с различным значением азимутального квантового числа l.
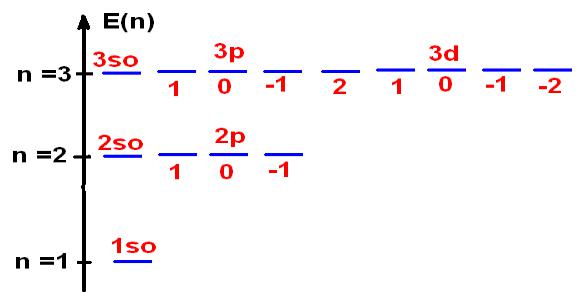
Энергетическая
диаграмма.
E |
Z 2 me e4 |
|
Z 2 me e4 |
|
|
Z 2 |
|||||||
2 |
|
2 |
(ýðã) |
|
|
|
|
|
(äæ ) |
|
|
(àò .åä) |
|
|
2 |
2 |
|
4 0 |
2 |
2n |
2 |
||||||
|
2n |
|
|
2n |
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
n=1 E = -Z2/2n2 = -1/2 а.е. = -1/2*27,2 эВ = - 13,6 эВ
n=2 E = -Z2/2n2 = -1/8 а.е. = - 3,4 эВ
n=3 E = -1/18 а.е. = - 1,51 эВ
Анализ выражения для Е
1.Энергия электрона в атоме квантуется.
2. Разница энергий АО при переходе с n1 на n2 = n1+1 уменьшается по мере увеличения n
E = -Z2me4/(4 0 )2 2 2 * (1/ n12 - 1/ n22 ) (дж)
•3. АО с одним значением n имеют одинако-вые значение энергии т.к. Е = f(n) , т.е. они вырождены. Степень вырождения равна n2
АО =1 при n=1; АО =4 при n=2; АО = 9 при n=3
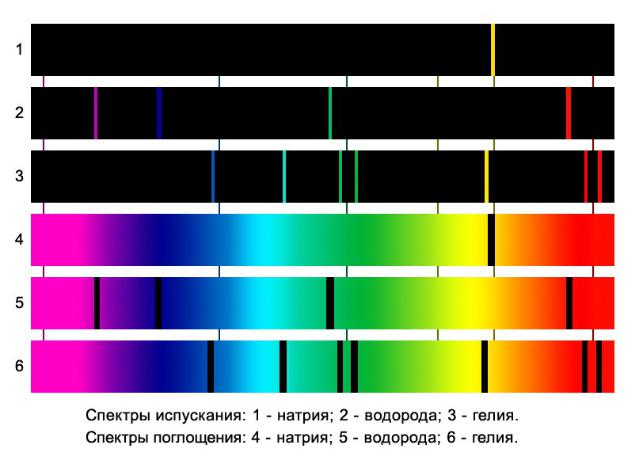
Спектры атомов
Правила отбора для
переходов с АО
• Состояние атома с наименьшей энергией
Е(n) называют основным состоянием n =1
• Правила отбора
n – любое, l = 1
•Это означает, что разрешенными являются переходы лишь с s-AO на p-AO, между
p-AO на d-AO и т.д.
•Вероятность переходов, не разрешенных правилами отбора практически равна нулю.
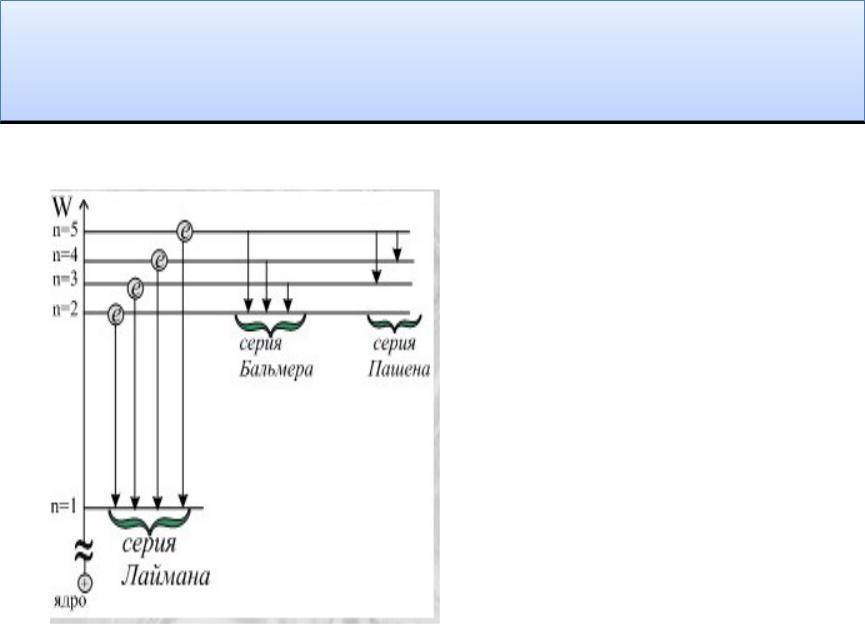
Спектральные серии
• = Ry* (1/ n12 - 1/ n22 )
Ry= me4/8 20 h3 c = 1,09737* 107 м-1
Серия Лаймана 1s np |
n1 =1 |
n2 =2,3,4,5… |
||
Серия Бальмера 2р ns n1 =2 |
n2 |
|
||
=3,4,5,6… |
|
|
|
|
Серия |
Пашена |
n1 =3 |
n2 |
|
=4,5,6,7… |
|
|
|
|
Серия |
Брэккета |
n1 =4 |
n2 |
|
=5,6,7,8… |
|
|
|
|
Серия |
Пфунда |
n1 =5 |
|
|
|
|
|||
Правила запрета спектральных
переходов
l = 1 n-любое
n = 1, l = 0 - 1s
n = 2, l = 0,1 - 2s,2p
n = 3, l = 0,1,2 3s,3p,3d
n = 4, l = 0,1,2,3 - 4s,4p,4d,4f

Атомно –эмиссионные
спектрометры
•Выбор самой интенсивной полосы перехода позволяют создать приборы – атомно – эмиссионные спектрометры. Состоит из датчиков настроенных на каждый элемент, т.е. на резонансную частоту. Чувствительность
метода огромная - несколько
атомов на 1 гр вещества.
